قاعده اکتت یا اوکتت (octet) یا قاعده هشتایی یا یک قاعده معروف شیمی می باشد و بیان می کند که اتم ها تمایل دارند هشت الکترون در لایه والانس خود داشته باشند. اوربیتال های لایه ظرفیت گازهای نجیب، پر شده است و سبب می شود که آنها نسبت به تمام عناصر، پایدارتر باشند. بنابراین عناصر نیز علاقه دارند مانند گازهای نجیب به حالت پایدار برسند. در نتیجه اتم ها، برای رسیدن به آرایش گازهای نجیب، باید آرایش لایه والانس خود را به آرایش آنها (ns²np۶) برسانند. در ادامه این مقاله در نشریه جهان شیمی فیزیک به بررسی عدد اکسایش و نحوه محاسبه آن پرداخته می شود. لطفا با ما همراه باشید.
قانون اکتت
عناصر گروه های اصلی جدول تناوبی در لایه والانس خود، کمتر از ۸ الکترون دارند. بنابراین این عناصر تمایل دارند که با گرفتن، از دست دادن و یا به اشتراک گذاشتن الکترون به آرایش الکترونی پایدار گاز نجیب برسند. به این قاعده، قاعده هشت تایی یا اوکتت گفته می شود. همچنین به آرایش الکترونی اتم ها در این حالت، آرایش الکترونی هشتایی پایدار می گویند، زیرا این اتم ها اوربیتال های s و p بیرونی پر شده دارند.
به طور کلی، فلزات (که تعداد الكترون هاي لايه ظرفیت آنها ۱، ۲، ۳ و يا حداكثر ۴ تا است) با از دست دادن الکترون های ظرفیت خود و تشکیل کاتیون، به آرایش الکترونی هشتایی گاز نجیب پيش از خود در جدول تناوبي می رسند. در واقع عناصر گروه اول جدول تناوبی با از دست دادن ۱ الکترون، گروه دو با از دست دادن ۲ الکترون و آلومنيوم در گروه سوم اصلی با از دست دادن ۳ الکترون به آرايش گاز نجيب ماقبل از خود مي رسند.
در مقابل نا فلزات (كه تعداد الكترون هاي لايه ظرفیت آنها بين ۴ تا ۷ می باشد)، با گرفتن تعداد معینی الکترون و تشکیل آنیون به آرايش گاز نجیب هم دوره خود در جدول تناوبي دست پیدا می کنند. عناصر گروه نیتروژن با گرفتن ۳ الکترون، گروه اکسیژن با گرفتن ۲ الکترون و عناصر گروه هالوژن ها با گرفتن ۱ الکترون به آرايش گاز نجيب هم دوره خود مي رسند.
لازم به ذکر است که تنها گازهای نجیب با پیروی از قاعده اکتت و داشتن هشت الکترون در لایه ظرفیت، بار خنثی دارند. درحالیکه سایر عناصر، زمانی که به صورت منفرد و تنها باشند، با پیروی از قاعده اکتت، باردار خواهند بود.
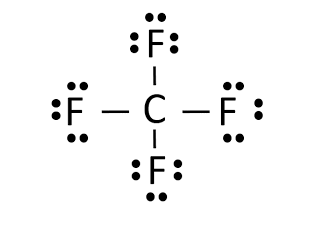
همانطور که مشخص است این قاعده هم در ترکیبات یونی و هم در ترکیبات کووالانسی کاربرد دارد. به عنوان مثال ترکیب یونی NaCl را در نظر بگیرید. در این ترکیب اتم سدیم با از دست دادن یک الکترون خود در لایه والانس، به آرایش الکترونی گاز بی اثر نئون می رسد. از طرف دیگر اتم کلر که در لایه والانس خود ۷ الکترون دارد و با جذب یک الکترون اتم سدیم، قاعده اکتت خود را تکمیل میکند. به عنوان نمونه از ترکیبات کووالانسی، ساختار لوویس مولکول CF۴ به شکل زیر می باشد. همانطور که مشخص است هر اتم، هشت الکترون و آرایش اکتت یا هشتایی دارد.
کاربرد قاعده هشتایی
با کمک قاعده اکتت می توان میزان واکنش پذیری، پایداری و نوع پیوند های بین اتم ها را توضیح داد. در حقیقت این قاعده بیانگر تمایل عناصر متعلق به گروه های اصلی جدول تناوبی برای واکنش با دیگر عناصر و در نتیجه تشکیل ترکیب و پایدار شدن می باشد. قابل توجه است كه بیست عنصر اول جدول تناوبی (اتم هایی با عدد اتمی کمتر از ۲۰)، تمایل بسیار زیادی به پیروی از قاعده اکتت دارند.
استثنا های قاعده اکتت
بسیاری از ترکیبات از قاعده هشتایی تبعیت می کنند، در عین حال ترکیبات فراوانی هم داریم که از این قاعده پیروی نمی کنند. به طور کلی می توان گفت سه دسته از ترکیبات استثنا برای قاعده اکتت می باشند که در ادامه قصد داریم تا به بررسی این موارد بپردازیم.
هیدروژن و لیتیوم
اتم های هیدروژن و لیتیم از قاعده دوتایی پیروی می کنند نه قاعده هشتایی. در واقع هیدروژن و لیتیوم در لایه ظرفیت خود تنها یک الکترون دارند. هیدروژن برای رسیدن به آرایش الکترونی پایدار (گاز نجیب هلیوم)، تنها به یک الکترون دیگر نیاز دارد. بنابراین یک الکترون را از طریق پیوند کووالانسی به اشتراک میگذارد یا به یون هیدرید (–H) تبدیل میشود. درحالیکه لیتیوم با از دست دادن یک الکترون و تشکیل پیوند یونی با سایر عناصر به چنین آرایشی دست پیدا میکند. بنابراین هیدروژن و هلیوم در نهایت در لایه والانس خود دو الکترون (با آرایش مشابه اتم هلیوم) دارند.
رادیکال های آزاد
بیشتر ترکیبات پایدار و یا یون های پیچیده دارای جفت الکترون می باشند. دسته ای از ترکیبات وجود دارند که تعداد الکترون های والانس در آنها عددی فرد است که به نام رادیکال های آزاد مشهورند مانند NO۳ ،NO و NO۲. توجه داشته باشید که رادیکال های آزاد، بسیار واکنش پذیر و نا پایدار می باشند. با توجه به ساختار لوییس آنها مشخص می شود که حداقل یک الکترون به صورت جفت نشده و تنها باقی خواهد ماند.
به عنوان نمونه تعداد الکترون های ظرفیت در مولکول NO برابر با ۱۱ الکترون ( ۱۱ = ۵+۶) می باشد. بهترین ساختار لوویس برای NO به شکل زیر می باشد. در این حالت نیتروژن یک تک الکترون و در اطراف اکسیژن، دو جفت الکترون قرار گرفته است. بنابراین همان طور که در شکل مشخص است در اطراف اتم نیتروژن ۷ الکترون وجود دارد نه ۸ الکترون، بنابراین اتم نیتروژن در مولکول NO از قاعده اکتت پیروی نکرده است.
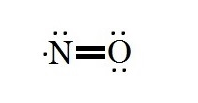
این ترکیبات در واکنش هایی شرکت می کنند تا در نهایت از قاعده اکتت تبعیت نمایند. به ساختار محصول که از قاعده هشتایی تبعیت می کند توجه کنید. به عنوان مثال داریم:
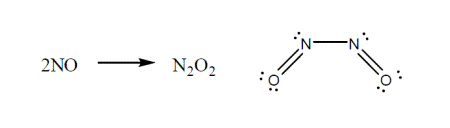
ترکیباتی که کمبود الکترون دارند
ترکیباتی که کمبود الکترون دارند (مانند BeF۲، BF۳، SnCl۲ و AlCl۳). اتم هایی مانند بریلیم، بور و یا آلومینیوم موقع تشکیل ترکیب تعداد الکترون هایی کمتر از هشت تا دارند. اتم بریلیم دو الکترون ظرفیت دارد و فقط می تواند دو پیوند در دو مکان تشکیل دهد. اتم های آلومینیوم یا بور دارای سه الکترون ظرفیت می باشند. به عنوان مثال ترکیب BCl۳ را در نظر بگیرید. هر اتم بور از سه الکترون والانس خود برای تشکیل سه پیوند کووالانسی با سه اتم کلر استفاده می کند. بنابراین در اطراف اتم بور فقط شش الکترون داریم نه هشت الکترون.
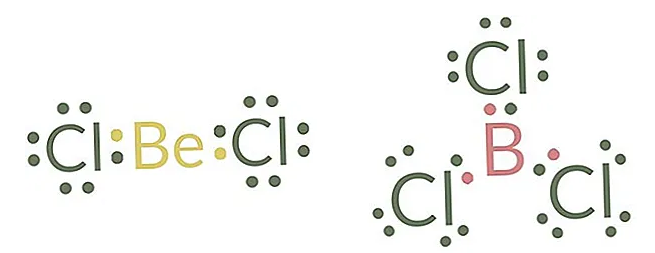
لازم به ذکر است که این ترکیبات نیز در واکنش هایی شرکت می کنند تا از قاعده اکتت تبعیت نمایند. مثال زیر را در نظر بگیرید. در این مثال به ساختار محصول که از اکتت تبعیت می کند، دقت کنید.
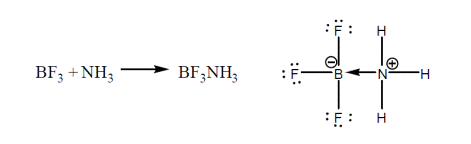
مواردی که از قاعده اکتت تبعیت نمی کنند
عناصر دوره سوم به بعد اوربیتال d دارند، بنابراین می توانند لایه ظرفیت خود را گسترش دهند. در واقع این ترکیبات از لایه والانس گسترش یافته استفاده می کنند و در هنگام تشکیل پیوند از این اوربیتال ها بهره می برند. در این حالت می توانند بیش از هشت الکترون را در لایه ظرفیت خود جای دهند، بنابراین دیگر از قاعده اکتت پیروی نمی کنند. به عنوان مثال مولکول های SF۴ و SF۶ را در نظر بگیرید. اتم گوگرد در مولکول SF۴ دارای ۱۰ الکترون و در مولکول SF۶ دارای ۱۲ الکترون می باشد. مولکول های PF۵، IF۳، IF۵، IF۷ و –I۳ همگی مثال هایی از این موارد می باشند
توجه داشته باشید که عناصر دوره دوم اوربیتال d ندارند، بنابراین نمی توانند لایه والانس خود را گسترش دهند. به همین علت این عناصر بیش از هشت الکترون در لایه والانس نخواهند داشت. در نتیجه مولکول هایی مانند NF۵،OF۴ یا OF۶ وجود ندارند. از طرفی، فلزات واسطه به دلیل داشتن اربیتال d از قاعده ۱۸ تایی پیروی می کنند نه قاعده اکتت.
آرایش الکترونی عناصر
آرایش الکترونی عناصر اساساً یک «آدرس» است که نشان میدهد الکترونها در کجای یک اتم قرار دارند. ما از مدل موج-مکانیکی هنگام ایجاد پیکربندی های الکترونی استفاده می کنیم. به یاد داشته باشید که مدل موج-مکانیکی دارای سطوح انرژی اتمی است که به “سطوح فرعی” تقسیم می شوند، که بیشتر به “اوربیتال” تقسیم می شوند. هر چه سطح انرژی از هسته دورتر باشد، انرژی بیشتر می شود و الکترون های بیشتری می توانند در فضای بزرگتر جای بگیرند. اولین سطح انرژی، نزدیکترین سطح به هسته، تنها برای یک سطح فرعی – به نام سطح فرعی ۱s – فضا دارد که یک مدار را در خود جای می دهد. هر اوربیتال، صرف نظر از اینکه در کدام سطح فرعی یا سطح انرژی قرار دارد، حداکثر می تواند دو الکترون را در خود نگه دارد. بنابراین اولین سطح انرژی می تواند دو الکترون را در خود نگه دارد.
اگر یک اتم بیش از دو الکترون داشته باشد، آنها در سطوح انرژی بالاتری یافت می شوند. در سطح انرژی دوم فضای بیشتری نسبت به سطح انرژی اول وجود دارد و می بینیم که دو سطح فرعی وجود دارد که به آنها زیرسطح های ۲s و ۲p می گویند. سطح فرعی ۲s فقط یک اوربیتال دارد که می تواند دو الکترون را در خود نگه دارد، اما سطح فرعی ۲p دارای سه اوربیتال است که در مجموع می تواند شش الکترون (دو الکترون در هر اوربیتال) را در خود جای دهد.
برای اتمهایی که فقط چند الکترون دارند، ترتیبی که الکترونها سطوح انرژی را پر میکنند دقیقاً به روشی است که ما پیشبینی میکنیم: دو الکترون اول زیرسطح ۱s را پر میکنند، دو الکترون بعدی به سطح فرعی ۲s میروند، شش الکترون بعدی. به ۲p بروید و غیره. با این حال، هنگامی که به سطح انرژی سوم می رسیم، همه چیز کمی عجیب می شود. معلوم شد که برای رفتن یک الکترون به اوربیتال ۴s انرژی کمی کمتر از اوربیتال ۳ بعدی لازم است و بنابراین ۴s قبل از اینکه الکترون ها ۳d را پر کنند پر می شود.