مولالیته (Molality)، یا غلظت مولال (Molal) نوعی از غلظت می باشد که در علم شیمی برای تعیین غلظت محلول ها به کار می رود. مولالیته که با نماد m نشان داده می شود، با تعداد مول های حل شونده در یک کیلوگرم حلال تعریف می شود. در این مقاله در نشریه جهان شیمی فیزیک، توضیحات بیشتری در رابطه با مولالیته، نحوه محاسبه و اهمیت آن در واکنش های شیمیایی ارائه شده است. لطفا با ما همراه باشید.
فهرست مطالب این مقاله
۱- تعریف و مفهوم مولالیته
۲- محاسبه مول یا گرم با استفاده از مولالیته
۳- تهیه محلول های مولال
۴- مزیت محلول های مولال
۵- کاربرد مولالیته
۶- تفاوت بین مولالیته و مولاریته
تعریف و مفهوم مولالیته
کمیت های زیادی برای بیان غلظت محلول در علم شیمی وجود دارند. به عنوان مثال از آنجایی که در آزمایشگاه، تهیه یک محلول مولار با سرعت و سادگی انجام می شود، بنابراین برای انجام کارهای معمولی و روزمره از مولاریته بهره می برند. در حالیکه برای انجام کارهای خیلی دقیق آزمایشگاهی و به خاطر کاهش دادن خطای حجم که در اثر تغییرات دما بوجود می آید، مولالیته را بر مولاریته ترجیح می دهند. زیرا همانطور که می دانید، متاسفانه غلظت مولار یا همان مولاریته با تغییر دما اندکی تغییر می کند.
لازم به ذکر است که تعدادی از خواص محلول ها به جای آنکه به ماهیت محلول وابسته باشند به غلظت ذرات ماده حل شده در آن بستگی دارند. بنابراین در محاسبات این خواص از جمله خواص کولیگاتیو، بهتر است از کمیت هایی استفاده شود که به دما وابسته نیستند. بر خلاف مولاریته، مولالیته یک محلول معین با تغییر دما تغییر نمی کند. زیرا در این حالت محلول بر مبنای جرم اجزای سازنده آن تهیه شده است، در نتیجه تغییر دما، تغییری در وزن ایجاد نخواهد کرد.
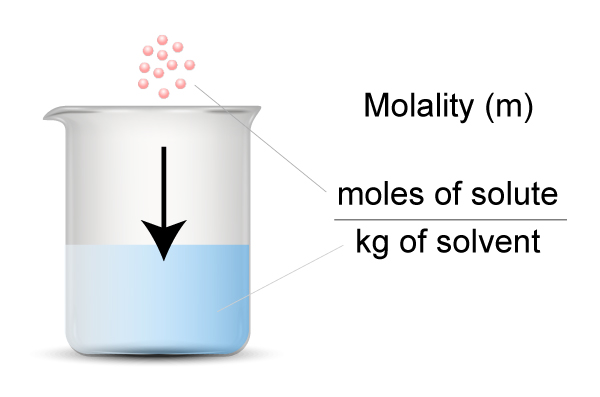
در واقع مولال به نسبت تعداد مول از یک جسم حل شده به جرم حلال برحسب كيلوگرم گفته می شود. این کمیت نشان دهنده تعداد مول جز مورد نظر در یک كيلوگرم از حلال می باشد.با توجه به فرمول زیر مشخص می شود که مولال در سیستم SI با واحد مول بر کیلوگرم (mol/kg) گزارش می شود.
جرم حلال بر حسب کیلوگرم یا كيلوگرم حلال / تعداد مول های حل شونده = مولاریته
مثال ۱
مولاليته محلول ۱۰ گرم سديم هيدروکسيد در ۵۰۰ گرم آب چقدر است؟
Mol ? = 10 g NaOH × ۱ mol NaOH / 40 g NaOH = 0.25 mol NaOH
L ? = 500 g water × ۱ kg / 1000 g = 0.50 kg water
molality = 0.25 mol / 0.50 kg = 0.50 m
مثال ۲
۵۰ گرم اتانول (C۲H۵OH) و ۲۰۰ گرم آب را با یکدیگر مخلوط نموده تا محلول يكنواختی بدست آید. مولاليته اتانول را در محلول حساب كنيد ؟
برای حل این مسئله در ابتدا جرم را به مول تبدیل نمایید. جرم مولی اتانول با استفاده از جدول تناوبی ۴۶ گرم بر مول می شود. علاوه بر آن به حجم حلال بر حسب کیلوگرم نیز نیاز می باشد که در صورت مسئله ۲۰۰ گرم یا ۰/۲ کیلوگرم ذکر شده است.

محاسبه مول یا گرم با استفاده از مولالیته
لازم به ذکر است که با توجه به تعریف مولالیته و معادله مربوط به آن، می توان تعداد مول هر جز در محلول و یا جرم حلال را نیز محاسبه کرد. در واقع، تعداد مول جز مورد نظر در محلول برابر با حاصلضرب مولالیته آن جز در جرم حلال بر حسب کیلوگرم می باشد.
جرم حلال بر حسب کیلوگرم × مولالیته جز مورد نظر = تعداد مول جز مورد نظر
علاوه بر آن، با تقسیم کردن تعداد مول از یک جسم مورد نظر به مولالیته همان جز مورد نظر، می توان جرم حلال را محاسبه کرد.
مولالیته جز مورد نظر / تعداد مول جز مورد نظر = جرم حلال بر حسب کیلوگرم
به عنوان مثال، برای تهیه ۱۵۰۰ گرم محلول اتانول ۵ مولال به چند گرم اتانول و چند گرم آب نیاز می باشد؟
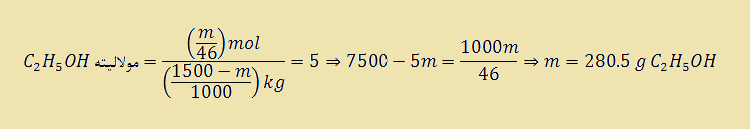
باقیمانده جرم محلول، جرم آب می باشد، بنابراین :
جرم آب بر حسب گرم ۵/۱۲۱۹ = ۵/۲۸۰ – ۱۵۰۰ = جرم اتانول – ۱۵۰۰
تهیه محلول های مولال
برای تهیه یک محلول مولال از یک ترکیب مورد نظر، ابتدا جرم مولکولی ترکیب مورد نظر را محاسبه می کنید. بعد از آن، وزنی معادل جرم مولکولی بدست آمده را بر حسب گرم با ترازو دقیق وزن کرده و در ۱۰۰۰ گرم از حلال حل نمایید. روش کار به این صورت است که در ابتدا يك بالن حجم سنجی یک لیتری انتخاب مي شود. سپس آن را تا خط نشانه یک لیتر با حلال پر می کنند و بعد به آن یک مول از حل شونده مورد نظر اضافه نموده و هم می زنند. به همین جهت محلول های یک مولال جرم بيشتری نسبت به محلول های یک مولار دارند، بنابراین مقداری رقيقتر می باشند زيرا در حقیقت حجم بيشتری دارند.
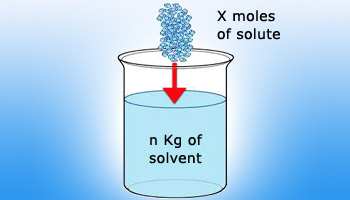
به عنوان مثال برای تهیه یک محلول ۱ مولال از اسید سولفوریک باید میزان گرم ۹۸/۰۸ (وزن مولکولی اسید سولفوریک برابر با ۹۸/۰۸ می باشد) از اسید سولفوریک را برداشته و در یک کیلوگرم آب حل کنید. لازم به ذکر است که به طور معمول در آزمایشگاه ها برای تهیه محلول های مولال از محلول های غلیظ اسید یا باز استفاده می کنند. در واقع در این حالت، ابتدا با استفاده از رابطه چگالی و بازآرایی آن وزن را به حجم تبدیل می کنند.
d = M / V→ V = M /d
از این رو حجم معین و مشخصی از محلول را که برابر با وزن مولکولی آن محلول می باشد، به وسیله وسایل حجم سنجی مانند پیپت یا استوانه مدرج برداشته و در نهایت در ۱۰۰۰ گرم آب حل می کنند تا یک محلول مولال بدست آید. نوجه داشته باشید که دقت محاسبات به دقیق بودن غلظت محلول های مولال وابسته می باشد، در حقیقت به دقیق بودن ترازوی مورد استفاده و همچنین دقت وسایل حجم سنجی بستگی دارد.
نکته
در تهیه محلول های مولال، حجم نهایی محلول بدست آمده اهمیت چندانی ندارد. زیرا در تمامی محلول های آبی یک مولال تهیه شده، از حل شدن اجزای مورد نظر مختلف در ۱۰۰۰ گرم آب، حجم های متفاوتی بدست می آید. توجه داشته باشید که تمامی این محلول ها کسرهای مولی یکسانی از مواد حل شده و حلال دارند.
از طرفی، در محلول های خیلی رقیق آبی، به دليل آنکه چگالی آب در ۲۵ درجه سانتيگراد در حدود یک می باشد، بنابراین مولالیته تقریبا با مولاریته برابر می باشد. زیرا با توجه به رابطه دانسیته، یک کیلوگرم آب به طور تقریبی حجمی برابر با یک لیتر اشغال می کند. لازم به ذکر است که این تقریب در محلول های غلیظ، حلال هایی غیر از آب و یا وقتیکه دمای محلول تغییر کند (به دلیل تغییر چگالی محلول) معتبر نمی باشد.
مزیت محلول های مولال
اشکال غلظت هایی که بر اساس حجم محلول محاسبه می شوند (مانند مولاریته و نرمالیته) اینست که این چنین غلظت هایی با تغییر دما اندکی تغییر می کنند. اما بر عکس آنها مولالیته مستقل از درجه حرارت می باشد، زیرا محلول های مولال بر اساس جرم اجزای سازنده آن تهیه می شوند. همانطور که می دانید جرم با دما تغییر نمی کند. از این رو، از یک محلول یک مولال که در ۳۰ درجه سانتیگراد تهیه شده است، می توان در ۱۰۰ درجه نیز به شرطی که هیچ مقدار از ماده حل شده یا حلال آن بر اثر گرما از بین نرود، استفاده کرد.
کاربرد مولالیته
بیشترین استفاده از مولالیته برای تعیین غلظت محلول های غلیظ و یا زمان هایی که دمای محلول تغییر کند (زیرا همان طور که می دانید جرم حل شونده و یا حلال بر اثر تغییر دما تغییر نمی کند) می باشد. علاوه بر موارد ذکر شده، از مولالیته در موارد اندازه گیری نقطه جوش، اندازه گیری نقطه ذوب و مطالعه خواص کولیگاتیو نیز کمک می گیرند.
همچنین غلظت محلول هايی كه حلال آنها غير از آب باشد نیز معمولا با مولاليته بيان می شوند. اگر حلال به كار رفته در اين محلول ها يكسان باشد، بنابراین کسر مولی جز حل شده و کسر مولی حلال در همه محلول های یک مولال یکسان خواهد بود. حال توجه داشته باشید که در یک محلول یک مولال از محلول تترا كلريد كربن، كسر مولی جز حل شده ۰/۱۳۳ و كسر مولي حلال برابر با ۰/۸۶۷ می باشد. از آنجایی که وزن مولکولی تتراکلرید کربن با وزن مولكولي آب برابر و یکسان نمی باشد، پس تعداد مول های تتراكلريد كربن در یک کیلوگرم آن برابر با تعداد مول های آب در یک کیلوگرم آب نخواهد بود.
تفاوت بین مولالیته و مولاریته
در هنگام تهیه محلول ۱ مولار، در ابتدا ۱ مول از ماده مورد نظر را در بالن ژوژه می ریزند، سپس و کم کم تا حجم ۱۰۰۰ ميلي ليتر به آن آب اضافه می کنند. در حالیکه براي تهیه محلول ۱ مولال، در ابتدای کار ۱۰۰۰ گرم از آّب را برداشته و سپس به آن ۱ مول از ماده مورد نظر را اضافه مي کنند. از این جهت، محلول ۱ مولال جرم بيشتري نسبت به محلول ۱ مولار دارد و چون حجم بيشتری دارد پس مقداری رقيق تر می باشد.
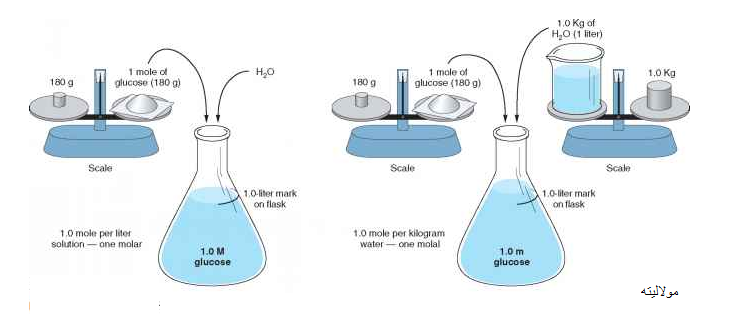
می توان با یک مثال ساده تفاوت مولاریته و مولالیته را به خوبی متوجه شد. یک لیتر محلول ۱ مولار و همچنین یک لیتر محلول ۱ مولال سدیم هیدرو اکسید (سود سوز آور) تهیه نمایید. جرم مولی سدیم هیدرو اکسید برابر با ۴۰ گرم می باشد.
تهیه محلول یک مولار : در ابتدا یک بالن ژوژه یک لیتری انتخاب کرده و آن را تا نیمه با آب مقطر پر می کنند. یک مول (چهل گرم) سدیم هیدرو اکسید را به بالن اضافه نموده و هم می زنند تا کاملا حل شود. در نهایت با آب مقطر آن را به حجم یک لیتر می رسانند.
تهیه محلول یک مولال : در ابتدا یک بالن ژوژه یک لیتری انتخاب کرده و آن را تا خط نشانه یک لیتر با آب مقطر پر می کنند. توجه داشته باشید یک لیتر تمام پر می شود، زیرا چگالی آب برابر با ۱ است، پس یک لیتر آن یک کیلوگرم می شود. یک مول (چهل گرم) سدیم هیدرو اکسید را به بالن اضافه نموده و هم می زنند تا کاملا حل شود. در اینجا مقدار محلول از خط نشانه بالاتر می رود و وزن نهایی آن یک کیلو و چهل گرم می شود.
مثال تبدیل مولاریته به مولالیته و بر عکس آن
مولالیته یک محلول ۱۸ مولار اسید سولفوریک (H۲SO۴) را محاسبه کنید. توجه داشته باشید که چگالی محلول ۱/۸۴ گرم بر سانتی متر مکعب می باشد. جرم مولی اسید سولفوریک برابر با ۹۸ گرم می باشد.
گام ۱ : فرض کنید تنها یک لیتر محلول دارید.
گام ۲ : جرم کل محلول را محاسبه کنید.
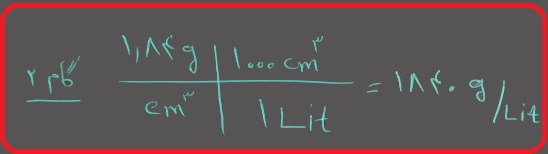
گام ۳ : تعداد گرم های محلول را محاسبه کنید. توجه داشته باشید چون در صورت سوال گفته شده است محلول ۱۸ مولار، بنابراین ۱۸ مول اسید سولفوریک در یک لیتر محلول دارید.
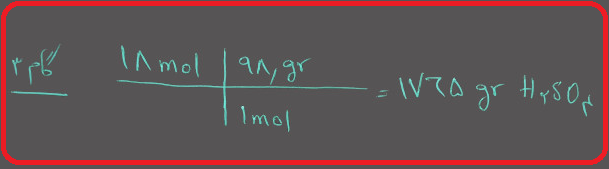
گام ۴ : تعداد گرم های حلال را محاسبه کنید.
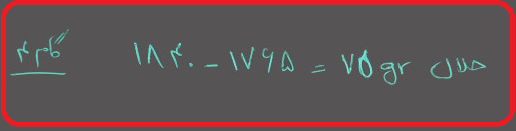
گام ۵ : مولالیته را محاسبه کنید.

یک محلول اسید سولفوریک (H۲SO۴) با غلظت ۸/۰۱ مولال و با چگالی ۱/۳۵۴ گرم بر لیتر داریم. مولاریته آن را حساب کنید؟ جرم مولی اسید سولفوریک برابر با ۹۸ گرم می باشد.





















