محلول چیست؟ – اجزا و انواع محلول ها کدامند؟
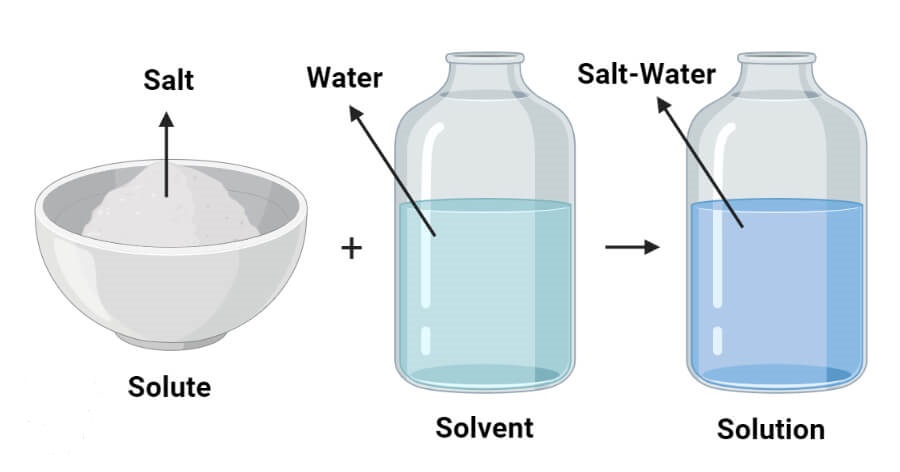
به مخلوط های همگن محلول می گویند که از دو جزء حلال و حل شونده تشکیل شده است. هر محلولی می تواند از دو یا چند ماده شیمیایی تشکیل شود.

بیشتر واکنش های شیمیایی در محیط محلولی انجام می شود. معرفی محیط های متشکل از حلال و حل شونده در کتاب های علوم پایه مانند پایه چهارم بررسی شده است.

در این مقاله نشریه جهان شیمی فیزیک به معرفی این دسته از مواد می پردازیم.
فاز چیست
قسمتی از یک ماده که تمام بخش های آن چه از نظر خواص فیزیکی و چه از نظر ترکیب شیمیایی یکی باشد یک فاز نامیده می شود. مواد در سه فاز جامد، مایع و گاز می توانند باشند و هنگام تبدیل از یک فاز به فاز دیگر از نظر ماهیت شیمیایی ثابت می مانند.
محلول چیست
اگر مخلوطی همگن از دو یا چند ماده ی شیمیایی داشته باشیم به آن محلول گفته می شود که از دو جزء حلال و ماده ی حل شونده تشکیل شده و می تواند به فازهای مختلف جامد، مایع و یا گاز وجود داشته باشد. به عنوان مثال وقتی شکر در آب حل می شود یک محلول تک فاز مایع داریم که رنگ، طعم، حجم و چگالی و دیگر خواص فیزیکی آن در همه ی قسمت های آن یکی است. از محلول گازی می توان هوا را مثال زد که ترکیبی از گازهای مختلف مانند اکسیژن، نیتروژن، هیدروژن، آرگون و … می باشد. آلیاژها نیز نمونه ای از محلولهای جامد می باشند. سکه های نقره ای نمونه ای از آلیاژهاست که در آن مس و نقره محلول تشکیل دادند.
نکته
طرز تمیز دادن حلال از حل شونده با مقدار آن ها تعیین می شود. جزء بیشتر حلال و جزئی که مقدار کمتری دارد با عنوان حل شونده می باشد. اگر مقدار هر دو جزء یکی باشد (هر دو ۵۰ درصد)، می توان به هرکدام حلال یا حل شونده گفت.
انحلال پذیری محصول
بیشترین مقدار حل شونده که می تواند در یک مقدار معینی از یک حلال مخصوص در یک دمای خاص، حل شود را انحلال پذیری آن ماده در این حلال می گویند. وقتی یک حل شونده در یک حلال حل می شود ابتدا پیوند بین مولکول های حلال شکسته و اجزای آن از هم جدا می شود. همچنین پیوند بین مولکول های حل شونده نیز از هم گسسته و سپس بین مولکول های حلال و حل شونده پیوند جدید برقرار شده و حل شونده به اصطلاح در حلال حل می شود. در این فرآیند، شکستن پیوندها احتیاج به انرژی دارد و تشکیل پیوندها با آزاد شدن انرژی و گرما همراه است که به این گرما، گرمای انحلال (∆H) می گویند. اگرمیزان انرژی آزاد شده بیشتر باشد فرآیند گرمازا و اگر میزان انرژی مصرف شده زیاد باشد فرآیند انحلال گرماگیر خواهد بود.
انحلال مواد مشابه در یکدیگر
در فرآیند انحلال جمله معروفی وجود دارد «همجنس همجنس را در خود حل می کند». بر اساس این جمله در صورتی عمل انحلال به خوبی انجام می شود که نیروی بین مولکولی در حلال و حل شونده با هم یکی باشد. به عنوان مثال نمک کلرید سدیم در آب به خوبی حل می شود. چون بین یون ها پیوند یونی است که در مولکول قطبی آب با تشکیل پیوندهای یون- دوقطبی به خوبی حل می شود. ید به عنوان یک مولکول غیرقطبی در تتراکلرید کربن به خوبی حل می شود. پس مواد قطبی در حلال قطبی و مواد غیرقطبی در حلال های غیرقطبی حل می شوند.
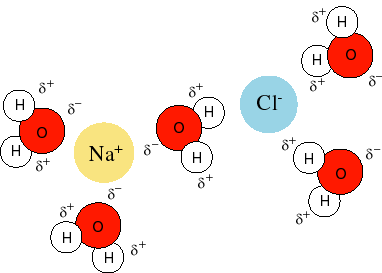
مواد یونی و الکترولیت ها وقتی در آب حل می شوند که یون های تفکیک شده آن ها توسط مولکول های آب، پوشیده می شوند. یون های منفی از سر مثبت مولکول آب (هیدروژن) و یون های مثبت از سمت سر منفی آب (اکسیژن) آبپوشی و هیدراته می شوند.
نکته ۱
برخی از انواع مولکول ها دارای هر دو قسمت قطبی و غیرقطبی هستند. اگر بخش قطبی بزرگ باشد انحلال پذیری بالایی در حلال های قطبی خواهد داشت و در صورت بزرگ بودن بخش غیرقطبی در حلال های غیرقطبی حل می شود. الکل ها نمونه ای از این ترکیبات هستند.
نکته ۲
موضوع دیگری که در انحلال مواد در یکدیگر حائز اهمیت است این است که بعضی مواد به هر نسبتی در هم حل می شوند. اتانول و آب نمونه ای از این مواد هستند. پیوند مشابه ای که بین این دو ماده وجود دارد، پیوند هیدروژنی است. پیوند هیدروژنی پیوندی است که بین اتم هیدروژن و یکی از اتم های الکترونگاتیو مثل فلوئور (F)، اکسیژن (O) و نیتروژن (N) برقرار می شود.
مقالات مرتبط
انواع پیوندها بین ذرات
پیوندی که در نتیجه برقراری بین ذرات گسسته در محلول ها ایجاد می شود می تواند با توجه به نوع مواد شرکت کننده یکی از برهمکنش های زیر باشد. مثلا بین یک استون و اتانول پیوند دوقطبی- دوقطبی، بین آب با الکل ها و یا خود آب پیوند هیدروژنی، بین یون ها با آب پیوند یون- دوقطبی، بین آب و مولکول های غیر قطبی پیوند دوقطبی- دوقطبی القائی و بین حلال و حل شونده های غیرقطبی پیوند دوقطبی القائی- دوقطبی القائی برقرار می شود.
انواع محلولهای همگن
محلول هایی که در آن مولکول های حل شونده به طور کامل در بین مولکول های حلال پخش شده و با مخلوط کامل شدن نتوان مرزی بین آن ها قایل شد را محلولهای همگن یا هموژن می گویند. همان طور که در بالا اشاره شد این نوع محلول ها در حالت های مایع، گاز مثل اتمسفر هوا و همچنین به شکل جامد مثل آلیاژها وجود دارند. این محلول ها را بر اساس نوع حلال خود به دو دسته آبی و غیرآبی تقسیم می کنند. وقتی در یک محلول، حلال آب باشد محلول های آبی خوانده می شود و اگر حلال ماده ای به غیر از آب باشد، محلول را غیرآبی می گویند. حلال های این محلول ها می تواند مثلا الکل ها، مواد غیرقطبی مثل تتراکلرید کربن، n- هگزان و یا حتی اسیدها مثل هیدروکلریک اسید، گازها و حتی جامدات باشند.
غلظت محصول چیست
تعریف غلظت برای محلول ها به شکل های مختلف بیان می شود. اما در یک تعریف کلی به مقداری از ماده ی حل شونده که در یک دمای خاص می تواند در مقدار مشخصی از یک حلال، حل شده و تشکیل یک محلول را بدهد غلظت آن ماده گفته می شود. غلظت در علم شیمی بر اساس مقدار مواد به شکل های گرمی یا مولی بیان شده و به صورت های متفاوت مولاریته، مولالیته، درصد جرمی، درصد جرمی حجمی، درصد حجمی حجمی، نرمالیته، قسمت در صد و… معرفی می شود. با این تعریف ها محلولها می توانند غلیظ یا رقیق باشند.
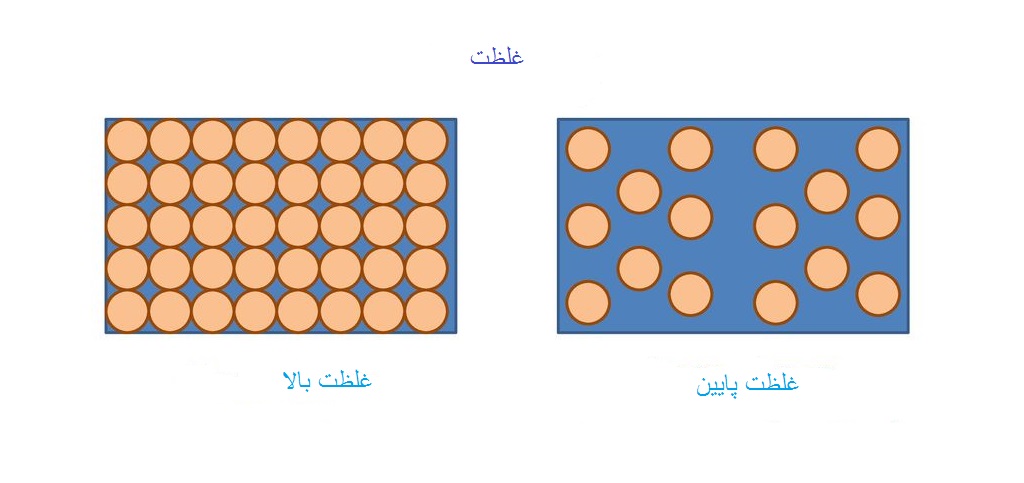
انواع محلول ها با توجه به مقدار حل شونده یا غلظت
محلولها را می توان به سه دسته محلولهای سیر نشده، محلولهای اشباع یا محلولهای فوق اشباع تقسیم کرد.
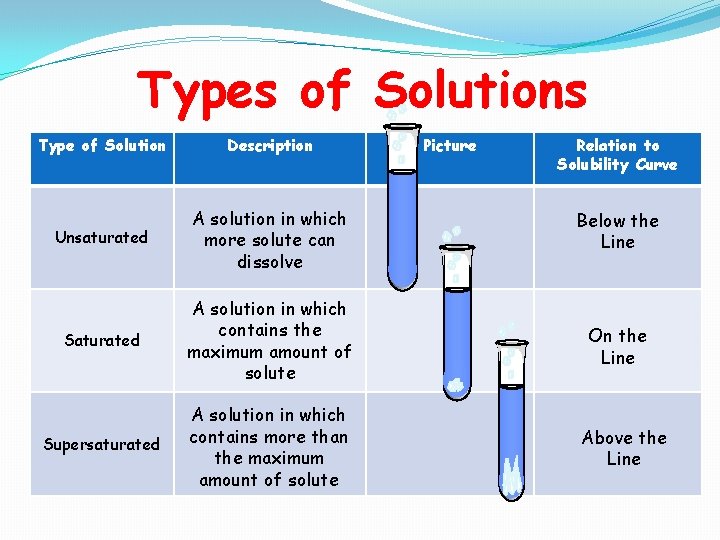
محلولهای سیر نشده
وقتی یک ماده حل شونده در یک حلال حل می شود با یکدیگر ترکیب شده و محلولی را تشکیل می دهد که باز هم می توان به آن حل شونده اضافه کرد. مثل حل کردن نمک در آب که تا نرسیدن به نقطه اشباع، یک محلول غیر اشباع و سیرنشده محسوب می شود.
محلولهای اشباع یا سیر شده
وقتی در یک دمای مشخص میزان حل شونده ای که به حلال اضافه می شود به حدی باشد که حلال دیگر نتواند حل شونده را در خود حل کند به اصطلاح محلول سیر شده یا اشباع به دست می آید. در این محلول مقدار ماده حل شونده ثابت مانده و بین سرعت حل شدن و جامد شدن آن یک تعادلی برقرار می شود و غلظت ثابت می ماند.
محلولهای فوق اشباع یا ابرسیرشده
حال اگر به محلولهای سیر شده، باز هم ماده حل شونده اضافه کنیم چون ظرفیت حلال برای حل کردن مقدار اضافی ماده حل شونده تمام شده، این مقدار اضافی به صورت رسوب در این محلول ها در آمده و محلولهای ابرسیرشده یا فوق اشباع را می سازند.
نکته
یکی از عوامل مهمی که بر میزان حلالیت و تهیه محلولهای اشباع و فوق اشباع اثر می گذارد دما می باشد. با افزایش دما میزان حلالیت افزایش می یابد و اگر در دمای بالا محلولهای اشباع به دست آیند با کاهش دما و سرد شدن، همین محلولها به فوق اشباع تبدیل می شوند.
خواص محلول ها
یک سری خواص در محلولها که به ماهیت شیمیایی اجزای آن بستگی ندارد بلکه تحت تاثیر تعداد اجزای محلول و جزء خواص فیزیکی می باشد، به خواص کولیگاتیو معروف هستند. این خواص شامل نقاط ذوب و جوش، فشار بخار و فشار اسمزی می باشند.
نقاط ذوب و جوش
نقطه جوش یک محلول با فشار بخار آن متناسب است. چون فشار بخار حلال بیشتر از فشار بخار محلول آن است پس نقطه جوش محلول باید بیشتر از نقطه جوش حلال آن باشد. در مورد دمای ذوب، این کمیت در محلول ها چون با اضافه کردن یک ماده حل شونده پتانسیل شیمیایی آن کاهش می یابد و مولکول ها کمتر به فاز مایع یا گاز می روند، افزایش یافته و به دنبال آن نقطه انجماد کاهش می یابد.
فشار بخار
وقتی به یک حلال ماده ی حل شونده اضافه می شود فشار بخار آن نسبت به زمانی که یک حلال خالص است، کاهش می یابد. فشار تعادلی در محلول های ایده آل از قانون رائول پیروی می کند.
P = PA XA + PB XB
که در آن P فشار بخار (حلال و حل شونده) و X برابر کسر مولی (حلال و حل شونده) است.
فشار اسمزی
وقتی یک لایه ی نیمه تراوا بین یک حلال خالص و محلول قرار گیرد، مولکول های حلال خالص با عبور از این غشا و رفتن به سمت محلول، پدیده اسمز را به وجود می آورد. با رسیدن اختلاف فشار به فشار اسمزی میزان عبور حلال به دو طرف غشا یکی شده و به تعادلی ثابت می رسد. فشار اسمزی تحت تاثیر دو کمیت دما و غلظت محلول می باشد. مانند گازهای ایده آل برای محلولهای ایده آل نیز قانون زیر را داریم :
Pv = nRT
R در این رابطه ثابت جهانی گازهاست و برابر با ۸,۳۱۴ ژول بر درجه کلوین مول می باشد.
تفاوت مخلوط و محلول چیست
تفاوت عمده بین مخلوط و محلول در این است که یک مخلوط خواص همه عناصر جایگزین را نشان می دهد. در یک مخلوط ترکیب عناصر ثابت نیست و مخلوط می تواند همگن یا ناهمگن باشد. در حالی که یک محلول مخلوطی از دو یا چند ماده است که به راحتی قابل جداسازی نیستند. تعداد موادی که در ساخت یک مخلوط شرکت می کنند، می تواند متفاوت باشد و مقدار ثابتی ندارد. در حالی که در محلول ها میزان حل شدن املاح در حلال، میزان معینی دارد.
مخلوط ترکیبی از دو یا چند ماده است که در آن هر ماده فقط با هم مخلوط شده است و هیچ ترکیب جدیدی تشکیل نشده و خصوصیات و خواص فردی هر ماده ثابت باقی می ماند. به عنوان مثال، کریستال های شکر مخلوط شده با دانه های نمک یا ماسه حل شده در آب نمونه های از یک مخلوط هستند. شما به راحتی می توانید اجزا این مخلوط ها را از یکدیگر جدا کنید. از طرف دیگر در محلول ها مواد مختلف نه تنها با هم مخلوط می شوند بلکه کاملا در یکدیگر نیز حل می شوند. برای مثال می توان به حل شدن بلورهای شکر در آب اشاره کرد.
محلول چیست پایه هشتم
محلول در اصل نوعی مخلوط است که در آن دو یا چند ماده با هم ترکیب می شوند و یک محلول واحد را تشکیل می دهند. املاح موادی هستند که با غلظت کمتری در محلول وجود دارند و در حلال حل می شوند که غلظت آن بیشتر از محلول حل شده است. یک محلول زمانی تشکیل می شود که یک ماده به خوبی درون یک حلال حل شده باشد یا با دیگری ترکیب شود. انواع مختلفی از محلول ها وجود دارد که در ادامه بیشتر در مورد آنها صحبت خواهیم کرد.
محلول در اصل مخلوطی از همگن دو یا چند ماده به مقدار نسبی است که می تواند به طور مداوم تا مرز حلالیت تغییر کند. اگرچه اصطلاح «محلول» معمولا با حالت مایع ماده مرتبط است، اما محلول گازها و جامدات نیز امکان پذیر است. به عنوان مثال، هوا محلولی است که عمدتا از اکسیژن و نیتروژن و با مقادیر کمی از چندین گاز دیگر تشکیل شده است. در حالی که آلیاژ برنج محلولی است که از مس و روی تشکیل شده است.
شیمیدانان از تفاوت در حلالیت برای جداسازی و خالص سازی مواد و همچنین انجام تجزیه و تحلیل شیمیایی استفاده می کنند. بیشتر واکنش های شیمیایی در محلول انجام می شود و تحت تاثیر حلالیت معرف ها قرار می گیرند.
محلول چیست کلاس چهارم
محلول را می توان به عنوان مخلوطی همگن از دو یا چند ماده تعریف کرد. مواد یک محلول می توانند در یک حالت فیزیکی یا در حالت های متفاوت باشند. مواد تشکیل دهنده محلول به عنوان اجزای محلول شناخته می شوند و نوع محلول بر اساس تعداد اجزای موجود در محلول تعیین می شود. به عنوان مثال، اگر یک محلول دارای دو جز باشد، به عنوان یک محلول دوتایی شناخته می شود.
در یک محلول دوتایی، جز موجود در مقادیر زیاد حلال نامیده می شود و جز دیگر املاح نامیده می شود. ترکیب یک محلول را می توان با بیان غلظت آن توصیف کرد و غلظت آن را به صورت کیفی یا کمی بیان کرد. از نظر کیفی می توان گفت محلول رقیق، غلیظ، اشباع، غیر اشباع و غیره است.
محلول چیست مثال بزنید
محلول نوعی مخلوط همگن است که در آن دو یا چند ماده با هم ترکیب می شوند. محلول ها می توانند در هر یک از سه حالت ماده جامد، مایع و گاز وجود داشته باشند، اما باید از دو بخش اساسی که شامل املاح و حلال هستند، تشکیل شده باشند. در یک محلول، حل شونده عنصری است که حل می شود و حلال، ماده ای است که حل شونده را حل می کند. املاح معمولا در مقادیر کمتری نسبت به حلال وجود دارد که تشکیل محلول را آسان تر می کند. نمونه ای از یک محلول، آب و شکر است که آب حلال و شکر محلول است.
به بیان ساده، محلول مخلوطی همگن است که از دو یا چند ماده تشکیل شده است. یکی از مواد را حل شونده می گویند که در دیگری حل می شود که به آن حلال می گویند. با توجه به مقدار املاح حل شده در محلول، در دمای ثابت محلول به سه نوع طبقه بندی می شوند.
مثال محلول
نمونه ای از تجربیات روزمره ما از محلول شامل جامدی مانند نمک یا شکر، حل شده در مایع (مانند آب) است. گازها نیز می توانند در مایعات حل شوند و محلول را تشکیل دهند. به عنوان مثال گاز دی اکسید کربن یا اکسیژن در آب حل شده و یک محلول را ایجاد می کند. مقدار املاح اضافه شده به حلال غلظت محلول را تعیین می کند. محلولی که دارای مقدار زیادی املاح باشد محلول غلیظ نامیده می شود و محلول با املاح کمتر را محلول رقیق می نامند.
انواع محلول ها با مثال
انواع مختلفی از محلول ها در جهان وجود دارد که می توان آنها را بر اساس عواملی مانند تفاوت املاح و حلال، تعداد معیارها و غیره طبقه بندی کرد که در زیر برای شما نشان داده شده است.
محلول های مبتنی بر آب به عنوان یک حلال
محلول آبی – محلولی که در آن ترکیب همگن به طور کامل در آب حل می شود و آب به عنوان یک حلال عمل می کند. شکر یا نمک حل شده در آب و دی اکسید کربن حل شده در آب دو نمونه از این نوع محلول ها هستند.
محلول های غیر آبی – این محلول ها اساسا معکوس محلول های آبی هستند، زیرا حلال موجود آب نیست. حلال این محلول ها می تواند هر چیز دیگری مانند بنزین، بنزن، اتر و غیره باشد. برای مثال می توان به فنل فتالئین در بنزن، گوگرد در دی سولفید کربن و غیره اشاره کرد.
محلول بر اساس مقدار املاح اضافه شده
محلول اشباع شده – در این محلول ها هیچ املاحی دیگری در آن دما حل نمی شود. هنگامی که در آن دما نمی توان نمک بیشتری را در محلول نمک آبی حل کرد، گفته می شود که محلول اشباع شده است. یک محلول اشباع به وضوح حاوی املاح بیشتری نسبت به یک محلول غیراشباع است.
محلول غیر اشباع – در این محلول ها می توان املاح بیشتری بدون افزایش دما حل کرد. محلول غیر اشباع دارای املاح کمتری نسبت به حداکثر مقداری است که در آن دما می تواند در آن حل شود. اگر بتوان نمک بیشتری را بدون افزایش دما در محلول آبی نمک حل کرد، محلول غیراشباع است.
محلول فوق اشباع – محلول های فوق اشباع به محلول هایی گفته می شود که در آنها املاح به مقدار زیاد وجود دارد و با افزایش دما به اجبار در حلال حل می شود. با کمک فرآیند تبلور، این ذرات اضافی املاح بعدا به شکل کریستال ایجاد خواهند شد.
محلول بر اساس مقدار حلال اضافه شده
محلول غلیظ – محلول غلیظ دارای غلظت املاح بالایی در حلال معین است. برخی از نمونه های این محلول شامل محلول آب نمک، آب پرتقال و چای تیره رنگ است.
محلول رقیق شده – محلول رقیق محلولی است که حاوی مقدار کمی املاح و مقدار زیادی حلال است. محلول نمک و چای با رنگ روشن دو نمونه از این محلول ها هستند.
محلول ها بر اساس میزان غلظت املاح در دو محلول
محلول ایزوتونیک – در یک محلول ایزوتونیک از آنجایی که غلظت املاح در ظرف و سلول یکسان است، آب در هر دو جهت در اطراف سلول حرکت می کند.
محلول هایپرتونیک – در این محلول ها آب به بیرون از سلول نشت می کند و به محلول موجود در ظرف اضافه می شود، زیرا محلول موجود در ظرف دارای غلظت املاح بالاتری است و باعث پلاسمولیز یا کوچک شدن سلول می شود.
محلول هیپوتونیک – در این محلول ها غلظت املاح در ظرف کمتر از سلول است و باعث حرکت آب به داخل سلول و متورم شدن و ترکیدن آن می شود.
محلول ها بر اساس توانایی آنها در هدایت جریان الکتریکی
محلول های که حاوی مولکول هستند به عنوان نارسانا شناخته می شوند، در حالی که آنهایی که حاوی یون هستند به عنوان رسانا شناخته می شوند. الکترولیت ها موادی هستند که در آب حل می شوند و یون تشکیل می دهند، در حالی که غیر الکترولیت ها موادی هستند که در آب حل می شوند اما یون تشکیل نمی دهند.
محلول الکترولیت قوی – الکترولیت های قوی فقط به شکل یون در محلول وجود دارند که باعث می شوند لامپ روی دستگاه روشن شود. یک مثال خوب از محلول های الکترولیت قوی محلول NaCl است.
محلول الکترولیت ضعیف – در این محلول ها مقدار کمی یون وجود دارد که باعث می شوند لامپ به سختی روشن شود. اسیدها و بازهای ضعیف نمونه های بسیار خوبی از الکترولیت های ضعیف هستند.
محلول چیست گاما
هرگاه ماده ای به خوبی حل شود یا با دیگری ترکیب شود، به آن محلول می گویند. همانطور که ما یک محلول را در نظر می گیریم، به طور طبیعی فرض می کنیم که این محلول نتیجه ترکیب عناصر جامد و مایع با یکدیگر هستند. در طی آزمایشات، نشان داده شده است که در مایعات نواحی خالی وجود دارد که ذرات جامد به راحتی می توانند در آن جا شوند. محلول نمک، محلول شکر، سرکه، آلیاژهای فلزی و هوا همگی نمونه هایی از محلول ها هستند. موادی که در یک محلول یافت می شوند به عنوان اجزای آنها شناخته می شوند. برای مثال آب و شکر اجزای یک محلول شکر هستند.
محلول چیست علوم هفتم
محلول چیزی است که هنگام مخلوط شدن دو ماده شیمیایی رخ می دهد که به آنها حلال و املاح گفته می شود. ترکیب املاح و حلال با هم یک محلول را تشکیل می دهند. محلول اغلب یک ماده حل شده در دیگری مانند حل کردن نمک در آب است. اگرچه از هر حالتی می توان یک محلول ساخت.
محلول با مخلوط یا سوسپانسیون متفاوت است. در محلول، املاح به مرور زمان ته نشین نمی شود و از محلول خارج نمی شود. دو اصطلاح رایج هنگام صحبت در مورد محلول ها، حلال و املاح هستند. حلال همان چیزی است که اکثر محلول را تشکیل می دهد و اغلب یک مایع مانند آب است. املاح ماده ای است که در حلال حل می شود. همیشه املاح کمتر از حلال در یک محلول وجود دارد.
وقتی به محلول ها فکر می کنیم، اولین چیزی که به نظر ما می آید، ماده ای است که در آب حل شده است. این طبیعی است زیرا آب حلال جهانی است. با این حال، محلول ها به فاز مایع محدود نمی شوند و محلول ها می توانند در فاز گازی نیز وجود داشته باشند. برای مثال هوایی که ما تنفس می کنیم محلولی است که از مخلوطی از گازها تشکیل شده است.
محلول definition
محلول ها مخلوط های همگن دو یا چند ماده هستند. ماده ای که بیشترین غلظت را در مخلوط دارد حلال و سایر مواد را حل شونده می نامند. محلول ها دارای ترکیب یکنواختی هستند که حلال و املاح را نمی توان به طور جداگانه با چشم غیر مسلح دید.
یک محلول می تواند در هر یک از سه حالت ماده باشد: گاز، جامد یا مایع. به عنوان مثال، هنگامی که شکر (C12H22O11)، یک جامد کووالانسی، در آب حل می شود، مولکول های آن به طور یکنواخت در مولکول های آب پراکنده می شوند و یک محلول آبی همگن تشکیل می دهند.
هنگامی که ترکیبات یونی در آب حل می شوند، برای تولید یون در یک محلول آبی تجزیه می شوند. به عنوان مثال، هنگامی که دی کرومات پتاسیم (K2Cr2O7) در آب حل می شود، تجزیه می شود و یون های پتاسیم و یون های دی کرومات به طور یکنواخت در مخلوط پراکنده می شود.
محلول دارای حالت فیزیکی مشابه حلال است. به عنوان مثال، هنگامی که شکر (محلول جامد) در آب (حلال مایع) حل می شود، محصول نهایی یک محلول آبی در حالت مایع است. املاح موجود در محلول ته نشین نمی شوند. در یک محلول، مولکولها، اتمها یا یونهای املاح با ذرات حلال از نزدیک احاطه شدهاند. مقدار حل شده ای که می تواند در یک حلال حل شود با مقدار حلالیت تعیین می شود.
غلظت یک محلول مقدار حل شده ای را که در مقدار خاصی از حلال حل می شود اندازه گیری می کند. غلظت با استفاده از واحدهای مختلفی اندازه گیری می شود. حلالیت در یک حلال خاص به حداکثر غلظتی اطلاق می شود که در شرایط معین می توان به دست آورد.
اگر حلالیت یک محلول برابر با غلظت آن باشد، محلول از املاح اشباع می شود. اگر غلظت املاح کمتر از حلالیت باشد، محلول غیراشباع در نظر گرفته می شود. محلول فوق اشباع، محلولی است که غلظت املاح آن بیشتر از حلالیت آن باشد. محلولی با غلظت کم املاح به عنوان محلول رقیق شناخته می شود، در حالی که محلولی با غلظت بالا محلول غلیظ نامیده می شود.




















۲ دیدگاه ها