آلوتروپ (Allotrope) به حالت های ساختاری متفاوت برای یک عنصر گفته می شود. این واژه نخستین بار توسط برزلیوس به کار گرفته شده است. آلوتروپ ها از نظر ساختار شیمیایی ناهمسان می باشند، بنابراین ویژگی های فیزیکی متفاوت (نظیر چگالی، انحلال پذیری و…) و ویژگی های شیمیایی متفاوتی (مانند میزان واکنش پذیری) را نشان می دهند. در ادامه این مقاله در نشریه جهان شیمی فیزیک به بررسی آلوتروپ عناصر مختلف پرداخته می شود. لطفا با ما همراه باشید.
مقدمه
واژه آلوتروپی، از واژه یونانی آلوتروپیا به معنای تغییر پذیری گرفته شده است. آلوتروپی خاصیت بعضی عناصر شیمیایی می باشد که در یک حالت جامد، مایع و یا گاز با دو یا چند شکل مختلف وجود دارند. مثلا اتم کربن دارای آلوتروپ های مختلفی مانند الماس، گرافیت، گرافن و … می باشد. در واقع می توان گفت که آلوتروپی به ساختار پیوند های شیمیایی بین اتم های یک عنصر ارتباط دارد و نباید آن را با حالت های فیزیکی مواد اشتباه گرفت. به عنوان نمونه، بخار آب، آب و یخ آلوتروپ نمی باشند، زیرا این سه حالت آب، به خاطر تغییر فاصله بین مولکول های آب بوجود آمده اند نه به جهت تغییر در پیوند های شیمیایی درون مولکول های آب. به بیان دیگر، آلوتروپ ها شکل های مختلف یک عنصر محسوب می شوند. هر کدام از این شکل ها، دگرشکل، دگرواره یا چندگونی نیز نامیده می شوند.

تفاوت آلوتروپ ها یا دگرشکل ها
آلوتروپ های یک عنصر شباهت ها و تفاوت های زیادی با یکدیگر دارند. دگرشکل های مختلف یک عنصر از دو جهت می توانند با یکدیگر متفاوت باشند. این دو جهت عبارتند از :
۱- پیوند های شیمیایی :
به عنوان مثال گرافیت و الماس را در نظر بگیرید. در گرافیت، هر اتم کربن در یک شبکه شش وجهی صفحه ای، به سه اتم کربن دیگر متصل است، در حالیکه در الماس، هر اتم کربن در یک شبکه چهار وجهی با چهار اتم کربن دیگر پیوند دارند.
۲- ساختار کریستالی یا ساختار بلوری :
ساختار بلوری ویژه فلز ها می باشد. در واقع فلزاتی که دو یا چند ساختار کریستالی پایدار داشته باشند، دگرشکل محسوب می شوند. شرایط تشکیل بلور های مختلف وابسته به دما و فشار است. این ساختار های بلوری می توانند با استحاله به یکدیگر تبدیل گردند. به عنوان مثال، آهن آلفا و آهن گاما دو دگرشکل فلز آهن می باشند. فلزاتی مانند منگنز، قلع، کبالت، تیتانیم، تلوریم و زیرکونیم نیز از جمله فلزات دگرشکل می باشند.
عنصر های دارای آلوتروپی
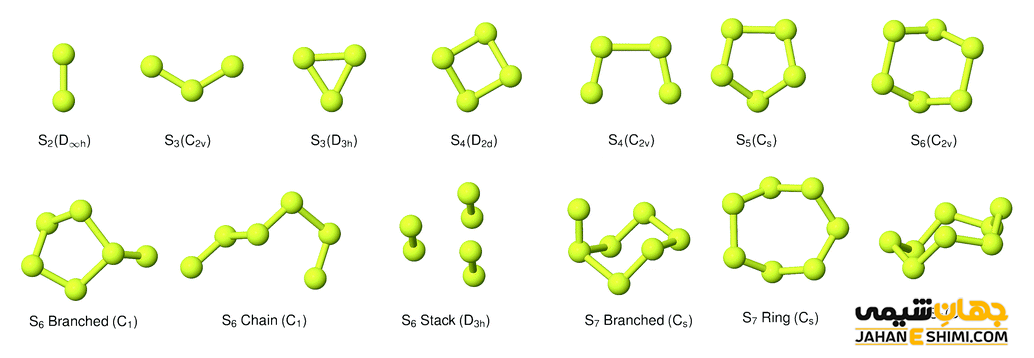
همانطور که بیان شد، آلوتروپ ها شکل های مختلف یک عنصر می باشند. اگر چه این شکل ها به ظاهر کاملا با هم متفاوت هستند، اما تنها فرق آنها با یکدیگر در نوع قرار گیری اتم ها در کنار هم می باشند. به بیان دیگر، اتم های عناصر متفاوت با شیوه های مختلفی در دگرشکل ها با یکدیگر پیوند تشکیل می دهند. دگرشکلی در برخی عناصر یافت می شود. این عناصر معمولا در بین گروه های ۱۳ تا ۱۶ جدول تناوبی قرار دارند. در جدول زیر، آلوتروپ های عناصر مختلف آورده شده است. در ادامه مقاله آلوتروپ های عناصر مشهور را بررسی خواهیم کرد.
عدد اتمی | عنصر | آلوتروپ ها |
| ۱ | هیدروژن (H) | دی هیدروژن (H۲) |
| ۵ | بور (B) | بور آمورف، بور آلفارومبوهدرال، بور بتارومبوهدرال، بور گاما اوتورومبیک، بور آلفا تتراگونال و بور بتا تتراگونال |
| ۶ | کربن (C) | گرافیت، الماس، کربن بی شکل (دوده)، لونزدالیت، گرافن، فولرن، کربن Q، کاربین و نانولوله کربنی |
| ۷ | نیتروژن (N) | دی نیتروژن (N۲) |
| ۸ | اکسیژن (O) | دی اکسیژن (O۲)، اوزون (O۳)، تترا اکسیژن (O۴) و اکتا اکسیژن |
| ۹ | فلوئور (F) | دی فلوئورین (F۲) |
| ۱۴ | سیلیکون یا سیلیسیم (Si) | سیلیکون آمورف، سیلیکون بلوری و سیلیسن |
| ۱۵ | فسفر (P) | فسفر سفید (P۴)، فسفر قرمز (آمورف)، فسفر سرخ، فسفر سیاه، فسفر بنفش و دی فسفر |
| ۱۶ | گوگرد یا سولفور (S) | گوگرد رومبیک، گوگرد مونوکلینیک، گوگرد بی شکل، گوگرد آلفا، گوگرد بتا، گوگرد گاما و … |
| ۱۷ | کلر (Cl) | دی کلرین (Cl۲) |
| ۲۶ | آهن (Fe) | آهن آلفا (فریت)، آهن بتا، آهن گاما (آستنیت)، آهن دلتا و آهن اپسیلون (هگزافروم) |
| ۲۷ | کبالت (Co) | کبالت آلفا و کبالت بتا |
| ۳۲ | ژرمانیوم (Ge) | ژرمانیوم آلفا، ژرمانیوم بتا و ژرمانن |
| ۳۳ | آرسنیک (As) | آرسنیک زرد، آرسنیک سیاه، آرسنیک خاکستری |
| ۳۴ | سلنیم (Se) | سلنیوم بی شکل قرمز، سلنیم بی شکل سیاه، سلنیم مونوکلینیک (تک شیب)، سلنیوم هگزاگونال و سلنیوم خاکستری |
| ۳۵ | برم (Br) | دی برمین (Br۲) |
| ۵۰ | قلع (Sn) | قلع سفید، قلع خاکستری، قلع گاما، قلع سیگما و استانن |
| ۵۱ | آنتیموان (Sb) | آنتیموان آبی- سفید، آنتیموان زرد، آنتیموان سیاه و آنتیموان انفجاری |
| ۵۲ | تلوریم (Te) | تلوریم آمورف و تلوریم بلوری |
| ۵۳ | ید (I) | دی یدین (I۲) |
| ۸۴ | پولونیم (Po) | پلونیوم آلفا و پلونیوم بتا |
آلوتروپ های کربن کدامند ؟ شیمی یازدهم
کربن آمورف، گرافیت، الماس، گرافن و فلورن از جمله آلوتروپ های مهم کربن می باشند. ذکر این نکته خالی از لطف نیست که گرافیت پایدارترین آلوتروپی کربن محسوب می شود. کربن سیاه یا کربن آمورف (بی شکل) در واقع کربنی است که به شکل تجاری از تجزیه اکسایشی و حرارتی هیدروکربن ها بوجود می آید. فلورن ها به شکل های مختلفی نظیر باکی بال ها و نانو لوله ها وجود دارند. توجه داشته باشید که آلوتروپ های کربن همگی جامد اند و خواص فیزیکی کربن در هر یک از دگرشکل های کربنی متفاوت می باشد.
به عنوان نمونه علاوه بر تفاوت ساختاری گرافیت و الماس (گرافیت ساختار لایه لایه دارد، درحالیکه الماس در ساختار چهار وجهی متبلور می شود)، گرافیت ظاهری کدر و سیاه رنگ دارد. در حالیکه الماس کاملا شفاف می باشد. همچنین در مقابل الماس که سخت ترین ترکیب طبیعی است، گرافیت آنقدر نرم است که می تواند بر روی کاغذ اثر برجا بگذارد. از طرفی دیگر، گرافیت هدایت کننده جریان الکتریکی می باشد، درحالیکه الماس یک رسانای ضعیف جریان الکتریکی به حساب می آید.
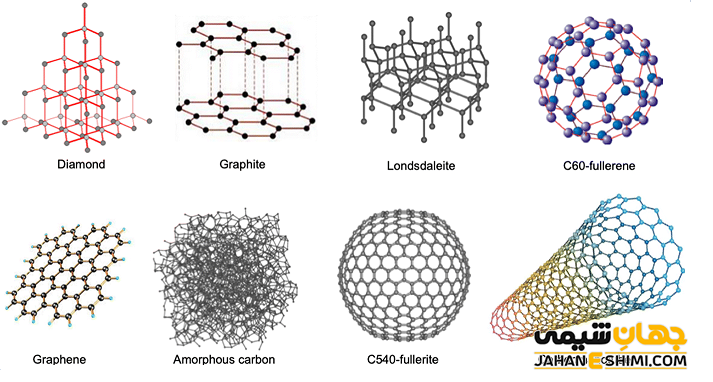
گرافین یک لایه دو بعدی از اتم های کربن می باشد. در گرافن اتم های کربن با پیوند های کوالانسی به یکدیگر متصل شده اند و سبب ایجاد یک ساختار لانه زنبوری می شوند. در گرافین در واقع تنها یکی از لایه های گرافیت وجود دارد. در حقیقت چهارمین الکترون پیوندی اتم کربن، به عنوان الکترون آزاد (ناپیوندی) باقی می ماند. حال اگر لایه های گرافیتی یا گرافنی در هم پیچیده شوند، نانولوله های کربنی تشکیل می شوند. لازم به ذکر است که باکی بال یک آلوتروپ مرموز کربن است که در آن اتم های کربن، لایه ای کروی شکل مشابه توپ فوتبال را تشکیل می دهند.
جالب است بدانید که
قابل ذکر است که گرافین و نانولوله های کربنی به دلیل داشتن ویژگی های جالب و منحصر به فرد بیشتر از سایر آلوتروپ های کربن مورد توجه محققان قرار گرفته اند. کاربردهای این دو آلوتروپ در صنایع مختلفی همچون نفت و الکترونیک کاربرد گسترده دارند.
آلوتروپ های اکسیژن کدامند ؟ شیمی دهم
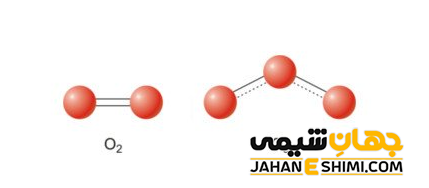
اکسیژن چندین آلوتروپی شناخته شده دارد. مهم ترین و شناخته شده ترین آنها، اکسیژن مولکولی (O۲) و اوزون (O۳) می باشد. سایر دگرشکل های اکسیژن عبارتند از : اکسیژن اتمی (O۱) که یک رادیکال آزاد محسوب می شود. تترا اکسیژن (O۴) و اکتا اکسیژن یا اکسیژن جامد (O۸) نیز در دسته دگرشکل های اکسیژن قرار می گیرند. در اینجا نیز خواص فیزیکی اکسیژن در هر یک از دگرشکل های آن متفاوت می باشد. به عنوان مثال در زیر دو آلوتروپ اکسیژن مولکولی و اوزون را مقایسه کرده ایم.
- چگالی، واکنش پذیری، نقطه جوش و جرم مولی اوزون بیشتر از اکسیژن است.
- نیرو های بین مولکولی در اوزون قویتر از اکسیژن می باشند.
- تعداد جفت الکترون های پیوندی و غیر پیوندی در اوزون بیشتر از اکسیژن هستند.
- پایداری اکسیژن بیشتر از اوزون می باشد.
آلوتروپ های فسفر کدامند ؟ شیمی دهم
فسفر هم دگرشکل های مختلفی دارد. از اصلی ترین آنها می توان به فسفر سفید، فسفر قرمز و فسفر سیاه اشاره کرد. این سه الوتروپ در تعداد پیوند های تشکیل شده بین اتم های فسفر و همچنین تعداد اتم در ذرات سازنده با یکدیگر متفاوتند. فسفر سفید جامدی مومی شکل و نارسانا می باشد. بلور های آن از تجمع مولکول های P۴ به صورت چهار وجهی منتظم تشکیل شده اند. فسفر سفید بسیار فعال است و با هوا واکنش داده و خود به خود آتش می گیرد. بنابراین آن را در زیر آب نگهداری می کنند.
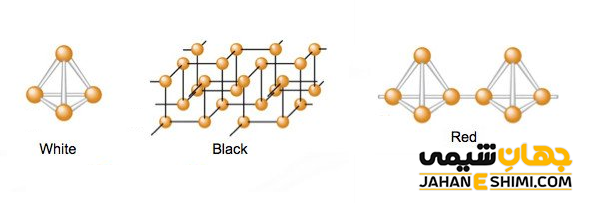
فسفر قرمز (Pn) جز جامد های کووالانسی می باشد که از حرارت دادن فسفر سفید تا دمای ۲۸۰ درجه سانتی گراد (در ظرف های سر بسته و به دور از هوا) ایجاد می شود. به بیان دیگر فسفر قرمز، پلیمری از فسفر سفید خواهد بود. توجه داشته باشید که با تغییرات اندک در ساختار شیمیایی فسفر قرمز، می تواند از رنگ نارنجی تا ارغوانی تغییر رنگ داشته باشد.
فسفر سیاه (Pn) شبیه گرافیت است، پس توانایی هدایت الکتریکی را همچون گرافیت دارد. این الوتروپ از حرارت دادن فسفر تا دمای ۸۸۰ درجه سانتی گراد و در زیر فشار بسیار زیاد تشکیل می شود. لازم به ذکر است که فعالیت فسفر سیاه نسبت به دیگر انواع فسفر کمتر می باشد.
آلوتروپ های گوگرد کدامند ؟ شیمی دهم
گوگرد یا سولفور در ساختار های بلوری مختلفی متبلور می شود. بنابراین دگرشکل های متعددی برای آن وجود دارد. در واقع گوگرد، بیش از ۳۰ آلوتروپ شناخته شده دارد که ساده ترین آنها مولکول بنفش دی سولفور (S۲) می باشد. گوگرد به صورت دگر شکل های بلورين لوزی شكل (گوگرد آلفا) و كج لوزی شكل (گوگرد بتا)، گوگرد گاما، آلوتروپ پودری، گوگرد رومبیک، گوگرد مونوکلینیک، و آلوتروپ سفيد رنگ و بی شكلی نیز می باشد. گوگرد بی شکل یا جامد آمورف از طریق سرد کردن سریع گوگرد مذاب بوجود می آید. سولفور معمولا به شکل متداول یعنی S۸ مشاهده می شود. علاوه بر آن در شکل های مختلفی نظیر S۴، S۶، S۷، S۱۲ و S۱۸ نیز وجود دارد.