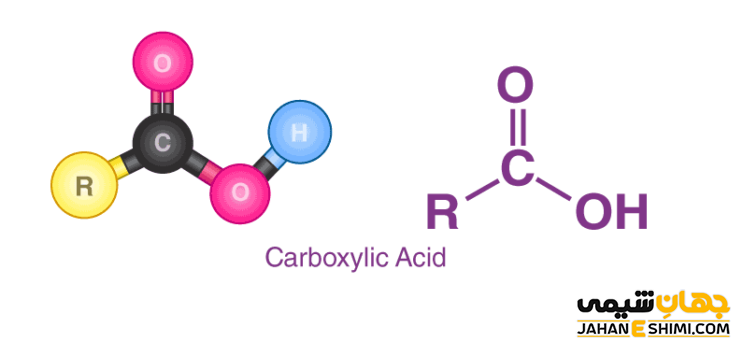
در علم شیمی، کربوکسیلیک اسید (Carboxylic acid)، به ترکیبات آلی اکسیژن داری گفته می شود که در آنها، یک یا چند گروه عاملی کربوکسیل یعنی COOH وجود داشته باشد. گروه عاملی کربوکسیل می تواند به هیدروژن، گروه آلکیل، گروه آریل، گروه های اشباع شده استخلاف دار یا بدون استخلاف و یا گروه های اشباع نشده استخلاف دار یا بدون استخلاف متصل شود. توجه داشته باشید که گروه های متصل شده به گروه عاملی کربوکسیل، خواص آن را تغییر نمی دهند. به طور کلی، فرمول عمومی کربوکسیلیک اسید به صورت R–COOH نشان داده می شود. در ادامه این مقاله در نشریه جهان شیمی فیزیک، با مفهوم کربوکسیلیک اسید ها، نام گذاری، قدرت اسیدی و خواص آنها پرداخته می شود. لطفا همراهی بفرمایید.
فهرست مطالب این مقاله
۱- اسید کربوکسیلیک شیمی یازدهم
۲- خواص کربوکسیلیک اسید ها
۱-۲- خواص فیزیکی اسید های کربوکسیلیک
۲-۲- خواص شیمیایی اسید های کربوکسیلیک
۳- ایزومری اسید های کربوکسیلیک
۴- نامگذاری کربوکسیلیک اسید ها
۵- روش تهیه اسیدهای کربوکسیلیک
۶- واکنش های کربوکسیلیک اسید ها
۷- کاربرد های کربوکسیلیک اسید ها
اسید کربوکسیلیک شیمی یازدهم
اسید های کربوکسیلیک در دسته اسید های ضعیف قرار می گیرند. در اثر حل شدن این اسید ها در آب، بعضی از مولکول های آنها، پروتون اسیدی خودشان را به مولکول های آب می دهند، در نتیجه می توانند به سرعت به حالت تعادل برسند. توجه داشته باشید که اسید های کربوکسیلیک سبک (حداکثر تا چهار اتم کربن) به راحتی در آب حل می شوند، در حالیکه با افزایش تعداد کربن و طول زنجیره کربنی، انحلال پذیری آنها در آب کم خواهد شد. به صورتی که بسیاری از آنها عملا در آب نا محلول می باشند. به بیان دیگر، با افزایش تعداد اتم کربن در زنجیره هیدروکربنی اسید، سر غیر قطبی مولکول بزرگ تر شده، پس جاذبه آن با مولکول های آب که قطبی اند کمتر خواهد شد. در نتیجه میزان انحلال پذیری آنها در آب نیز کاهش می یابد.
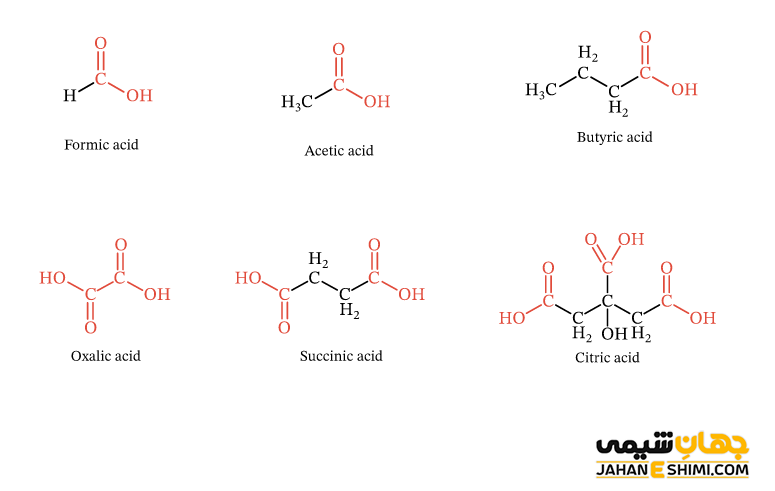
متانوییک اسید، فرمیک اسید یا جوهر مورچه با فرمول شیمیایی HCOOH ساده ترین عضو گروه کربوکسیلیک اسید ها می باشد. این اسید در طبیعت در نیش حشراتی مثل مورچه یا زنبور پیدا می شود. علاوه بر آن، ماده گزش زا در برگ گیاه گزنه نیز اسید فرمیک می باشد. از طرفی دیگر، بنزوئیک اسید (PhCOOH) که در حقیقت یک بلور سفید رنگ است، ساده ترین کربوکسیلیک اسید آروماتیک می باشد. آمینو اسید، اسید های چرب و اتانوئیک اسید ( اسید استیک یا جوهر سرکه) نیز سه مثال مهم دیگر از کربوکسیلیک اسید ها می باشند. اسید های چرب در واقع اسید های کربوکسیلیکی هستند که زنجیر هیدروکربنی آلیفاتیک بزرگ دارند. این زنجیر هیدرو کربنی می تواند سیر شده (اشباع) یا سیر نشده (غیر اشباع) باشد. چند نمونه دیگر کربوکسیلیک اسید می توان به پروپانوئیک اسید، بوتانوئیک اسید، دی اتانوئیک اسید (اگزالیک اسید)، سوکسینیک اسید و آبیتیک اسید اشاره کرد.

جالب است بدانید که
اعضای کوچکتر اسید های کربوکسیلیک آلیفاتیک، عموما بی رنگ، فرار با بوی شدید می باشند. به عنوان مثال سرکه های خانگی در واقع محلول پنج درصد استیک اسید اند. در حالیکه اسید های بزرگتر، جامداتی ( به شکل کریستالهای جامد) با نقطه ذوب پایین خواهند بود. این دسته از مواد شیمیایی دارای بوی خوش می باشند. بسیاری از این مواد به طور طبیعی در حیوانات و گیاهان وجود دارند. مثلا مرکبات مانند لیمو یا پرتقال شامل سیتریک اسید اند.
خواص کربوکسیلیک اسید ها
خواص این دسته از مواد شیمیایی در دو دسته خواص فیزیکی و خواص شیمیایی جداگانه بررسی می شود.
خواص فیزیکی اسید های کربوکسیلیک
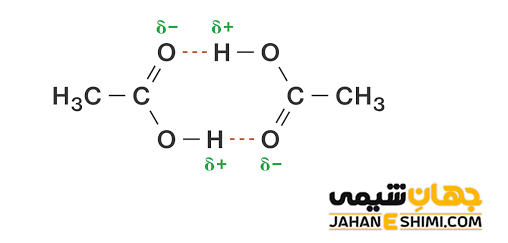
این ترکیبات معمولا بویی ترشی دارند. این دسته از مواد، ترکیباتی قطبی اند، بنابراین می توانند با یکدیگر پیوند هیدروژنی تشکیل دهند. در واقع، این گروه به دلیل داشتن گروه کربونیل (C=O)، پذیرنده پیوند هیدروژنی و به خاطر وجود گروه هیدروکسیل (−OH) دهنده پیوند هیدروژنی محسوب می شوند. قطبیت این گروه بیشتر از الکل ها است، پس در مقایسه با آنها پیوند های هیدروژنی قویتری تشکیل می دهند. در حقیقت قوی تر بودن پیوند های هیدروژنی در این اسید ها به دلیل مثبت تر بودن هیدروژن شرکت کننده در پیوند هیدروژنی خواهد بود (به علت حضور دو اتم اکسیژن الکترونگاتیو).
از طرفی دیگر، محلول بودن کربوکسیلیک اسید های کوچک در آب نیز به دلیل تشکیل پیوند هیدروژنی میان گروه کربوکسیل و مولکول های آب می باشد. توجه داشته باشید که این اسید ها در حلال های غیر قطبی مانند اتر، بنزن و یا حلال هایی با قطبیت کمتر مثل الکل نیز حل می شوند.
لازم به ذکر است که این ترکیبات در هنگام بخار شدن یا حل شدن در حلال های ناقطبی، جهت حفظ پیوند هیدروژنی خود، می توانند به صورت زیر دایمر تشکیل دهند. بنابراین کربوکسیلیک اسید ها نسبت به دیگر ترکیبات آلی هم کربن، دمای ذوب و جوش بالاتری خواهند داشت. مثلا جهت تبخیر شدن، بایستی پیوند های دیمری ابتدا شکسته شوند و یا اینکه آرایش دیمری به صورت کامل تبخیر شود. از این رو باعث افزایش چشمگیر آنتالپی تبخیر خواهد شد. علاوه بر آن به دلیل پیوند های هیدروژنی بهتر در آب حل می شوند.
خواص شیمیایی اسید های کربوکسیلیک
از مهمترین خواص شیمیایی آنها می توان به خصلت اسیدی اشاره کرد. این گروه در مقایسه با اسید های معدنی همانند اسید سولفوریک، اسید کلریدریک و یا اسید نیتریک بسیار ضعیف می باشند، اما نسبت به آب، الکل و یا استیلن ها اسیدیته قوی تری دارد. خصلت اسیدی بالاتر کربوکسیلیک اسید ها نسبت به ترکیباتی مانند الکل ها به دلیل پایداری یون کربوکسیلیک (−RCOO) است. یون کربوکسیلات به دلیل حضور دو اتم اکسیژن الکترونگاتیو و رزونانس زیر پایدار می باشد.
R–COOH → RCOO− + H+
اسیدیته اسید های کربوکسیلیک در واقع به ساختمان اسید، طبیعت عوامل و گروه های مختلف موجود بر روی بخش آلکیل یا آریل بستگی دارد. هرچه گروه های متصل به گروه عاملی کربوکسیل، الکترون کشنده تر باشند، در این صورت، اتم اکسیژن در گروه کربوکسیل تمایل بیش تری جهت گرفتن الکترون پیوندی دارد. پس راحت تر یون پروتون را آزاد می کند در نتیجه قدرت اسیدی افزایش خواهد یافت. از جمله مهم ترین گروه های الکترون کشنده، هالوژن ها می باشند. در مورد هالوژن ها ذکر سه نکته زیر مهم می باشد :
- هرچه تعداد هالوژن در اسید مربوطه بیشتر باشد، قدرت اسیدی نیز بیشتر خواهد بود.
- هرچه هالوژن به گروه عاملی کربوکسیل، نزدیک تر باشد، تاثیر الکترون کشندگی آن نیز بیش تر خواهد بود. پس قدرت اسیدی نیز بیش تر است.
- هرچه هالوژن متصل به گروه عاملی کربوکسیل، الکترونگاتیوتر باشد، در این صورت قدرت الکترون گیرندگی آن نیز بیش تر خواهد بود. پس قدرت اسیدی نیز بیش تر است.
نکته
حال اگر گروه های الکترون دهنده به گروه عاملی کربوکسیل متصل باشند، باعث تضعیف اسیدیته آن می شوند. از طرفی، هرچه تعداد کربن های گروه آلکیل بیشتر باشد، خاصیت الکترون دهندگی آن نیز بیش تر خواهد بود. پس قدرت اسیدی کم تر می شود به عنوان مثال روند قدرت اسیدی در اسید های کربوکسیلیک زیر را در نظر بگیرید.
HCOOH > CH۳COOH > CH۳CH۲COOH
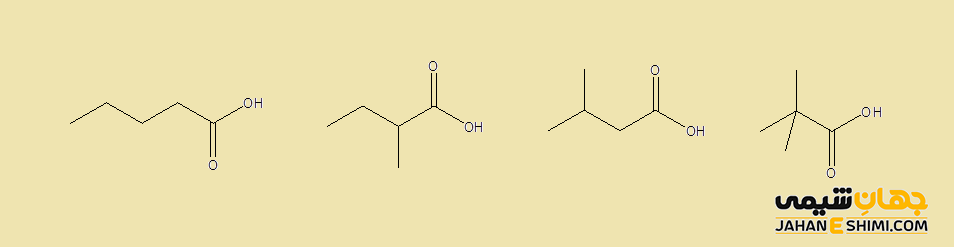
ایزومری اسید های کربوکسیلیک
ایزومر ساختاری در این ترکیبات با تغییر اسکلت کربنی R در فرمول شیمیایی R–COOH بدست می آید. به عنوان نمونه، ایزومر های ساختاری اسید های کربوکسیلیک با فرمول C۵H۱۰O۲ را در شکل زیر مشاهده می کنید.
نامگذاری کربوکسیلیک اسیدها
در نامگذاری آیوپاک، کربوکسیلیک اسید ها را با پسوند اوئیک اسید مشخص می کنند و در حقیقت به صورت آلکانوئیک اسید نامگذاری می شوند. برای نام گذاری، در ابتدا طولانی ترین زنجیر را که عامل اسیدی بر روی آن زنجیر قرار گرفته است، مشخص می کنند. شمارش از سمت گروه عاملی کربوکسیل انجام می شود. به عبارت دیگر، زنجیر اصلی حتما بایستی دارای گروه کربوکسیلیک اسید باشد و همچنین در شماره گذاری، کربن کربوکسیل همیشه شماره یک را می گیرد. سپس با مشخص کردن استخلاف ها، شاخه های فرعی و محل قرارگیری آنها، نام زنجیره اصلی را قید نموده و به آخر آن، پسوند اوئیک (oic) اضافه می شود. دقت داشته باشید که اگر زنجیره دارای پیوند دوگانه نیز باشد، ذکر نوع ایزومر هندسی (سیس یا ترانس) هم لازم می باشد.
اگر اسید کربوکسیلیک مورد نظر، دو عامل اسیدی داشته باشد در این صورت نام گذاری آن بر وزن آلکان دی اوییک اسید خواهد بود مثل دی بوتانوئیک اسید. علاوه بر آن، اگر گروه عاملی کربوکسیل به حلقه بنزن متصل شده باشد، به آن بنزوییک اسید می گویند. از آن جهت که بسیاري از کربوکسیلیک اسید ها، در واقع جزء نخستین ترکیبات آلی استخراج شده و شناخته شده می باشند، تعداد زیادی از آنها علاوه بر نام آیوپاک خود یک نام معمولی نیز دارند. نام معمولی و مشهور آنها در بخش کاربرد ها آورده شده است.
روش تهیه اسیدهای کربوکسیلیک
معمولا دو روش صنعتی و آزمایشگاهی برای تهیه این مواد شیمیایی وجود دارد. این دو روش به دلیل اینکه نیازمند تجیهزات ویژه ای می باشند، با هم تفاوت دارند. به عنوان مثال، نمونه هایی از روش های سنتز صنعتی این ترکیبات عبارتند از :
- کربونیلاسیون الکل ها با استفاده از فرآیند کاتیوا
- کربونیلاسیون آلکن ها به همراه اضافه کردن آب
- اکسیداسیون آلدهید ها در حضور کاتالیزور های منگنز و یا کبالت
- اکسیداسیون الکل ها
- اکسیداسیون هیدروکربن ها با استفاده از هوا
- اکسیداسیون اتن به کمک کاتالیزور سیلیکو تنگستیک اسید
- ازن کافت آلکن ها
- هیدرولیز تری گلیسیرید ها
- تخمیر اتانول
روش های سنتز آزمایشگاهی اسید های کربوکسیلیک اغلب با هزینه های بسیار زیادی همراه می باشد. از جمله این روش ها می توان به موارد زیر اشاره کرد.
- اکسیداسیون الکل های نوع اول یا آلدهید ها به کمک اکسنده های قوی مانند پتاسیم دی کرومات، پتاسیم پر منگنات یا پتاسیم کلریت
- هیدرولیز استر ها، نیتریل ها و یا آمید ها با استفاده از کاتالیزور های اسیدی یا بازی
- کربوناسیون واکنشگر گرینیارد و همچنین واکنشگر اورگانولیتیوم
- کاتالیز بازی آریل کتون ها
- تسهیم نا منتاسب یک آلدهید در واکنش کانیزارو
واکنش های کربوکسیلیک اسید ها
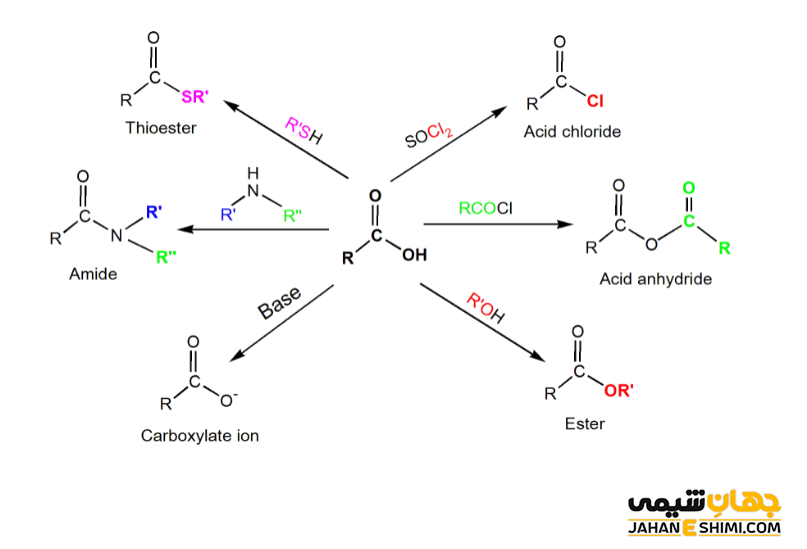
بیشتر واکنش های اسید های کربوکسیلیک شامل تبدیل آنها به استر ها، آمید ها، اسید کلرید ها، الکل ها و نمک های کربوکسیلات می باشند. از دیگر واکنش های آنها می توان به واکنش با باز ها و تولید نمک، احیای اسید ها، تهیه آسیل هالید ها، هالوژن دار شدن آنها و همچنین واکنش های جانشینی هسته دوستی آسیل اشاره کرد. این ترکیبات دارای واکنش های دیگری نیز هستند که بررسی این واکنش ها از حوصله این بحث خارج است. اما دقت داشته باشید که به طور کلی می توان گفت اکسایش الکل ها، آلدهید ها و کتون ها، اسید های کربوکسیلیک را به عنوان محصول می دهد. در حالیکه کاهش اسید های کربوکسیلیک، الکل ها، آلدهید ها و کتون ها را خواهد داد.
کاربرد های کربوکسیلیک اسید ها
این ترکیبات ماده ای ارزشمند در بدن حیوانات و گیاهان می باشند. در واقع می توان گفت که چربی ها و پروتئین ها (اسید آمینه) نوعی اسیدکربوکسیلیک می باشند. علاوه بر آن، مزه ترش بسیاری از خوراکی ها مانند سرکه، آبلیمو و آبغوره نیز به دلیل همین اسید ها می باشد. استر ها از واکنش میان اسیدکربوکسیلیک و الکل بدست می آیند. این دسته از اسید ها در تولید پلیمر، حلال ها، شوینده ها، افزودنی های غذا و صنعت داروسازی کاربرد دارند. چند نمونه از کاربرد اسید های کربوکسیلیک در جدول زیر آورده شده است.
| نام عمومی | نام آیوپاک | فرمول شیمیایی | کاربرد یا محل حضور |
| کربنیک اسید | کربنیک اسید | OHCOOH | خون و بافت |
| فرمیک اسید | متانوئیک اسید | HCOOH | به عنوان نگهدارنده (جلوگیری از فاسد شدن) و آنتی باکتریال در غذای دام و همچنین در مرغداری ها برای از بین بردن باکتری سالمونلا کاربرد دارد. |
| استیک اسید | اتانوئیک اسید | CH۳COOH | سرکه |
| متاکرلیک اسید | متاکرلیک اسید | CH₂C(CH₃)COOH | ماده اولیه در تولید پلیمر ها و همچنین چسب ها |
| پروپیونیک اسید | پروپانوئیک اسید | CH۳CH۲COOH | مواد نگهدارنده، شیر، کره، پنیر |
| آدیپیک اسید | هگزان دی اوئیک اسید | ۴(CH₂)₄(COOH)₂ | ماده اولیه در تولید پلیمر ها |
| باتریک اسید | بوتانوئیک اسید | CH۳(CH۲)COOH | کره |
| والریک اسید | پنتانوئیک اسید | CH۳(CH۲)۳COOH | سنبل الطیب |
| سیتریک اسید | ۲- هیدروکسی، ۱ و ۲ و ۳ پروپان تری کربوکسیلیک اسید | HOC(CH₂COOH)₂ | به عنوان طعم دهنده و همچنین نگهدارنده در غذ اها و نوشیدنی ها |
| کاپروییک اسید | هگزانوئیک اسید | CH۳(CH۲)۴COOH | چربی حیوانی مانند چربی بز |
| مالئیک اسید | سیس بوتن،۱و۴دی اوئیک اسید | HO₂CCH=CHCO₂H | ماده اولیه در تولید پلیمر ها |
| انانتیک اسید | هپتانوئیک اسید | CH۳(CH۲)۵COOH | گیاه پیچک |
| کاپریلیک اسید | اوکتانوئیک اسید | CH۳(CH۲)۶COOH | گیاه نارگیل |
| پلارگونیک اسید | نونانوئیک اسید | CH۳(CH۲)۷COOH | گیاه شمعدانی |
| ترفتالیک اسید | ۱و۴ بنزن دی کربوکسیلیک اسید | C₆H₄(COOH)₂ | در تولید پلیمر ها |
| بنزوئیک اسید | بنزوئیک اسید | C₆H₅COOH | نگهدارنده های غذایی |



















