
در علم شیمی، خواص کولیگاتیو (Colligative properties) به خواصی از محلول ها گفته می شود که به تعداد ذرات حل شونده غیر فرار موجود در محلول بستگی دارند. این خواص مستقل از نوع و خواص شیمیایی ذرات می باشند. در واقع خواص کولیگاتیو فقط به نسبت تعداد ذرات حل شونده به تعداد ذرات حلال بستگی دارند. به بیان دیگر، در بعضی مواقع، تعدادی از خواص محلول ها به جای اینکه وابسته به ماهیت محلول باشند، به غلظت ماده حل شده بستگی دارند. در واقع می توان گفت که تعداد بسیار کمی از خواص فیزیکی، در دسته خواص کولیگاتیو قرار می گیرند. این خواص عبارتند از : فشار بخار، نقطه جوش، نقطه انجماد و فشار اسمزی. در ادامه این مقاله در نشریه جهان شیمی فیزیک به بررسی خواص کولیگاتیو و انواع مختلف آن پرداخته می شود. لطفا با ما همراه باشید.
فهرست مطالب این مقاله
۱- مقدمه
۲- خواص کولیگاتیو
۳- اثر افزایش غلظت بر خواص کولیگاتیو
۱-۳- کاهش فشار بخار
۲-۳- افزایش دمای جوش
۳-۳- کاهش نقطه انجماد
۴-۳- فشار اسمزی
۴- کاربرد های خواص کولیگاتیو
مقدمه
به طور کلی خواص یک محلول متفاوت از خواص حلال یا حل شونده خالص است. بسیاری از خواص محلول ها به ماهیت شیمیایی حل شونده ها بستگی دارند. از طرفی دیگر، برخی دیگر از این خواص، مستقل از ماهیت آنها می باشند. خصوصیات فیزیکی محلول ها را می توان به دو دسته خواص شدتی و خواص مقداری تقسیم بندی کرد. خواص شدتی خواصی هستند که به اندازه نمونه بستگی دارند. به عنوان مثال، حجم و جرم نمونه ای از این گونه خواص اند. در حالیکه، خواص مقداری خواصی هستند که به اندازه نمونه مورد بررسی بستگی ندارند. چگالی و غلظت نمونه ای از خواص مقداری اند. در این مقاله دسته ای از خواص فیزیکی معرفی می شوند که در حقیقت زیر مجموعه ای از خواص شدتی اند که به آنها خواص کولیگاتیو می گویند.
نکته جالب توجه اینجاست که تمامی انسان ها بدون آنکه با اصطلاح علمی خواص کولیگاتیو آشنا باشند، در طول زندگی روزمره خود با این خواص، سر و کار دارند. در واقع، بدون آنکه بتوانند علت اتفاق افتادن این گونه پدیده ها را توضیح دهند، با آنها درگیرند. مثلا به صورت تجربی، می دانند که محلول آب و شکر از آب خالص دیرتر به جوش می آید. همچنین متوجه شده اند که محلول آب و نمک و یا محلول آب و شکر در دما های پایین تر از آب خالص منجمد می شوند. از جمله موارد دیگر خواص کولیگاتیو در زندگی روزمره می توان به موارد استفاده از ضد یخ در رادیاتور ماشین جهت پیشگیری از یخ زدن آن و همچنین پدیده اسمز در فرآیند های زیستی اشاره کرد.

خواص کولیگاتیو
همانطور که بیان شد، خواص کولیگاتیو به مجموعه خواصی از محلول ها گفته می شود که به تعداد ذرات حل شونده غیر فرار موجود در محلول (یون یا مولکول) بستگی دارند. اما سوالی که در اینجا مطرح می شود اینست که حل شونده فرار یا غیر فرار به چه موادی گفته می شود ؟
حل شونده غیر فرار به ماده ای می گویند که نقطه جوش آن، بالاتر از صد درجه سانتیگراد است. به عبارتی دیگر، در دمای محیط، فشار بخار بسیار ناچیزی دارد. در تعریف کلی تر می توان گفت که ماده غیر فرار به ماده ای گفته می شود که نقطه جوش آن بالاتر از نقطه جوش حلال مربوطه باشد. از جمله مواد غیر فرار می توان به انواع نمک ها و یا مایع هایی با نقطه جوش بالا اشاره کرد. به طور مشابه می توان گفت که مایع فرار به مایعاتی گفته می شود که نقطه جوش آنها، از صد درجه سانتیگراد کمتر است. از جمله مایعات فرار معروف می توان به استون و اتانول اشاره نمود. توجه داشته باشید که بحث مواد شیمیایی فرار و غیر فرار فقط برای مواد خالص مطرح است.
در تعریف خواص کولیگاتیو اینطور گفته شده است که این خواص فقط به تعداد نسبی ذرات ماده حل شده و همچنین ذرات حلال حاضر در حجم مشخصی از محلول، بستگی دارند. در حقیقت خواص کولیگاتیو مستقل از ماهیت ماده حل شده و یا نوع ذرات اند. به طور کلی، نوع ذرات به ویژگی هایی مثل بار، فرمول شیمیایی، نوع اتم های سازنده، حجم و سایر موارد مربوط می شود. به عنوان نمونه در بررسی خواص کولیگاتیو محلول ها، تاثیر یک مول آنیون کلر با تاثیر یک مول شکر تفاوتی نخواهد داشت. زیرا در اینجا فقط تعداد ذرات (مول ها) مهم خواهند بود نه نوع یا ماهیت آنها.
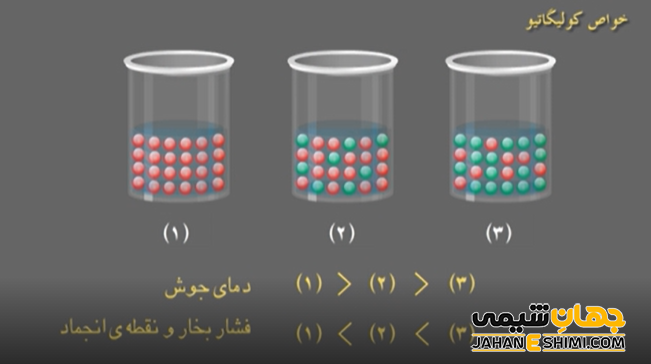
خواص کولیگاتیو شامل موارد زیر می شوند :
- کاهش نسبی فشار بخار
- افزایش یا صعود نقطه جوش
- نزول نقطه انجماد
- فشار اسمزی
اثر افزایش غلظت بر خواص کولیگاتیو
از آنجاییکه خواص کولیگاتیو به غلظت وابسته اند، بنابراین متاثر از غلظت خواهند بود. در ادامه مقاله به بررسی تاثیر غلظت بر روی خواص گولیکاتیو پرداخته می شود.
کاهش فشار بخار
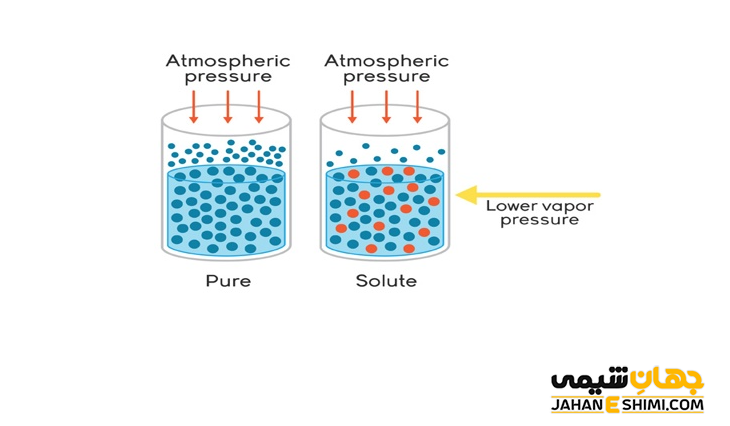
همانطور که می دانید، تبخیر سطحی به جدا شدن مولکول های مایع از سطح آن گفته می شود. بر اثر تبخیر سطحی، به دیواره های ظرف، مولکول های هوا و غیره فشار وارد می شود. دقت داشته باشید که به فشار ناشی از حضور مولکول های بخار مایع در بالای سطح، فشار بخار گفته می شود. در واقع، فشار بخار در دمای معین، ثابت است.
حالا شرایطی را در نظر بگیرید که غلظت افزایش یافته است. در اثر افزایش غلظت، مولکول های حل شونده به جای تعدادی از مولکول های حلال قرار خواهند گرفت. در صورتیکه حل شونده، غیر فرار باشد؛ تعداد مولکول های تبخیر شده کاهش می یابد. در نتیجه فشار بخار مایع کاهش پیدا می کند.
به بیان دیگر، حضور مواد حل شونده در سطح مایع باعث می شود که تعداد کمتری از مولکول های حلال را در سطح مایع داشته باشید. بنابراین، سرعت تبخیر حلال کاهش پیدا می کند. لازم به ذکر است که بررسی ها نشان داده که کاهش فشار بخار، یکی از خواص کولیگاتیو خواهد بود. در حقیقت این کاهش، مستقیم به غلظت ماده حل شده بستگی دارد. بنابراین مستقل از ماهیت مولکول های حل شده می باشد.
افزایش دمای جوش
همانطور که می دانید، تبخیر زمانی انجام می شود که فشار بخار مایع مورد نظر با فشار هوای محیط، برابر شود. به بیان دیگر، نقطه جوش يك مايع به دمايي می گویند كه در آن دما، فشار بخار مايع با فشار جو یکسان شده است. لازم به ذکر است که جوشيدن یک مايع تحت تاثير دما قرار دارد. در واقع با افزايش گرمای داده شده به مایع، دمای آن مايع زياد نمی شود. بلكه سرعت جوشش آن مایع بيشتر می گردد. دقت کنید که نقطه جوش مايع مورد نظر با تغييرات فشار خارجی، تغيير خواهد کرد.
از آنجاییکه افزایش غلظت سبب کاهش فشار بخار محلول می شود، پس به انرژی بیشتری نیاز خواهد بود. به کمک این انرژی بیشتر، مولکول های عمقی تر محلول در نتیجه جنب و جوش خود، به سطح محلول آمده و تبخیر می شوند. در این صورت، فشار بخار افزایش می یابد. بنابراین افزایش غلظت باعث افزایش نقطه جوش (میعان) می گردد.
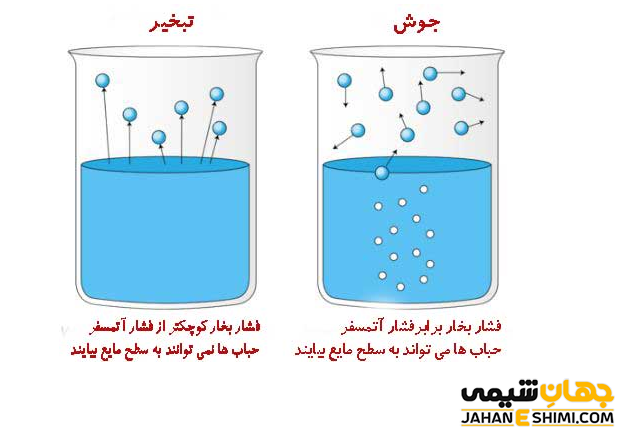
با توضیحات فوق مشخص می شود که یک محلول متشکل از ماده حل شده غیر فرار، همواره در دمایی بیشتر از نقطه جوش حلال به جوش خواهد آمد. حال اگر محلول رقیق باشد، صعود نقطه جوش به صورت مستقیم به غلظت ماده حل شده بستگی دارد. به عبارت دیگر، افزایش نقطه جوش محلول های شامل مواد حل شده غیر فرار را می توان بر اساس کاهش فشار بخار توجیه نمود. از آن جهت که محلول مورد نظر در هر دمایی، فشار بخار کمتری نسبت به فشار بخار حلال خالص خواهد داشت. از این رو، محلول ذکر شده جهت جوشیدن بایستی به دمای بالاتر برسد. در واقع رسیدن به این دما باید قبل از آنکه فشار بخار محلول با فشار جو برابر باشد، صورت بگیرد.
نکته مهم
افزایش یا صعود نقطه جوش در یک محلول را می توان با استفاده از فرمول زیر محاسبه کرد :
∆Tb=Kb × m
در این معاله؛ Tb∆ صعود نقطه جوش بر حسب درجه سلسیوس، m غلظت مولاریته و Kb ثابت مربوط به حلال مورد نظر است. به عنوان مثال، Kb برای آب مقدار ۰/۵۲ درجه سلسیوس است.
کاهش نقطه انجماد
با سرد شدن و کاهش دمای یک مايع، حركت مولكول های آن مایع، كند می شود. در نهایت و در دمايی معين، انرژی جنبشی تعدادی از این مولكول ها کاهش می یابد. این کاهش انرژی جنبشی به حدی می رسد كه نيروهای بين مولكولی قادرند آنها را در يك شبكه بلوری در کنار هم نگه دارند. در اين صورت انجماد آغاز می گردد. بدین شکل مولكول های كم انرژي به تدریج در نقاطي از شبكه بلور قرار می گيرند.
از طرفی، محلول هایی که مقدار کمی از ماده حل شده دارند، در دمای پایین تری نسبت به حلال خالص منجمد یا ذوب می گردند. در حقیقت، نزول نقطه انجماد یا ذوب نیز مانند صعود نقطه جوش، نتیجه مستقیم کاهش فشار بخار حلال به دلیل حضور ماده حل شده است. به عبارت دیگر، با تغییرات در فشار بخار، تغییرات در نقطه ذوب و نقطه جوش حلال ایجاد می شود. همانطور که بیان شد، تغییرات فشار بخار یک خاصیت کولیگاتیو است، از این رو، تغییرات در نقطه جوش و نقطه ذوب حلال نیز از خواص کولیگاتیو محسوب می شوند. نزول نقطه انجماد در یک محلول را می توان با استفاده از فرمول زیر محاسبه کرد :
∆Tf=Kf × m
در این معاله؛ Tf∆ نزول نقطه انجماد بر حسب درجه سلسیوس، m غلظت مولالیته و Kf ثابت مربوط به حلال مورد نظر است. به عنوان مثال، Kf برای آب مقدار ۱/۸۶- درجه سلسیوس است.
فشار اسمزی
فشار اسمزی یکی دیگر از خواص کولیگاتیو محلول ها است. فرض کنید دو ظرف جداگانه دارید که به وسیله غشاء نیمه تراوا به یکدیگر وصل شده اند. غشای نیمه تراوا، غشایی است که نسبت به بعضی مولکول ها نفوذ پذیر و نسبت به بعضی دیگر از آنها نفوذ ناپذیر است. به بیان دیگر، این غشا اجازه عبور مولکول های آب و یا حلال را می دهد، در حالیکه مولکول های حل شونده اجازه عبور از آن را ندارند. در واقع مولکول های آب یا حلال در طی فرآیند اسمز، همیشه از نواحی رقیق تر (حل شونده کمتر و غلظت پایین تر) به نواحی که غلظت بالاتری دارند نفوذ می کنند.
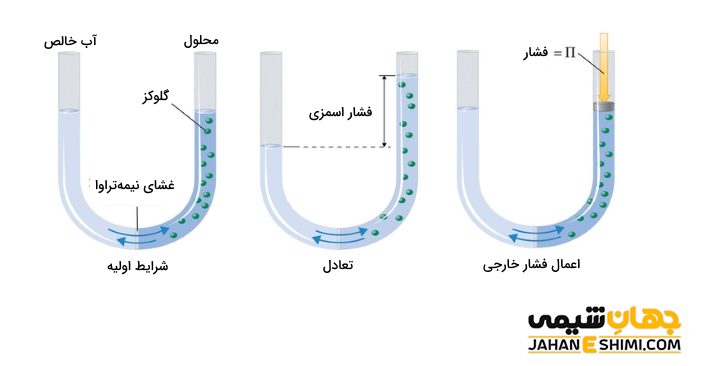
به عنوان مثال، فرض کنید در یکی از این دو ظرف، آب خالص و در دیگری محلول آب قند وجود دارد. با گذشت زمان، سطح مایع در ظرف حاوی آب خالص پایین می آید. در حالیکه در ظرف حاوی محلول قندی بالا خواهد رفت. در حقیقت به دلیل تبخیر و میعان، تمام آب خالص به محلول منتقل می شود. در حقیقت فشار اسمزی به دلیل اختلاف فشار بخار آب در دو بشر است. همانطور که بیان شد، آب خود به خود از ظرفی که فشارش بالاتر است به ظرفی که فشار بخارش پایینتر است، منتقل می شود. لازم به ذکر است که هرچه غلظت افزایش یابد، در نتیجه فشار اسمزی نیز افزایش می یابد.
جالب است بدانید که
فشار اسمزی یک محلول رقیق از خواص کولیگاتیو است. زیرا این خاصیت با غلظت ماده حل شده نسبت مستقیم دارد، اما مستقل و جدا از ماهیت ماده حل شده می باشد. فشار اسمزی را می توان به کمک معادله زیر محاسبه کرد :
π = MRT
در این معاله؛ π فشار اسمزی بر حسب اتمسفر، M غلظت مولاریته، T دما بر حسب کلوین و R ثابت جهانی گازها است. از آنجاییکه مولاریته برابر با n/V است (n نماد مول و V نماد حجم)، بنابرابن معادله فشار اسمزی را می توان به شکل زیر نوآرایی کرد :
πV = nRT
کاربرد های خواص کولیگاتیو
با استفاده از خواص کولیگاتیو می توان تعداد مول یا ذرات ماده حل شده در مقدار معینی از حلال را تعیین کرد. همچنین به محاسبه جرم مولکولی ماده حل شده پرداخت. همچنین به کمک خواص کولیگاتیو و روشی به نام اسمز معکوس، می توان از آب دریا، آب خالص تهیه کرد.



















