
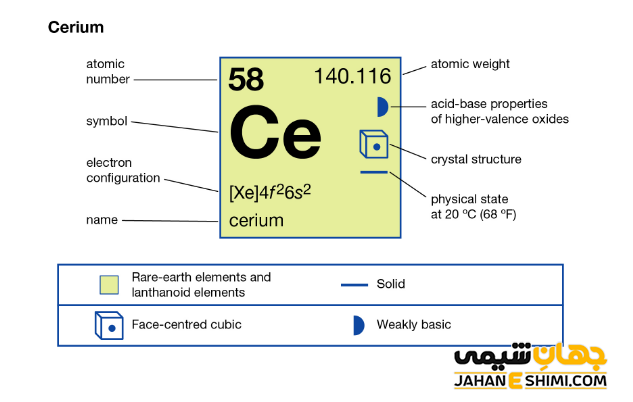
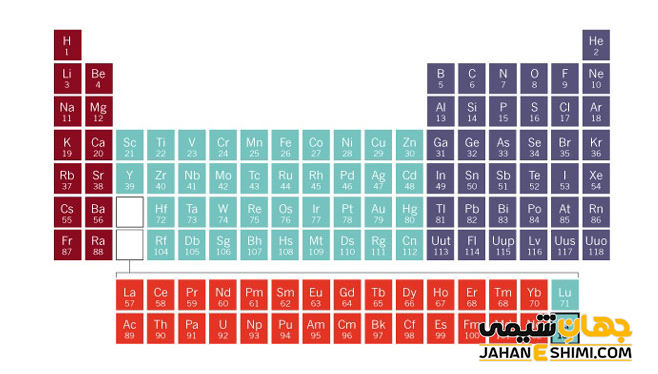
عنصر سریم (Cerium) با نماد شیمیایی Ce، یکی از عناصر شیمیایی جدول مندلیف است که عدد اتمی آن ۵۸ می باشد. این عنصر در حقیقت پنجاه و هشتمین عنصر از جدول تناوبی بوده که در گروه IIIB و دوره ششم جدول تناوبی قرار دارد. در واقع عنصر سریم یک فلز واسطه (Transition Metals) نرم به رنگ خاکستری و از عناصر گروه لانتانید ها است. این فلز با عناصر اسکاندیم (Sc)، ایتریم (Y) و آکتینیوم (AC)، در گروه سوم واسطه جدول تناوبی قرار گرفته است. در ادامه این مقاله در نشریه جهان شیمی فیزیک به بررسی عنصر سریوم پرداخته می شود. لطفا با ما همراه باشید.
فهرست مطالب این مقاله
۱- تاریخچه کشف عنصر سریم
۲- پیدایش و منابع عنصر شماره ۵۸ جدول تناوبی
۳- ویژگی های فیزیکی و شیمیایی عنصر سریم
۱-۳- لانتانید ها
۴- ایزوتوپ های عنصر سریم
۵- کاربرد های عنصر سریم
۶- ترکیبات عنصر سریم
۷- خطرات سریوم بر روی سلامتی انسان
تاریخچه کشف عنصر سریم
عنصر سریم برای اولین بار در سال ۱۸۰۳ میلادی، توسط شیمیدانان سوئدی به نام های ویلهلم هیزینگر (Wilhelm von Hisinger) و یاکوب برزلیوس (Jacob Berzelius) در سوئد و در همان سال به صورت مستقل توسط شیمیدان آلمانی یعنی کلاپروت (Martin Heinrich Klaproth) در آلمان، کشف شد. برزیلس نام این عنصر را از روی نام خرده سیاره استروئیدسرس که دو سال قبل (یعنی در سال ۱۸۰۱ میلادی) کشف شده بود، انتخاب کرد. این عنصر در واقع از طریق خالص سازی کانی معدنی که از معدن آهن در شهر بوستون بدست آمده بود، کشف شد.

پیدایش و منابع عنصر شماره ۵۸ جدول تناوبی
عنصر سریم در گروه عناصر کمیاب زمین قرار دارد. این عنصر در واقع بیست و ششمین عنصر فراوان پوسته زمین است، یعنی چیزی در حدود نصف عنصر کلر و پنج برابر سرب. این عنصر فراوان ترین عنصر خاکی نادر است که در کانی های کمیابی همچون سریت، مونازیت، آلانیت و باستنازیت پیدا می شود. توجه داشته باشید که کانی های مونازیت (Ce, La, Th, Nd, y, PO۴)، آلانیت ((Ca, Ce, La, Y) 2(Al, Fe)۳ (SiO۴)۳ (OH)) و باستنازیت (Ce, La, Y, CO۳F) از مهمترین منابع سریم محسوب می شوند. این عنصر بیشتر به وسیله یک فرآیند جابجایی یونی تولید می شود. در حقیقت در طی آن، از دانه های مونازیت به عنوان منبع سریم بهره می برند.
ویژگی های فیزیکی و شیمیایی عنصر سریم
عنصر سریم، فلزی چکش خوار، نرم و انعطاف پذیر است که به راحتی با چاقو بریده می شود. احتمال سوختن نوع خالص این فلز در صورتیکه با چاقو خراشیده شود، وجود دارد. به دلیل قابلیت چکش خواری بالایی که دارد، می تواند به راحتی به ورقه هایی صاف تبدیل شود. از لحاظ رنگ و درخشش شبیه آهن می باشد. به علاوه عنصری بسیار واکنش پذیر است، در حدی که در میان عناصر خاکی کمیاب، تنها اروپیم واکنش پذیرتر از آن است. سریوم در آب سرد به آهستگی و در آب گرم و داغ بسیار سریع تجزیه می شود. از طرفی، محلول های قلیایی رقیق و یا اسید های غلیظ به سرعت، این فلز را مورد حمله قرار می دهند.
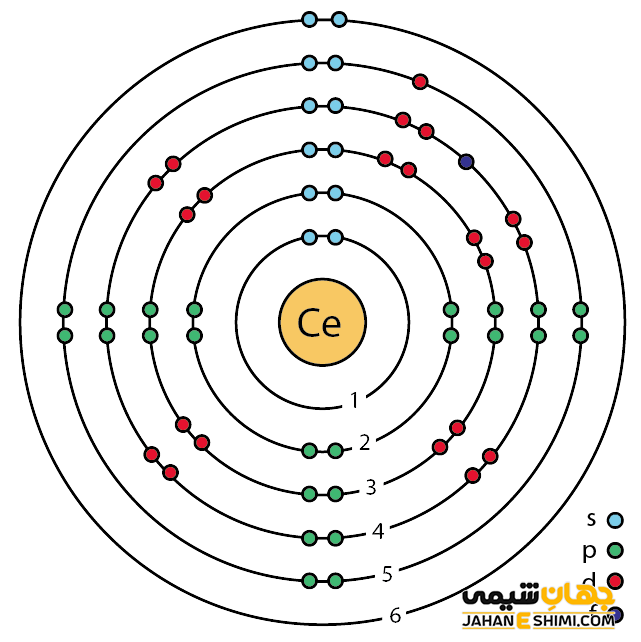
خصوصیات قابل توجه سریم از ساختار اتمی آن ([Xe] 4f۱۵d۱۶s۲) ناشی می شود. همانطور که مشخص است، اوربیتال f در این عنصر در حال پر شدن است. این عنصر به واسطه آرایش الکترونی که دارد، در دسته فلزات واسطه داخلی و در واقع گروه لانتانید ها قرار می گیرد. فلزات واسطه در حقیقت بین فلزات قلیایی خاکی و عناصر گروه بور در جدول تناوبی قرار گرفته اند. به عناصر واسطه، عناصر گروه B نیز گفته می شود. لازم به ذکر است که به لانتانید ها و اکتینید ها عناصر واسطه داخلی گفته می شود. با توجه به آرایش الکترونی مشخص است که چهار الکترون در دورترین لایه الکترونی سریوم وجود دارد. پس می تواند به صورت کاتیون چهار بار مثبت (+Ce۴) نیز ظاهر شود. حالت اکسیداسیون آن بیشتر ۳+ و ۴+ است. از این رو می تواند در سه یا چهار پیوند کووالانسی شرکت کند.
جالب است بدانید که
به علت نزدیکی نسبی اوربیتال ۴f و اوربیتال های لایه بیرونی عنصر سریم، این عنصر دارای خواص شیمیایی جالب توجهی می باشد. به عنوان نمونه، فشردن این عنصر زمانیکه در حال سرد شدن است، می تواند حالت اکسیداسیون آن را از ۳ به ۴ تغییر دهد. لازم به ذکر است که عنصر شماره ۵۸ جدول تناوبی در حالت اکسیداسیون +۳ را cerous و در حالت اکسیداسیون +۴ را cericمی نامند. از این رو، نمک های سریم (IV) به رنگ های نارنجی، قرمز یا زردفام می باشند، درحالیکه نمک های سریم (III) اغلب سفید رنگند. توجه داشته باشید که حالت اکسیداسیون +۴ پایدار است.
- حالت فیزیکی آن در دمای ۲۵ درجه سلسیوس و فشار ۱ اتمسفر به صورت جامد است.
- دمای ذوب و دمای جوش این عنصر به ترتیب ۷۹۵ و ۳۴۴۳ درجه سانتی گراد است.
- عنصر سریم پارا مغناطیس است.
- ساختار بلوری آن به شکل ساختار کوبیک یا مکعبی است.
- این عنصر آلوتروپ ندارد.
- جرم اتمی سریم برابر با ۱۴۰.۱۱۶ g/mol است.
- چگالی آن نیز برابر با ۶.۷۷۰ g/cm۳ می باشد.
- شعاع اتمی آن نیز برابر با pm 204 ± ۹ می باشد.
- یون های سریم معمولا عدد اکسایش برابر با اعداد ۰، +۱،+۲ ، +۳ و +۴ دارند. در حقیقت یک اکسید بازی ملایم محسوب می شود. اعداد اکسایش ۰، +۳ و +۴ متداول تر می باشند.
- اولین انرژی یونیزاسیون آن برابر با ۵۳۴.۴ kJ/mol است.
لانتانید ها
واژه لانتانید (Lanthanide) از فلز لانتان گرفته شده است (به معنای شبیه لانتان) که به طور کلی با نماد شیمیایی Ln نمایش داده می شوند. لانتانید ها در واقع شامل ۱۵ عنصر با عدد های اتمی ۵۷ (لانتان) تا ۷۱ (لوتتیم) است. این گروه از عناصر به دلیل کمبود جا و همچنین برای اینکه نظم و ترتیب جدول تناوبی حفظ شود، در یک ردیف ۱۴ تایی در پایین جدول قرار گرفته اند. تمامی لانتانید ها به جز لانتان جز بلوک f می باشند. لانتان جز بلوک d جدول تناوبی محسوب می شود، اما خواص آن شبیه به چهارده لانتانید دیگر خواهد بود.
در تناوب ششم جدول تناوبی، اوربیتال ۶s اثر پوششی کمی بر روی اوربیتال های۴f دارد. بنابراین زمانیکه این اوربیتال از الکترون پر شود، اوربیتال های ۵d و ۴f با تاثیر پذیری از بار موثر و مثبت هسته به سطح پایین تری از انرژی می روند. از این رو، تراز های انرژی این سه اوربیتال به هم نزدیک خواهند بود. الکترون بعدی در لانتان به اوربیتال ۵d اضافه می شود. اما در عناصر بعدی، الکترون به جای اوربیتال ۵d به اوربیتال ۴f اضافه می شود (به دلیل پایداری بیشتر در این حالت).
۴f، در واقع اولین زیر لایه ای است که در بلوک f پر می شود. این زیر لایه در حقیقت بعد از زیر لایه ۶s شروع به پر شدن می کند. همانطور که می دانید ۷ اوربیتال بلوک f می توانند تا چهارده الکترون را در خود جای دهند. از این رو، این بلوک میتواند شامل ۱۴ عنصر است. بنابراین این گروه با فلز سریوم (۴f۰۵d۱۶s۲) آغاز و به فلز لوتتیم (۴f۱۴۵d۱۶s۲) ختم می شود.
ایزوتوپ های عنصر سریم
همانطور که می دانید، ایزوتوپ های یک عنصر، در تعداد نوترون ها با یکدیگر تفاوت دارند. عنصر سریم ایزوتوپ های فراوانی دارد. سریم به صورت طبیعی دارای سه ایزوتوپ پایدار ۱۳۶Ce (0.185 %)، ۱۳۸Ce (0.251 %) و ۱۴۰Ce (88.45 %) و یک ایزوتوپ رادیواکتیو ۱۴۲Ce (11.114 %) می باشد. همانطور که مشاهده می کنید، ۱۴۰Ce فراوان ترین ایزوتوپ طبیعی این عنصر است. علاوه بر آن، ۲۷ ایزوتوپ پرتوزای سریم نیز شناخته شده است. پایدارترین رادیوایزوتوپ های سریم ۱۴۲Ce با نیمه عمر ×۱۰۱۶ ۵سال و ۱۴۴Ce با نیمه عمر ۸۹۳/۲۸۴ روز می باشند. بقیه رادیو ایزوتوپ های آن، نیمه عمری کمتر از ۴ روز دارند. لازم به ذکر است که حتی نیمه عمر بیشتر آنها کمتر از ده دقیقه است. ایزوتوپ های رادیواکتیو این عنصر دارای جرم های ۱۲۳ تا ۱۵۲ می باشند.

کاربرد های عنصر سریم
یکی از کاربرد های سریم، تهیه آلياژ است. این فلز در ساخت آلیاژ های آلومینیوم، آهن و برخی از فولاد ها بکار می رود. در واقع، وجود سریم در فولاد ها، باعث کاهش سولفید ها و اکسید ها می شود، در نتیجه مانع گازی شدن آن می گردد. در حالیکه در فولاد ضد زنگ، سریوم به عنوان عامل سخت کننده سریع استفاده می شود. اضافه کردن سریم به چدن نیز مانع تشکیل گرافیک در هنگام انجماد می گردد. در این صورت، باعث تولید نوعی چدن چکش خوار (مالیبل) می شود. به علاوه، اضافه کردن سریم (۳ تا ۴ درصد) به همراه زیرکونیوم (۰/۲ تا ۰/۶ درصد) به آلیاژ های منیزیم، باعث مقاومت منیزیم قالب گیری شده در برابر حرارت خواهد شد. سریم همچنین در آلیاژ هایی که به منظور ساخت آهنربا های دائمی کاربرد دارند، استفاده می گردد.
از عنصر شماره ۵۸ جدول تناوبی و دیگر عناصر کمیاب، جهت نور پردازی قوس های کربنی به ویژه در صنعت تصویر متحرک (سینما) بهره می برند. ترکیبات این عنصر به عنوان کاتالیزور در پالایش نفت، متالورژیکی و سنتز های آلی استفاده می شود. ترکیبات سریوم همچنین در فرآیند تولید شیشه کاربرد دارند. در واقع هم به صورت جزئی از شیشه و هم به صورت رنگ زدا. این ترکیبات جهت رنگ لعاب نیز کاربرد دارند. به عنوان نمونه، سولفات سریک در آزمایش های کمی، به عنوان یک عامل اکسید کننده حجمی به طور گسترده کاربرد دارد. علاوه بر این، سریوم یک قطعه از فلز میش متال است که در تولید آلیاژ های آتشگیر، در فندک سیگار کاربرد زیادی دارد. از طرفی دیگر، فسفر YAG دوپ شده با سریم به همراه دیود های ساطع کننده نور آبی جهت تولید منابع نور LED سفید کاربرد دارد.

جالب است بدانید که
امروزه اکسید سریم نیز کاربرد های گوناگونی دارد. به عنوان مثال، در توری های گازی پر نور مورد استفاده قرار می گیرد. از دیگر کاربرد های اکسید سریوم می توان به موارد زیر اشاره کرد.
- به عنوان کاتالیزور؛ این اکسید در فرآیند پالایش نفت خام به عنوان یک سرعت دهنده جداسازی استفاده می شود.
- پولیش اکسید سریوم؛ در واقع یک ماده مهم به منظور پوشش گازی گداخته است. به عنوان یک کاتالیزور هیدروکربن جهت پالایش کوره ها کاربرد دارد.
- هدایت الکتریکی؛ به عنوان یک هادی با ارزش در تحقیق و توسعه پیل های سوختی مورد استفاده قرار می گیرد.
- اپتیک؛ جهت بی رنگ کردن شیشه های حاوی نا خالصی های آهنی سبز رنگ کاربرد دارد. همچنین، امکان جذب انتخابی اشعه فرا بنفش را در شیشه ها ایجاد می کند. به منظور صیقل دادن شیشه ها نیز استفاده می شود.
- کاربردهای پزشکی؛ نانو ذرات اکسید سریم از لحاظ فعالیت ضد باکتری و آنتی اکسیدانی در پزشکی بسیار مطلوب هستند.
ترکیبات عنصر سریم
اکسید سریم (Cerium oxide) که با عناوین سریا، اکسید سریک، دی اکسید سریک، سریم دی اکسید یا دی اکسید سریم نیز شناخته می شود، یکی از مهمترین ترکیبات کاربردی فلز سریم است. این اکسید یک پودر سفید یا زرد مایل به سفید می باشد. سریوم همچنین می تواند به راحتی با هالوژن ها و فلزات واکنش دهد. از دیگر ترکیبات آن می توان به موارد زیر اشاره کرد.
- اکسید سریم یا اکسید سریم (IV) (CeO۲)
- تری اکسید دی سریم یا اکسید سریم (III) (Ce۲O۳)
- دی هیدرید سریم (CeH۲)
- تری هیدرید سریم (CeH۳)
- کلرید سریم (CeCl۳)
- سریک آمونیوم نیترات (H۸N۸CeO۱۸)
- سریوم (IV) سولفات (Ce(SO۴)۲)
- سریم(III) سولفات (Ce۲ (SO۴)۳)
- سریم تالیوم (CeTl)
- سریم جیوه (CeHg)
- سریم روی (CeZn)
- سریم کادمیوم (CeCd)
- سریم منیزیوم (CeMg)
- سریم نقره (CeAg)

خطرات سریوم بر روی سلامتی انسان
عنصر سریم نیز مانند بقیه لانتانید ها دارای میزان سمی بودن ضعیف تا متوسط است. این عنصر، یک عامل کاهنده قوی محسوب می شود. در حرارت ۸۰-۶۵ درجه سانتیگراد در هوا به صورت خود به خود می سوزد. واکنش سریوم با عنصر روی می تواند به صورت انفجاری باشد. با عناصر بیسموت و آنتیموان واکنش های بسیار گرما زایی خواهد داشت. دقت داشته باشید که دود حاصل از سوختن سریم، بسیار سمی است. به منظور جلوگیری از سوختن سریم، نباید به هیچ وجه از آب بهره برد. زیرا عنصر سریم با آب جهت تولید گاز هیدروژن واکنش می دهد.
کارگرانی که با سریوم کار می کنند، عوارضی مانند خارش، حساسیت به گرما و آسیب های بدنی را گزارش کرده اند. حیواناتی که مقدار زیادی سریم به آنها تزریق شده است، به دلیل مشکلات قلبی و رگی از بین رفته اند. علاوه بر آن، اکسید سریم (IV) در دمای بالا عامل یک اکسید کننده قوی است. همچنین با مواد آلی قابل احتراق واکنش می دهد. توجه داشته باشید که اگر سریوم رادیواکتیو نباشد، عیار تجاری نا خالص آن می تواند شامل مقادیر کمی توریم رادیواکتیو باشد. لازم به ذکر است که برای عنصر سریم هیچ نقش بیولوژی شناسایی نشده است.




















