
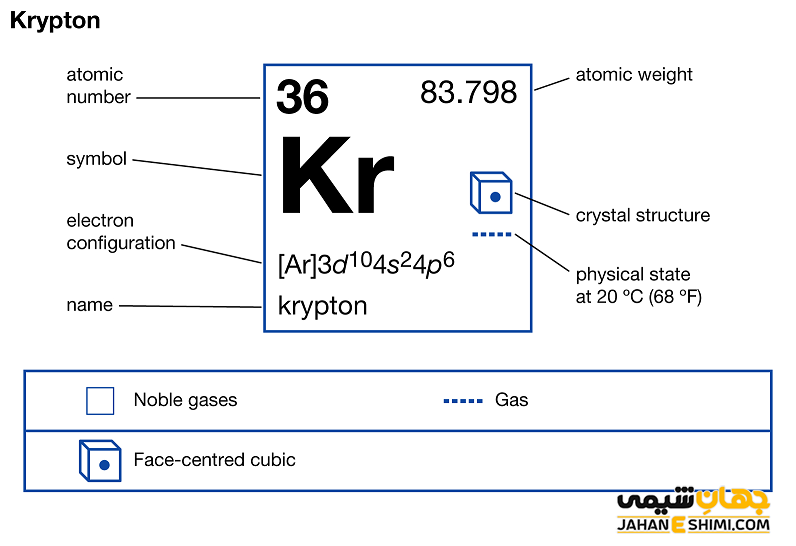
عنصر کریپتون (Krypton) با نماد شیمیایی Kr، یکی از عناصر شیمیایی جدول مندلیف است که عدد اتمی آن ۳۶ می باشد. این عنصر در حقیقت سی و ششمین عنصر از جدول تناوبی بوده که در گروه هجده (XVIII) و دوره چهارم جدول تناوبی عناصر قرار گرفته است. در واقع عنصر کریپتون گازی است بی رنگ، خنثی، بی بو و بدون مزه که از عناصر گروه گاز های نجیب (Noble Gas) می باشد. این گاز با عناصر هلیم (He)، نئون (Ne)، آرگون (Ar)، زنون (Xe)، رادون (Rd)، و اگانسون (Og)، در گروه هشت اصلی IA و بلوک p جدول تناوبی قرار گرفته است. در ادامه این مقاله در نشریه جهان شیمی فیزیک به بررسی عنصر کریپتون پرداخته می شود. لطفا با ما همراه باشید.
تاریخچه کشف عنصر کریپتون
عنصر کریپتون برای نخستین بار در سال ۱۸۹۸ میلادی، توسط شیمیدان اسکاتلندی به نام ویلیام رمزی (William Ramsay) و شیمیدان انگلیسی به نام موریس تراورز (Moris Travers) در لندن کشف شد. در واقع کریپتون یکی از اجزای باقیمانده، بعد از تبخیر تقریبا تمام اجزای هوای مایع بود. عناصر نئون و زنون نیز با فرآیند مشابهی توسط این شیمیدان کشف شده اند. لازم به ذکر است که ویلیام رمزی در سال ۱۹۰۴ میلادی، به دلیل کشف مجموعه گاز های نجیب همچون کریپتون موفق به دریافت جایزه نوبل شیمی شده است. واژه کریپتون از کلمه یونانی کریپتوس (kryptos) به معنای پنهان و مخفی گرفته شده است. زیرا این عنصر برای مدت زیادی به صورت کشف نشده باقی مانده بود.

پیدایش و منابع عنصر شماره ۳۶ جدول تناوبی
گاز کریپتون به مقدار بسیار جزئی در اتمسفر وجود دارد. مقدار این گاز در اتمسفر زمین به طور تقریبی برابر با ۱ ppm است. گاز کریپتون را می توان به وسیله تقطیر جزء به جزء هوای مایع بدست آورد. از جمله منابع آن می توان به آزمایش بمب اتمی، رآکتور های اتمی و در نتیجه رها شدن Kr-85 از رآکتور های اتمی در طی فرآیند مجدد میله های سوخت اشاره کرد.
ویژگی های فیزیکی و شیمیایی عنصر کریپتون
کریپتون گازی تک اتمی و غیر قابل اشتعال است. خصوصیات ویژه و قابل توجه کریپتون از ساختار اتمی ([۱۸Ar] 3d۱۰۴s۲۴p۶) آن ناشی می شود. همانند دیگر گاز های نجیب، هشت الکترون در دورترین لایه الکترونی کریپتون وجود دارد. در نتیجه با توجه به آرایش الکترونی کریپتون و قاعده اکتت مشخص می شود که اوربیتال های لایه آخر این عناصر از الکترون پر می باشند و بنابراین میلی به گرفتن و یا از دست دادن الکترون ندارد. در حقیقت از این حیث پایدار است.
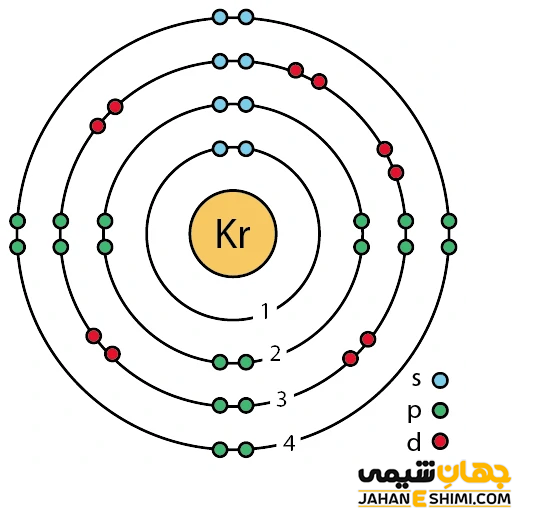
دقت داشته باشید که کریپتون ۱/۱۸ مرتبه از هوا سنگین تر است. این عنصر در اثر تخلیه الکتریکی، نور بنفش کم رنگ تولید می کند. رنگ های نارنجی و سبز طیفی درخشان آن نیز از خصوصیات دیگر این گاز محسوب می شوند. کریپتون همچنین یکی از محصولات شکافت اورانیم محسوب می شود. در حالت جامد شده، سفید و بلورین خواهد بود. از این رو از ساختار کریستالی مکعبی ساخته شده است. از دیگر ویژگی های عنصر کریپتون می توان به موارد زیر اشاره کرد.
- حالت فیزیکی آن در دمای ۲۵ درجه سلسیوس و فشار ۱ اتمسفر به صورت گاز است.
- دمای ذوب و دمای جوش این عنصر به ترتیب ۱۵۷.۳۷ و ۱۵۳.۴۱۵ درجه سانتی گراد است.
- عنصر کریپتون دیا مغناطیس است.
- ساختار بلوری آن به شکل مکعبی مرکز وجوه پر (fcc) است.
- این عنصر آلوتروپ ندارد.
- جرم اتمی کریپتون برابر با ۸۳.۷۹۸ g/mol است.
- چگالی آن نیز برابر با ۰.۰۰۳۷۴۹ g/cm۳ می باشد.
- شعاع اتمی آن نیز برابر با ۸۸ pm می باشد.
- یون های کریپتون معمولا عدد اکسایش برابر با اعداد ۰، +۱ و +۲ را دارند. اعداد اکسایش ۰ و +۲ متداول تر می باشند.
- انرژی یونیزاسیون آن برابر با ۱۳۵۰.۸ kJ/mol است.
گاز های نجیب
همانطور که بیان شد، عنصر شماره ۳۶ جدول تناوبی به گروه گاز های نجیب تعلق دارد. تمامی گاز های نجیب (به جز هلیوم) دارای آرایش الکترونی ns۲ np۶ می باشند. این آرایش الکترونی بسیار پایدار است. علت نامگذاری آنها به گاز های نجیب و یا گاز های بی اثر، به دلیل واکنش پذیری بسیار سخت آنهاست. این گازها از لحاظ شیمیایی خنثی می باشند. پس تمایلی به شرکت در واکنش های شیمیایی ندارند. دلیل این امر در واقع آرایش الکترونی لایه ظرفیت آنها می باشد. این آرایش، کاملا از الکترون پر است، بنابراین تمایلی به گرفتن و یا از دست دادن الکترون ندارند. در واقع عدد اکسایش این گاز ها صفر است.
توجه داشته باشید که در بین عناصر هر تناوب در جدول تناوبی، گاز های نجیب بیشترین انرژی یونیزاسیون را دارند. در حالیکه الکترونگاتیویته این گاز ها بسیار پایین است. علاوه بر آن، نقطه ذوب و جوش نیز پایین می باشد. این گاز ها همچنین حلالیت بسیار کمی در آب دارند.
در گذشته به گاز های نجیب، عناصر گروه صفر نیز گفته می شد. زیرا تصور بر این بود که این عناصر نمی توانند با دیگر اتم ها پیوند تشکیل دهند. به علاوه، در زمان گذشته به نظر دانشمندان، این گاز ها در جهان بسیار نادر بودند. از طرفی دیگر، از لحاظ شیمیایی نیز خنثی بوده و ترکیب نمی شدند. بنابراین آنها را گاز های نادر (Rare Gases) یا گاز های راکد نیز (Inert Gases) نامیدند. اما امروزه می دانید که این عناصر در جهان فراوان می باشند، پس کلمه نادر ممکن است گمراه کننده باشد. کلمه راکد نیز می تواند این مفهوم را برساند که این عناصر نمی توانند ترکیبات شیمیایی ایجاد کنند، از این رو بهتر است که از این کلمه نیز استفاده نشود.

ایزوتوپ های عنصر کریپتون
همانطور که می دانید، ایزوتوپ های یک عنصر، تنها در تعداد نوترون ها با یکدیگر متفاوت هستند. کریپتونی که در طبیعت وجود دارد دارای شش ایزوتوپ پایدار ۷۸Kr (0.35 %)، ۸۰Kr (2.28 %)، ۸۲Kr (11.58 %)، ۸۳Kr (11.49 %) ، ۸۴Kr (57 %) و ۸۶Kr (17.3 %) می باشد. لازم به ذکر است که ایزوتوپ ۷۸Kr، نیمه عمری بسیار طولانی دارد. این ایزوتوپ در حقیقت دومین ایزوتوپ پایدار بعد از ایزوتوپ سلنیوم ۷۸ در دنیا می باشد. علاوه بر آن، تعداد زیادی ایزوتوپ پرتوزای کریپتون نیز شناخته شده است. به بیان دیگر، کریپتون دارای ۳۴ ایزوتوپ شناخته شده است. جرم اتمی این ایزوتوپ ها بین ۶۹ تا ۱۰۲ می باشد.
ایزوتوپ رادیواکتیو ۸۱Kr با نیمه عمر ۲۵۰۰۰۰ سال، در حقیقت محصولی از واکنش های جوی با دیگر ایزوتوپ های طبیعی کریپتون می باشد. عنصر کریپتون نیز مانند عنصر زنون، نزدیک آب های سطحی بسیار ناپایدار می باشد. بنابراین می توان از رادیو ایزوتوپ ۸۱Kr به منظور تاریخ گذاری آب های زیرزمینی استفاده نمود.

کاربرد های عنصر کریپتون
کاربرد های کریپتون نیز مانند دیگر گاز های نجیب، به حوزه ساخت لامپ (لامپ های فلوئورسنت، لامپ های معمولی برق و لامپ های ویژه دیگر)، لیزر، عکسبرداری، منابع سوختی و … مربوط می شود. در واقع، این عنصر در ترکیب با دیگر عناصر نجیب مثل آرگون، در تولید و ساخت لامپ های فلورسنت مورد استفاده قرار می گیرد. این ترکیب باعث کاهش مصرف انرژی و همچنین باعث افزایش نور خروجی می گردد. ترکیب کریپتون با زنون، جهت پر کردن لامپ های رشته ای استفاده می شود. این ترکیب باعث کاهش تبخیر رشته ها و امکان کارکرد در دمای بالاتر می شود. علاوه بر آن، می توان از ترکیب کریپتون با سایر گاز ها، در تولید و ساخت لامپ های درخشان با نور سبز مایل به زرد استفاده نمود.
کریپتون همچون سایر گاز های نجیب در نورپردازی عکاسی کاربرد دارد.کریپتون یونیزه شده، باعث انتشار نور شدید سفیدی می گردد. این ویژگی در ساخت لامپ فلاش دوربین های عکاسی استفاده می شود. این مدل فلاش های دوربین، در عکاسی سریع بکار می روند. پلاسمای کریپتون جهت استفاده در لیزر های پر قدرت گزینه مناسبی است. از طرفی دیگر، لیزر ترکیب کریپتون فلوئوراید در پژوهش های انرژی جوش هسته ای در آزمایش های سری و محرمانه کاربرد دارد. از خواص ویژه این لیزر می توان به یکنواختی پرتو، طول موج کوتاه و اندازه اسپات قابل تغییر آن اشاره نمود. یکی دیگر از کاربرد های گاز کریپتون، تعیین استاندارد برای واحد بین المللی طول (به ویژه متر) بوده است. به عبارت دیگر در سال ۱۹۶۰ میلادی، در یک توافق بین المللی، واحد متر بر اساس نور خارج شده از یک ایزوتوپ کریپتون تعریف شده است.

کاربرد های جالب کریپتون
از دیگر کاربرد های آن می توان به جذب و انتشار تابش الکترومغناطیس اشاره کرد. در حقیقت از این خاصیت در لامپ های تخلیه الکتریکی و دستگاه های روشنایی نظیر چراغ خودرو ها، تابلو های تبلیغاتی و غیره استفاده می کنند. همچنین از کریپتون مانند آرگون به دلیل رسانایی گرمایی پایینی که دارند، به عنوان عایق در پنجره های دو جداره استفاده می شود. کریپتون به عنوان استاندارد کالیبره دستگاه طیف سنجی جرمی و اندازه گیری منطقه خاص در کاربرد های جذب نیز مورد استفاده قرار می گیرد. به علاوه، کریپتون مایع به منظور تولید و ساخت کالریمتر الکترومغناطیسی شبه همگن کاربرد دارد.
در صنعت پزشکی از گاز کریپتون در تصویر برداری رزونانس مغناطیسی (MRI) از طریق راه های هوایی ریه استفاده می کنند. در واقع کریپتون به رادیولوژیست ها کمک می کند تا سطوح آب گریز را از سطوح آب دوست حاوی راه های هوایی ریه تشخیص دهند. همچنین، این عنصر در پزشکی هسته ای جهت اسکن ریه کاربرد دارد. در طی فرآیند اسکن، کریپتون استنشاق می شود و در نتیجه تصویر برداری با پرتو گاما انجام می گیرد. کریپتون در صنعت و کار های نظامی نیز کاربرد دارد. از این عنصر جهت شناسایی مخازن تاسیسات بازیافت سوخت هسته ای در کشور ها استفاده می کنند. علاوه بر آن، رادیو ایزوتوپ ۸۵Kr، در آنالیز های شیمیایی بکار گرفته می شود.
ترکیبات عنصر کریپتون
محققان در گذشته فکر می کردند که کریپتون نیز همچون سایر گاز های کمیاب، از لحاظ شیمیایی بی اثر است. ولی تحقیقات در سال ۱۹۶۳ میلادی، نشان داد که بعضی از ترکیبات کریپتون وجود دارند. از جمله این ترکیبات می توان به کریپتون دی فلورید (KrF۲) و کریپتون تترا فلورید (KrF۴) اشاره کرد. علاوه بر این دو ترکیب، گزارش تایید نشده ای از نمک باریم اکسواسید کریپتون وجود دارد.
یون های چند اتمی +ArKr و +KrH نیز کشف شده اند. همچنین شواهدی مبنی بر وجود دو ترکیب+KrXe و KrXe وجود دارد. ترکیباتی مانند کریپتون هیدرید- سیانید (HKrCN) و هیدرو کرپتو آستیلن (HKrC≡CH) نیز تا دمای ۴۰ کلوین پایدار می باشند. از طرفی دیگر، بلور های کریپتون هیدرید (Kr(H۲)۴) را می توان در فشار های بالاتر از ۵ GPa رشد داد. با مشاهده این ترکیبات، ثابت شده است که کریپتون نیز ترکیبات مختلفی دارد. پس به صورت مطلق بی اثر نمی باشد.
خطرات کریپتون بر روی سلامتی انسان
گاز کریپتون، گازی ساکن و نا متحرک است. این گاز به عنوان ماده ای اختناق آور محسوب می شود. استنشاق غلظت بالای کریپتون باعث تهوع، استفراغ، سرگیجه، درماندگی، کاهش هوشیاری و در نهایت مرگ می شود. مرگ در اثر اشتباه در تصمیم گیری، کاهش هوشیاری، پایین بودن غلظت اکسیژن ظرف چند ثانیه و بدون هیچ عارضه قبلی رخ می دهد.
از جمله نخستین علائم تنفس گاز های خفقان آور، تنفس شدید و احساس خفگی است. در این صورت، هوشیاری کاهش پیدا می کند و در نتیجه هماهنگی ماهیچه ها مختل می گردد. در نهایت تصمیم گیری مختل شده، تزلزل عاطفی رخ داده و به سرعت احساس خستگی بوجود می آید. حال هرچه، غلظت گاز خفقان آور بیشتر شود، باعث تشنج، کمای شدید و مرگ خواهد شد. لازم به ذکر است که تماس با کریپتون مایع می تواند باعث سوختگی کرایوجنیک شود.




















