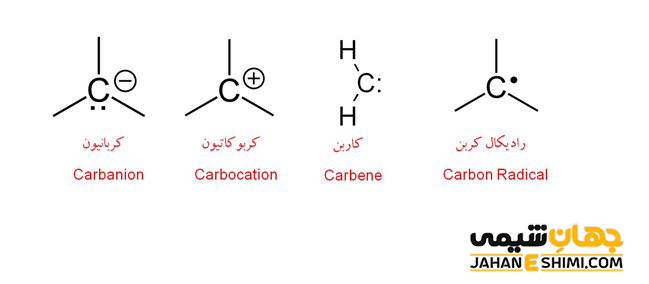
در علم شیمی، کربانیون (carbanion) به مولکول هایی گفته می شود که یک اتم کربن منفی دارند. به بیان دیگر، کربانیون یک یون آلی محسوب می شود که دارای یک اتم کربن با بار منفی، سه پیوند شیمیایی و ساختار هندسی هرم سه بعدی است. از مهمترین مشخصه آن، می توان به ناپایداری بسیار زیادش اشاره کرد، بنابراین فقط برای مدت زمان کوتاهی وجود دارد. از این رو، به همراه کربورادیکال ها و کربوکاتیون ها، به عنوان واسطه های مهم در واکنش های آلی در نظر گرفته می شوند. به بیان دیگر، بسیاری از واکنش های آلی از مسیر یکی از این حد واسط ها (حد واسط در مسیر یک واکنش تولید و سپس دوباره مصرف می شود) می گذرد. در ادامه این مقاله در نشریه جهان شیمی فیزیک به بررسی کربانیون و انواع مختلف آن پرداخته می شود. لطفا با ما همراه باشید.
مقدمه
ساختار کربانیون برای اولین بار در سال ۱۹۰۷ میلادی با مکانیسم واکنش تراکم بنزوئین (Benzoin Condensation) ظاهر شد، که به درستی توسط کلارک (Clarke) و آرتور لاپورث (Arthur Lapworth) معرفی گردید. در سال ۱۹۱۴ میلادی، شیمیدان آلمانی ویلهلم شلنک (Wilhelm Johann Schlenk) نشان داد که چگونه رادیکال های تری آریل متیل می توانند به وسیله فلزات قلیایی به کربانیون تبدیل شوند. اصطلاح کربانیون توسط والیس (Wallis) و آدامز (Adams) در سال ۱۹۳۳ میلادی به عنوان همتای بار منفی یون کربانیوم (carbonium ion) معرفی شد.
خواص و ویژگی های کربانیون
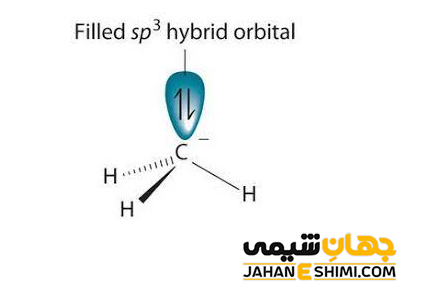
همانطور که بیان شد، کربانیون ها دارای بار منفی هستند، بنابراین می توان به آنها آنیون کربن نیز گفت. در این ترکیبات، می توان جفت الکترون هایی را که به اشتراک نگذاشته اند دید. اتم کربن کربانیون ها یک کربن سه ظرفیتی است، بنابراین، هیبریداسیون sp۳ را نشان می دهد. این مولکول، مانند سایر ذرات در هیبریداسیون sp۳، چهار اوربیتال هیبریدی به سمت گوشه های چهار وجهی دارد. یکی از اوربیتال های sp۳ اتم کربن با بار منفی در مولکول کربانیون، یک جفت الکترون ناپیوندی است. به دلیل آزادی بیشتر این جفت الکترون غیر پیوندی، سه گروه دیگر متصل به اتم مرکزی کربانیون به هم نزدیک تر شده و شکل هرمی را تشکیل خواهند داد.
وقتیکه کربانیون با گروه های جانشینی یک، دو و سه استخلافی پیوند دهد، به ترتیب، شکل هایی به صورت خطی، خمیده و سه ضلعی مسطح خواهد داشت. این دسته از ترکیبات آلی، اغلب در مجموع هشت الکترون ظرفیت را دارند. بنابراین از قاعده اوکتت پیروی می کنند. به بیان دیگر، کربانیون ها کمبود الکترون ندارند. لازم به ذکر است که کوچک ترین کربانیون، یون –CH۳ است که از مولکول متان (CH۴) از طریق از دست دادن یک پروتون (+H) بدست آمده است.
خاصیت بازی
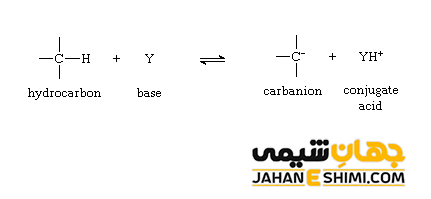
این ترکیبات از جمله باز های قوی لوئیس و هسته دوست محسوب می شوند که در حقیقت ساختار الکترونی مانند آمین ها دارند. به طور کلی می توان کربانیون را باز مزدوج یک کربن اسید (Carbon Acid) دانست. واکنش ذکر شده را در زیر مشاهده می کنید. در این معادله، B معرف یک باز (قلیا) است.
R۳CH + B– → R۳C– + HB
توجه داشته باشید که خاصیت بازی آنها از طریق گروه های متصل به کربن تعیین می شود. اگر اتم های مجاور نسبت به اتم کربن با بار منفی، الکترونگاتیوتر باشند، بار منفی آنها پایدار تر است (اثر القایی). از طرفی دیگر، مزدوج شدگی یا کونجوگیشن (Conjugation) آنیون بر اثر پدیده رزونانس نیز باعث پایداری آن خواهد شد. جالب است بدانید که مزدوج شدگی زمانی اهمیت پیدا می کند که آنیون مورد بررسی در نتیجه آروماتیستیه (خاصیت آروماتیکی) پایدار شده است. علاوه بر آن، هندسه مولکولی همچنین بر هیبرید شدن کربانیون ها اثر می گذارد. به بیان دیگر، هرچه خاصیت s در اتم جذب کننده بار الکتریکی، بیشتر است، در نتیجه آنیون حاصل نیز پایداری بیشتری دارد.
اثر القایی
زمانیکه در مولکولی همچون CR۴ که بار های الکتریکی در آن به صورت متقارن پخش شده اند، یک اتم X جانشین یکی از گروه های R شود، در این صورت مولکول CR۳X تشکیل می شود. در این حالت، پخش بار الکتریکی در اطراف اتم مرکزی کربن (C) بهم می خورد. بدین ترتیب، الکترونگاتیویته اتم مرکزی نیز تغییر می کند. بسته به ماهیت اتم جانشین شده X، اتم مرکزی نسبت به مولکول اولیه CR۴ می تواند الکترونگاتیوتر یا الکتروپوزیتیوتر باشد. یعنی دارای بار جزئی مثبت یا منفی خواهد شد. به این پدیده، اثر القایی گفته می شود.
چنانچه در اثر این جانشینی، بار جزئی مثبت بر روی اتم X قرار بگیرد و در نتیجه اتم مرکزی کربن دارای بار جزئی منفی شود، می توان گفت که اتم X دارای اثر القایی مثبت است. در حالیکه، اگر اتم X دارای بار الکتریکی جزئی منفی شود، بنابراین اتم مرکزی کربن دارای بار جزئی مثبت می گردد، می توان بیان کرد که اتم X دارای اثر القایی منفی می باشد.
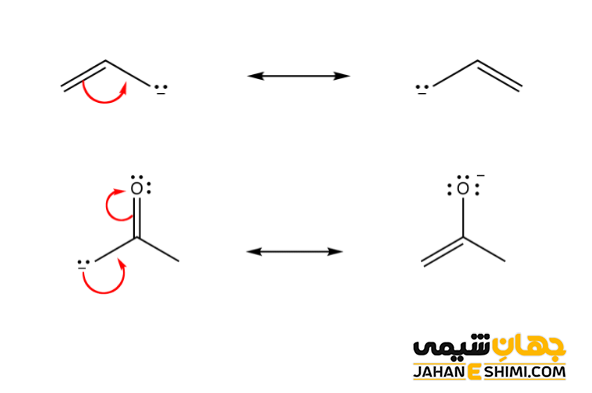
مزدوج شدگی
در شیمی آلی، تغییر متناوب پیوند های چندگانه (دوگانه یا سهگانه) با پیوند یگانه کربن- کربن در هر مولکول رو مزدوج شدن می گویند. در واقع به خاطر عدم استقرار الکترون های پای، مجموع انرژی کلی مولکول کاهش پیدا می کند و باعث می گردد پایداری آن مولکول افزایش یابد. به بیان دیگر، یک سیستم مزدوج یا کونجوگه به سیستم متشکل از اوربیتال های پی (p) متصل به یکدیگر با الکترون های غیر مستقر در یک مولکول می گویند. به عبارت دیگر می توان گفت که مزدوج شدن برابر است با همپوشانی یک اوربیتال p با یک اوربیتال دیگر p در طول یک پیوند سیگما (σ).
انواع کربانیون ها
این دسته از ترکیبات آلی را نیز مانند کربوکاتیون ها می توان به سه دسته طبقه بندی کرد. کربانیون نوع اول، نوع دوم و نوع سوم. این تقسیم بندی بر اساس تعداد اتم ها یا گروه های کربنی (–R) متصل به اتم کربن آنیونی انجام می شود.

پایداری کربانیون ها
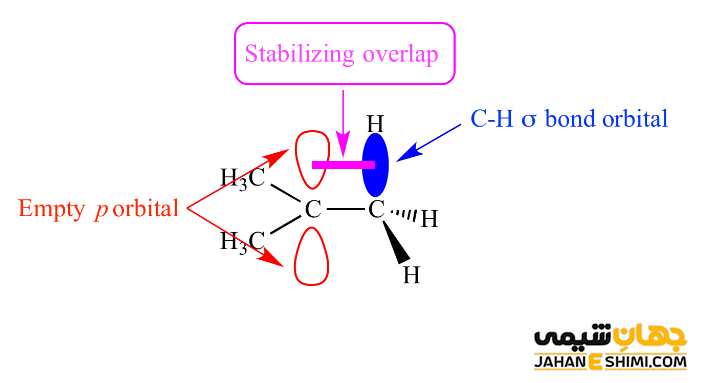
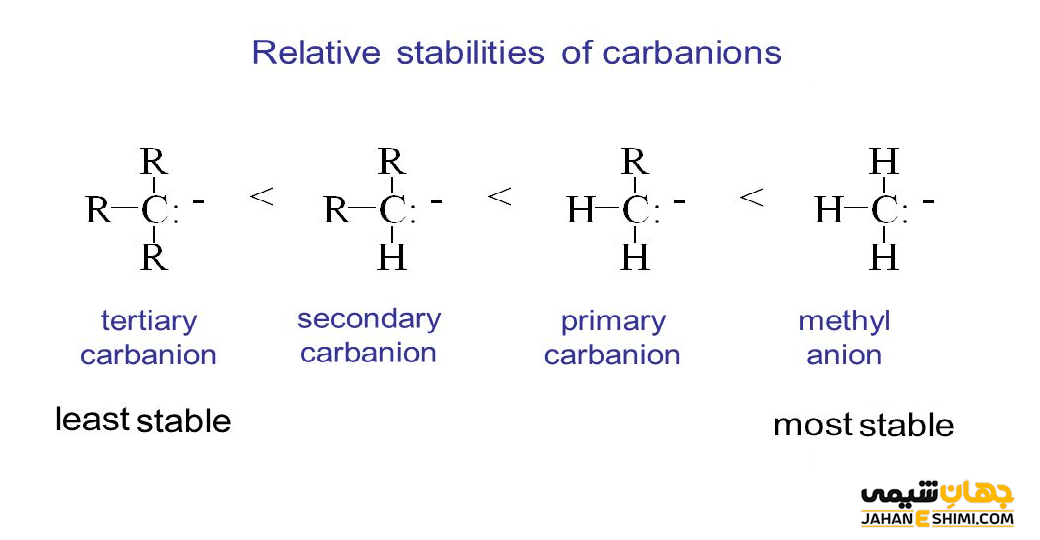
پایداری کربانیون ها به عوامل مختلفی بستگی دارد. از جمله این عوامل می توان به الکترونگاتیویته اتم کربن آنیونی، اثر رزونانس، اثر القایی ناشی از جانشینی اتم متصل بر روی کربن آنیونی اشاره کرد. همانطور که بیان شد، این ترکیبات دارای اتم کربن با بار منفی حاوی یک اوربیتال هیبریدی sp۳ هستند. آنها یک جفت الکترون غیرپیوندی دارند. بنابراین، به دلیل دافعه الکترونی بین الکترون ها، احتمال اینکه با پیوند کووالانسی C-H همسایه، برهمکنش پیوندی داشته باشد وجود ندارد. همانطور که می دانید، پدیده هایپرکونژوگاسیون شامل الکترون های یک پیوند مجاور برای اهدا الکترون ها به یک اوربیتال خالی p است. حال اگر این اوربیتال p، پر شده باشد و یا کربن را آنیون در نظر بگیرید، بر طبق قانون کولن نیروی دافعه وجود خواهد داشت. این امر باعث بی ثباتی و ناپایداری مولکول مورد نظر می شود.
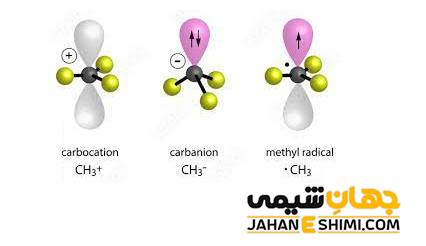
بنابراین، برخلاف رادیکال های کربن و کربوکاتیون ها، یک کربانیون به خاطر گروه های الکترون دهنده (گروه های آلکیل) متصل به اتم مرکزی، ناپایدار است. پس ترتیب پایداری کربانیون ها، کاملا برعکس روند کربوکاتیون ها و رادیکال های کربن است. به طور کلی، ترتیب پایداری کربانیون های جایگزین آلکیل به این شکل است که کربوکاتون نوع اول پایدارتر از کربانیون نوع دوم، کربانیون نوع دوم پایدارتر از کربانیون نوع سوم می باشند. به طور کلی می توان نتیجه گرفت که گروه های آزاد کننده الکترون، مولکول های کربوکاتیون و رادیکال کربن را پایدار می کنند. در حالیکه، باعث ناپایداری کربانیون ها می شوند. از طرفی، رزونانس شامل جابه جایی الکترون ها در یک مولکول است. حال اینکه رزونانس باعث تثبیت مولکول می شود یا خیر بستگی به این دارد که دقیقاً چه اتفاقی می افتد.
نحوه تشکیل کربانیون ها
این ترکیبات از طریق پروتون زدایی آلکان ها (در کربن sp۳)، آلکن ها (در کربن sp۲)، آرن ها (در کربن sp۲) و آلکین ها (در کربن sp) که به ترتیب با عناوین آنیون آلکیل (alkyl)، آنیون آلکنیل یا وینیل (alkenyl or vinyl)، آنیون آریل (aryl) و آنیون های آلکینیل یا استیلید (alkynyl or acetylide) شناخته می شوند. علاوه بر موارد بیان شده، هر مولکولی که دارای پیوند C-H باشد (اسید کربن) می تواند با از دست دادن یک پروتون، کربانیون بسازد.
اسید های کربن
هر ترکیبی که دارای اتم هیدروژن باشد، برای تشکیل پایه مزدوج خود می تواند تحت فرآیند پروتون زدایی قرار بگیرد. اگر واکنش پروتون زدایی منجر به از دست دادن پروتون توسط اتم کربن شود، آن ترکیب، یک اسید کربن است. در نتیجه می توان گفت که هر هیدروکربنی که پیوند C-H دارد می تواند به عنوان یک اسید با میزان pKa مشخص در نظر گرفته شود. دقت داشته باشید که اسید های کربن در مقایسه با ترکیباتی که به عنوان اسید کلاسیک در نظر گرفته می شوند (مثلا اسید های معدنی همچون اسید نیتریک یا اسید های کربوکسیلیک مثل اسید استیک)، معمولا از نظر قدرت اسیدی بسیار ضعیف تر هستند. البته موارد استثنایی نیز وجود دارد. خاصیت اسیدی این ترکیبات زمانی افزایش پیدا می کند که:
- اتم کربن با گروه های الکترون دوست احاطه شده است.
- زمانیکه آنیون آروماتیک باشد، یا اضافه شدن الکترون باعث آروماتیک شدن آنیون گردیده است. حتی هنگامیکه بار منفی بر روی اتم کربن بتواند بر روی حلقه هایی که آروماتیک اند جابجا شود.
- اتم کربن بدون هیچ واسطه ای در کنار یک گروه کربونیل قرار گرفته باشد. در حقیقت پروتون آلفای گروه عاملی کربونیل، خصلت اسیدی دارد، زیرا بار الکتریکی منفی انول به صورت جزئی می تواند بر روی اتم کسیژن پخش شود.
واکنش های کربانیون ها
کربانیون ها به عنوان مراکز منفی تمایل دارند تا با ترکیبات الکترون دوست یا الکتروفیل (Electrophile) واکنش دهند. ترکیبات الکترون دوست به گروه های شیمیایی گفته می شود که دارای بار مثبت هستند. بنابراین، تمایل دارند الکترون بگیرند تا خنثی شوند. در واقع، چگالی الکترونی منفی در اتم کربن کربانیون باعث می شود تا بتواند با گروه های کربونیل، ایمین و نمک های ایمینیوم، واکنشگر های هالوژناسیون و یا پروتون دهنده ها واکنش دهد. علاوه بر آن، در واکنش های سنتز آلی همچون واکنشگر های اورگانو لیتیومی (آلی لیتیومی) و یا واکنشگر گرینیارد را به عنوان کربانیون در نظر می گیرند. توجه داشته باشید که کربانیون یک گونه واکنش پذیر محسوب می شود، بنابراین بعد از مدت کوتاهی از تشکیل واکنش می دهد تا محصول واقعی آن واکنش شیمیایی ایجاد گردد.