سینتیک شیمیایی و عوامل موثر بر سرعت واکنش ها
یکی از شاخه های علم شیمی است که به بررسی چگونگی و سرعت انجام واکنش های شیمیایی می پردازد سینتیک شیمیایی نام دارد. سینتیک را می توان مقدار تغییر جابه جایی دانست. علم سینتیک شیمیایی مکمل شاخه ترمودینامیک شیمی است. این مقاله نشریه جهان شیمی فیزیک به بیان توضیحاتی راجع به این علم شیمی می پردازد.
فهرست مطالب :
۱- تاریخچه
۲- سینتیک واکنش شیمیایی چیست؟
۳- سرعت واکنش دهنده ها و فرآورده ها
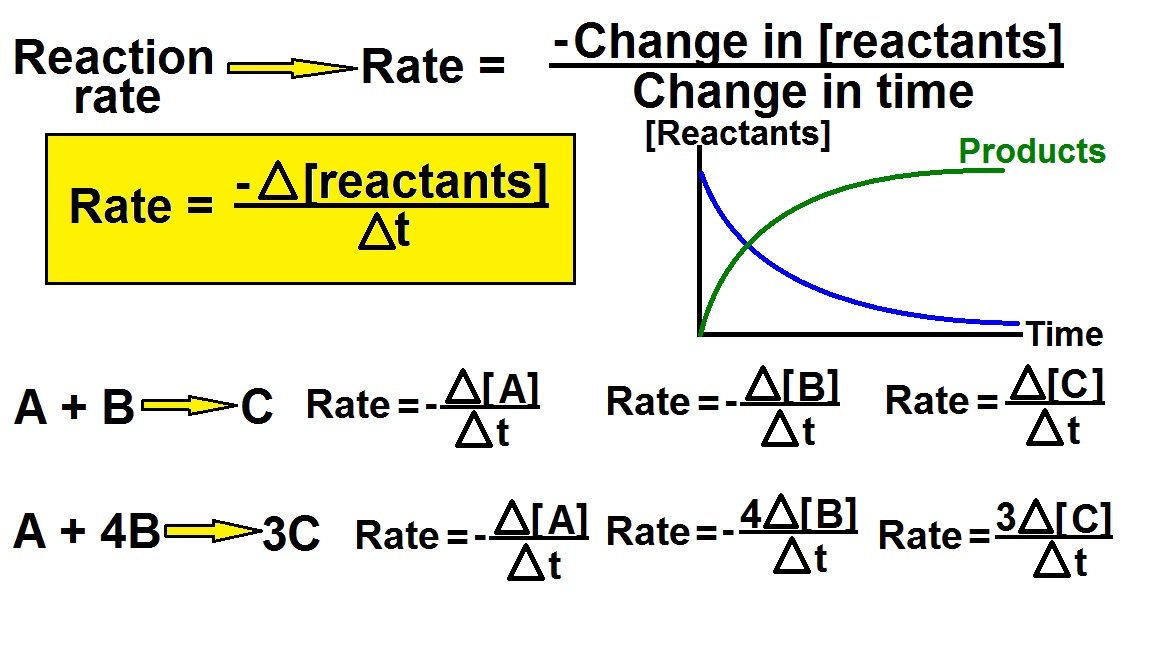
۴- سرعت متوسط (R–)
۵- رابطه سرعت
۶- عوامل موثر بر سرعت واکنش های شیمیایی
۶-۱- غلظت
۶-۲- دما
۶-۳- فاز و سطح واکنش دهنده ها
۶-۴- اثر فشار
۶-۵- کاتالیزگر
۱- تاریخچه :
اولین کسی که به ممطالعه سرعت واکنش های شیمیایی پرداخت، ونزل در سال ۱۷۷۷ بود که سرعت حل شدن فلزات در اسیدها را بررسی کرد. در سال ۱۸۵۰ ویلهی با مطالعه سرعت هیدرولیز اسیدها متوجه شد، سرعت این واکنش به غلظت ساکاروز تجزیه نشده (اولیه) بستگی دارد.
در سال ۱۸۶۳ نتایج آزمایشات برتلو و سن زیل (مطالعه سرعت هیدرولیز استرها در اسید) را تکمیل کرده و قانون اثر غلظت ها که امروزه می دانیم مهمترین عامل تاثیرگذار در سرعت است، را بیان کرد. در نهایت در سال ۱۸۸۴ دینامیک شیمیایی توسط وانت هوف بررسی شد.
۲- سینتیک واکنش شیمیایی چیست؟
به علم مطالعه سرعت انجام واکنش های شیمیایی و عوامل موثر بر آن مثل دما، غلظت واکنش دهنده ها و فرآورده ها، فشار و … سینتیک شیمیایی می گویند. در علم سینتیک حتی اطلاعات زیادی در مورد مکانیسم و مراحل انجام واکنش های شیمیایی و کنترل واکنش و توضیح گونه های انجام دهنده واکنش می توانیم به دست آوریم. واکنش ها بر اساس سرعت انجام آن به دسته های زیر تقسیم می شوند :
الف – واکنش های خیلی سریع با زمان انجام ۱۰_۴ ثانیه
ب – واکنش های سریع با زمان انجام در حد ثانیه
ج – واکنش های معمولی با زمان انجام در حدود چند دقیقه یا چند ساعت
د – واکنش های کند با زمان انجام در حد روزها و حتی هفته ها
ذ – واکنش های خیلی کند که سال ها و قرن ها برای انجام آن ها زمان لازم است.
۳- سرعت واکنش دهنده ها و فرآورده ها :
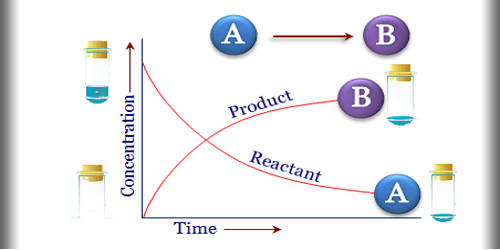
در یک واکنش شیمیایی به تدریج با پیشرفت واکنش و گذر زمان از مقدار مواد واکنش دهنده ها کاسته شده و بر مقدار فرآورده ها افزوده می شود. اگر نمودار غلظت برحسب زمان برای یک واکنش شیمیایی را رسم کنیم، نمودار غلظت واکنش دهنده ها با گذر زمان منفی و نمودار غلظت فرآورده ها مثبت خواهد بود. برای تعیین سرعت واکنش باید سرعت مصرف شدن واکنش دهنده ها و سرعت تولید فرآورده های واکنش را مدنظر داشته باشیم. بر این اساس به میزان پیشرفت واکنش با زمان که به صورت تغییرات غلظت یکی از واکنش دهنده ها و یا فرآورده ها در زمان بیان می شود سرعت و سینتیک واکنش گفته می شود.
۴- سرعت متوسط (R–) :
به سرعت مصرف و تولید ماده در واکنش شیمیایی را در واحد زمان سرعت متوسط گویند که با R– نشان می دهند که از کلمه Rate به معنای سرعت گرفته شده است. به تعداد مول های مصرف شده در واحد زمان سرعت متوسط یک واکنش دهنده و به تعداد مول های تولید شده در واحد زمان سرعت متوسط یک فرآورده طبق رابطه زیر می گویند.
R– = _ Δn ̸ Δt برای واکنش دهنده
R– = +Δn ̸ Δt برای فرآورده
۵- رابطه سرعت :
اگر ضرایب استوکیومتری واکنش یکسان نباشد برای بیان کردن رابطه سرعت واکنش، با در نظر گرفتن واکنش کلی زیر داریم:
Aa + bB → cC + dD
R = _ 1 ̸ a ₓ d[A] ̸ dt = _1 ̸ b ₓ d[B] ̸ dt = 1 ̸ c ₓ d[C] ̸ dt = 1 ̸ d ₓ d[D] ̸ dt
در این معادله بالا و رابطه سرعت حروف کوچک (a, b, c, d) ضرایب استوکیومتری و حروف بزرگ (A, B, C, D) واکنش دهنده ها و محصولات واکنش هستند. پس سرعت واکنش (R) برابر است با مقدار پیشرفت واکنش بر حسب زمان.
نکته :
علامت منفی برای مواد واکنش دهنده ها به دلیل این است که با گذر زمان غلظت مواد اولیه کم می شود و این علامت منفی باعث به دست آمدن عدد مثبت برای سرعت واکنش می شود.
اگر غلظت مواد را بر حسب mol ̸ L و زمان را بر حسب ثانیه بیان کنیم، سرعت بر حسب واحد mol ̸ L.s بیان می شود.
۶- عوامل موثر بر سرعت واکنش های شیمیایی :
۶-۱- غلظت :
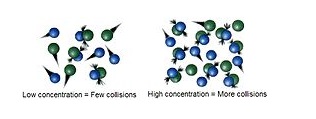
در یک واکنش شیمیایی برای تشکیل محصول مواد واکنش دهنده با هم برخورد می کنند. اگر برخوردی وجود نداشته باشد هیچ واکنشی اتفاق نمی افتد و سرعت واکنش صفر می شود. هرچه غلظت مواد اولیه بیشتر باشد، تعداد برخورد بین آن ها و در نتیجه آن تعداد برخوردهای موثر بیشتر شده و سرعت واکنش افزایش می یابد.
۶-۲- دما :
هر چه دمای یک واکنش افزایش یابد انرژی جنبشی ذرات واکنش دهنده افزایش یافته و ذرات با شدت بیشتری به هم برخورد می کنند و سرعت حرکت آن ها نیز زیاد می شود. در نتیجه تعداد برخوردها و به دنبال آن تعداد برخوردهای موثر زیاد شده و سرعت واکنش افزایش می یابد. برعکس کاهش دما باعث کاهش انرژی ذرات و کاهش سرعت واکنش می شود. به عنوان مثال با گذاشتن مواد غذایی در فریزر و انجماد آن ها سرعت رشد باکتری ها کاهش یافته و مواد دیرتر فاسد می شوند.
نکته :
گرماگیر یا گرماده بودن واکنش ها باعث می شود افزایش دما روی واکنش های رفت یا برگشت تاثیر کند. همچنین افزایش دما روی واکنش های با مکانیسم های مختلف، محصولات مختلفی می دهند.
۶-۳- فاز و سطح واکنش دهنده ها :
در انجام یک واکنش شیمیایی اگر مواد واکنش دهنده با هم دریک فاز باشند، مثلا به شکل مایع باشند و در هم حل شوند، واکنش با سرعت بیشتری انجام می شود. همچنین واکنش دهنده ها به شکل مایع چون آزادی حرکت بیشتری دارند، در مقایسه با فاز جامد، ذرات آن تعداد برخورد بیشتری داشته و سرعت انجام واکنش افزایش می یابد.
اگر مواد اولیه جامد باشد با خرد کردن مواد جامد به قطعات ریز، سطح تماس بین ذرات بیشتر شده، سرعت واکنش افزایش می یابد. روشی دیگر برای افزایش سرعت واکنش دو جامد، افزودن حلال به آن هاست.
۶-۴- اثر فشار :
در صورتی تغییر فشار روی سرعت واکنش تاثیر می گذارد که حداقل یکی از مواد اولیه واکنش به حالت گازی باشد. در این صورت اگر فشار افزایش پیدا کند، مثل افزایش غلظت، تعداد برخورد بین ذرات واکنش دهنده زیاد می شود و سرعت واکنش بیشتر می شود.
۶-۵- کاتالیزگر :
یکی دیگر از عوامل افزایش سرعت واکنش، اضافه کردن کاتالیزگر با افزایش سطح تماس بیشتر است. با اضافه کردن کاتالیزور به واکنش، انرژی فعالسازی واکنش کم شده و برخوردهایی که منجر به تشکیل محصول می شود (برخورد موثر) زیاد شده و سرعت واکنش افزایش می یابد. هر کاتالیزور فقط مناسب یک یا چند واکنش است.
نکته :
بازدارنده ها برعکس کاتالیزورها سرعت واکنش های شیمیایی را با جذب عوامل فعال واکنش و یا از طریق کاهش سطح تماس، کاهش می دهند.