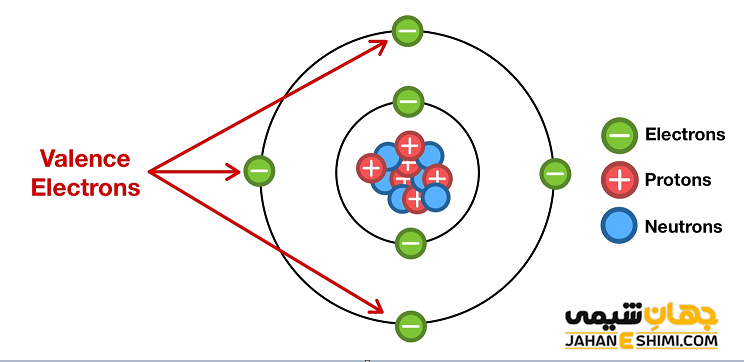
الکترون ظرفیت یا الکترون والانس (Valence electron) به هر یک از الکترون های لایه ظرفیت اتم مورد نظر گفته می شود که می تواند در ایجاد و تشکیل پیوند های شیمیایی شرکت کند.

به عبارت دیگر به آخرین لایه الکترونی اتم، لایه والانس و در نتیجه به الکترون های این لایه، الکترون های والاس گفته می شود. در ادامه این مقاله در نشریه جهان شیمی فیزیک به بررسی الکترون های ظرفیت عناصر مختلف می پردازیم. لطفا با ما همراه باشید.
لایه الکترونی
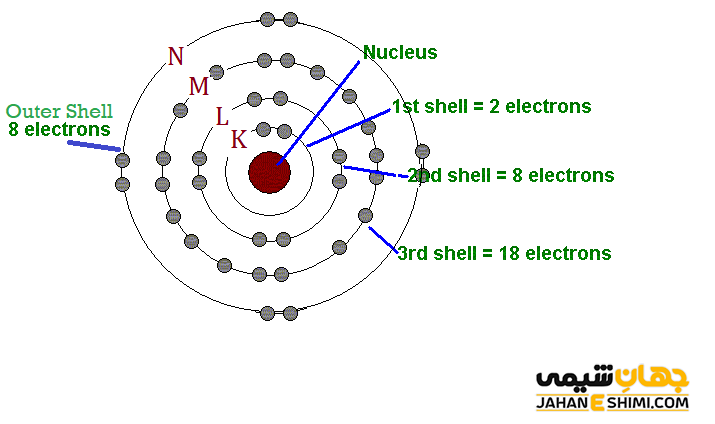
لایه الکترونی یا مدار الکترونی (Electron Shell) به لایه های اطراف هسته اتم گفته می شود که هر لایه می تواند تعداد ثابتی الکترون را در خود جای دهد. همان طور که در شکل زیر می بینید، لایه های الکترونی در فاصله معینی از هسته قرار گرفته اند. این لایه ها با شماره های ۱، ۲، تا ۷ شناخته می شوند. لایه اول نزدیک ترین لایه به هسته اتم می باشد.

توجه داشته باشید که لایه اول تعداد ۲ الکترون، لایه دوم تعداد ۸ الکترون و لایه سوم تعداد حداکثر تا ۱۸ الکترون را در خود جای می دهد. به طور کلی می توان تعداد الکترون های هر لایه الکترونی را از طریق فرمول ۲n۲ محاسبه کرد. در این رابطه، n شماره لایه الکترونی است. لازم به ذکر است که بیش ترین مقدار n برای تمام اتم های شناخته شده در طبیعت برابر ۷ خواهد بود.
ذکر این نکته مهم است که اگرچه بار تمامی الکترون ها یکسان می باشد، اما انرژی آنها درون اتم متفاوت خواهد بود. در واقع هر چه الکترون در لایه پایین تر و نزدیک تر به هسته باشد، انرژی بیش تری خواهد داشت. بنابراین الکترون های لایه آخر، کمترین انرژی را نسبت به سایر لایه های اتم نشان می دهند. پس جدا کردن الکترون های لایه ظرفیت با انرژی کمتری امکان پذیر می باشد. در حقیقت لایه ظرفیت یا والانس همان آخرین لایه اصلی الكترونی یا در واقع آخرین سطح انرژی اصلی اتم است. لایه والانس به پوسته بیرونی یا لایه خارجی نیز مشهور است.
الکترون ظرفیت شیمی دهم
همانطور که بیان شد الکترون والانس به الکترون های وابسته به پوسته بیرونی اتم گفته می شود. الکترون های ظرفیت در صورتیکه پوسته بیرونی اتم بسته نباشد می توانند در تشکیل پیوند های شیمیایی شرکت کنند. به عنوان مثال، در پیوند کووالانسی یگانه، هرکدام از دو اتم درگیر در دو سر پیوند، یک الکترون ظرفیت خود را به اشتراک می گذارند. لازم به ذکر است که برای عناصر گروه های اصلی جدول تناوبی، الکترون های ظرفیت، تنها می توانند در بیرون ترین لایه الکترونی وجود داشته باشند. در حالیکه، در فلزات واسطه، این الکترون های والانس می توانند در یک لایه داخلی نیز وجود داشته باشند.
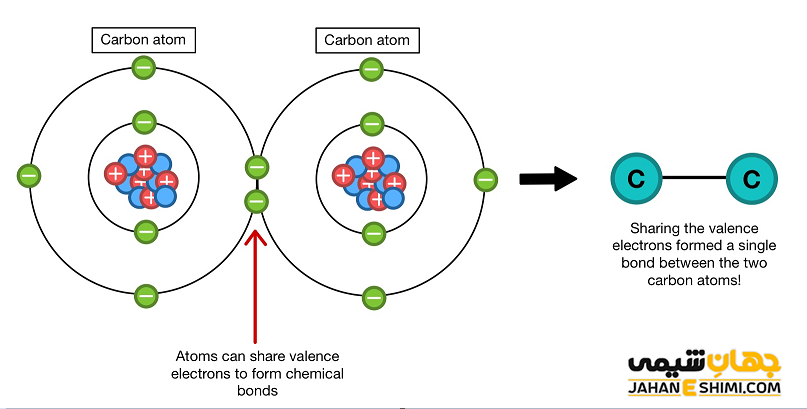
تعداد الکترون های ظرفیت می تواند رفتار یک عنصر شیمیایی را در واکنش های شیمیایی تعیین کند. علاوه بر آن، خواص شیمیایی یک عنصر (مثل ویژگی ظرفیت شیمیایی) نیز به وسیله الکترون های ظرفیت تعیین و مشخص می شود. در حقیقت با بررسی الکترون های والانس می توان نتیجه گیری کرد که آیا اولا عنصر مورد نظر تمایل دارد با سایر عناصر واکنش دهد یا خیر. ثانیا اگر چنین تمایلی را نشان می دهد، میزان آمادگی و با چه تعداد الکترون در واکنش ها شرکت خواهد کرد.
الکترون های ظرفیت نیز مانند الکترون های داخلی، توانایی جذب یا آزاد سازی انرژی به صورت فوتون را خواهند داشت. دریافت انرژی اضافه می تواند سبب جهش الکترون به لایه های بیرونی تر گردد. به این پدیده، حالت برانگیخته می گویند. در اینجا، اگر الکترون انرژی کافی برای غلبه بر پتانسیل یونیزاسیون بگیرد، می تواند حتی اتم مورد نظر را ترک و در نتیجه یک یون مثبت تشکیل دهد. حال اگر الکترون والانس، انرژی خود را با انتشار یک فوتون از دست بدهد، ممکن است که درون یک لایه داخلی تر که کاملا اشغال نشده جابجا شود.
حال اگر لایه های الکترونی ظرفیت یک اتم بسته باشد (مثلا آرایش الکترونی s۲p۶)، در نتیجه این اتم از لحاظ شیمیایی تمایلی به تشکیل پیوند شیمیایی ندارد. پس نسبت به سایر اتم ها بی اثر خواهد بود. از طرفی، اتم هایی که یک یا دو الکترون ظرفیت اضافی در لایه بسته خود دارند، به خاطر انرژی نسبتا کمی که برای خارج ساختن الکترون های اضافی و تشکیل یون مثبت نیاز است، بسیار واکنش پذیر می باشند. همچنین اتم هایی که با کمبود یک یا دو الکترون در لایه بسته خود مواجه اند، به خاطر تمایل شدید برای بدست آوردن الکترون های از دست رفته و در نتیجه تشکیل یون منفی بسیار واکنش پذیر می باشند. علاوه بر آن، این دسته از اتم ها برای به اشتراک گذاشتن الکترون های ظرفیتی خود در تشکیل پیوند کووالانسی، نیز واکنش پذیر می باشند.
تعداد الکترون های ظرفیت
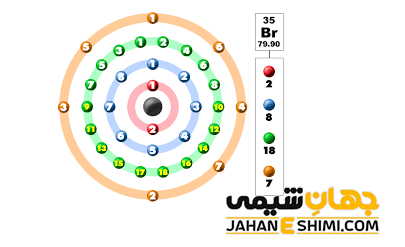
اگر شماره گروه یک اتم در جدول تناوبی را بدانید به راحتی می توانید تعداد الکترون های ظرفیت آن اتم را مشخص کنید. در واقع تعداد الکترون های ظرفیتی گروه یک تا گروه یازده، مساوی شماره گروه می باشد. مثلا تمام عناصر گروه ۲ جدول تناوبی دارای ۲ الکترون ظرفیت می باشند. اما از گروه دوازده تا آخر، تعداد الکترون های ظرفیت برابر با یکان شماره گروه خواهد بود. به عنوان مثال تمامی عناصر گروه ۱۵ جدول تناوبی عناصر دارای ۵ الکترون ظرفیت خواهند بود. حال اگر مولكول مورد نظر، به شکل یون با بار منفی باشد، به تعداد بار یون، به تعداد كل الكترون های آن مولکول اضافه می شود. در حالیکه مولکول مورد بررسی کاتیون باشد، به همان تعداد بار یون از تعداد الكترون ها كاسته می شود.
تعداد الکترون های لایه ظرفیت با استفاده از آرایش الکترونی
در عناصر دسته s (آرایش الکترونی ns)، تعداد الکترون های والانس برابر با تعداد الکترون های زیر لایه s آخرین لایه (n) می باشد. در حالیکه در عناصر دسته p، تعداد الکترون های ظرفیت برابر است با مجموع تعداد الکترون های زیر لایه های p و s در آخرین لایه اتم (n). اما در عناصر دسته d، تعداد الکترون های ظرفیت برابر است با مجموع الکترون های زیر لایه s آخرین لایه (n) و الکترون های زیر لایه d لایه قبل آن (n-1). در واقع در عناصر واسطه، چون تراز های d و s، اختلاف انرژی خیلی کمی با یکدیگر دارند. پس به این دو تراز، لایه ظرفیت و به الکترون های آنها، الکترون های ظرفیت می گویند. تعداد الکترون های والانس از فرمول s(n) + (n-1)d بدست می آید.
نکات کنکوری الکترون ظرفیت و روش تعیین آن
- الکترون های ظرفیت به الکترون های لایه ظرفیت عنصر مورد نظر گفته می شود، که این الکترون ها در واکنش ها و پیوند های شیمیایی نقش دارند.
- خواص شیمیایی یک عنصر را می توان از روی الکترون های ظرفیتی آن عنصر تعیین نمود.
- عناصری که در آرایش الکترونی آنها، آخرین الکترون در زیر لایه s یا p قرار دارد، تعداد الکترون های موجود در آخرین لایه (بزرگترین n) برابر با الکترون والانس خواهد بود.
- در گروه عناصر واسطه که زیر لایه d آنها در حال پر شدن می باشد، از آنجاییکه تفاوت سطح انرژی زیر لایه های ns و (n-1)d کم می باشد، الکترون های ظرفیتی برابر با مجموع الکترون های هر دو زیر لایه خواهد بود.
- از گروه اول تا گروه ۱۱ جدول تناوبی، تعداد الکترون های لایه ظرفیت برابر با شماره گروه می باشد. از گروه ۱۲ تا ۱۸ جدول تناوبی، تعداد الکترون های لایه ظرفیت برابر عدد یکان شماره گروه خواهد بود.
- در عناصر گروه ۱۲ جدول تناوبی، که شامل عناصر Zn و Cd و Hg اند، زیر لایه d عناصر بیان شده کاملا پر بوده و تمایلی برای واکنش های شیمیایی نشان نمی دهند. از این رو جزء الکترون های والانس نیز محسوب نمی شوند. از این رو، دو الکترون موجود در اوربیتال s لایه آخر را به عنوان الکترون های ظرفیتی در نظر می گیرند.
ظرفیت عناصر
همانطور که می دانید پایدارترین حالت برای یك عنصر، زمانیست كه آن عنصر به آرایش الکترونی گاز نجیب نزدیك به خود دست یابد. به عنوان مثال، عناصر گروه اول جدول تناوبی (گروه فلزات قلیایی) در لایه ظرفیت خود فقط یك الكترون در اوربیتال ns دارند. بنابراین این عناصر تمایل شدیدی به از دست دادن این تک الكترون و در نتیجه دست یابی به آرایش گاز بی اثر ما قبل خود نشان می دهند. پس ظرفیت عناصر گروه اول ۱+ خواهد بود. توجه داشته باشید که پیدا کردن ظرفیت عناصر واسطه كه دارای چندین عدد اكسایش و در نتیجه چندین ظرفیت مختلف می باشند به این راحتی نیست.
به طور کلی با داشتن عدد اتمی عناصر می توان ظرفیت آنها را مشخص نمود. برای اینکار، در ابتدا آرایش الكترونی عنصر مورد نظر را نوشته و با شناختی كه بایستی از گروه های جدول تناوبی داشته باشید، ساده ترین راه برای دست یابی عنصر مورد نظر به آرایش گاز نجیب را پیدا کنید. بدین ترتیب ظرفیت عنصر مورد نظر تعیین می گردد. اما درباره یون ها نیز باید به همین صورت عمل كرد. یعنی در ابتدا آرایش الكترونی یون مورد نظر نوشته شود. سپس ساده ترین راه برای دست یابی به آرایش الکترونی گاز بی اثر را انتخاب کرده و در نهایت تعداد الكترون هایی كه باید عنصر بگیرد یا از دست بدهد تا به آرایش گاز نجیب نزدیک خود برسد، به عنوان ظرفیت یون یا عنصر مورد نظر در نظر گرفته می شود.
نکته
برای تعیین ظرفیت مولكول های چند اتمی، باید در ابتدا اتم مركزی را در مولكول مورد بررسی پیدا کرد. بعد از تعیین اتم مركزی مولکول، آرایش الكترونی اتم مركزی به همراه الكترون هایی كه از اتم های مجاورش گرفته را بنویسید. حالا تعداد الكترون هایی كه اتم مركزی باید بگیرد یا اینکه از دست بدهد تا به آرایش الکترونی گاز نجیب دست یابد را محاسبه کنید. ظرفیت برخی عناصر در جدول زیر آورده شده است.
| ظرفیت (جهت پیوند های کووالانسی) | الکترون های ظرفیت | گروه (جدول تناوبی) |
| – | ۱ | گروه ۱ (فلزات قلیایی) |
| – | ۲ | گروه ۲ (فلزات قلیایی خاکی) |
| – | مقدار ظرفیت برابر با تعداد الکترون های لایه d است | گروه ۳–۱۲ (فلزات واسطه) |
| – | ۳ | گروه ۱۳ (گروه بور) |
| ۴ (فقط کربن) | ۴ | گروه ۱۴ (گروه کربن) |
| ۳ | ۵ | گروه ۱۵ (گروه نیتروژن) |
| ۲ | ۶ | گروه ۱۶ (گروه اکسیژن) |
| ۱ | ۷ | گروه ۱۷ (هالوژن ها) |
| ۰ | ۸ | گروه ۱۸ (گاز های نجیب) |
تعداد الکترون ظرفیت عناصر
الکترون های ظرفیتی به عنوان الکترونی هستند که در بیرونی ترین پوسته اتم یافت می شوند و به طور کامل پر نشده اند تا به پیکربندی گازهای بی اثر برسند. یک عنصر می تواند تعدادی الکترون از دست بدهد یا به دست بیاورد تا به ثبات برسد که به آن ظرفیت می گویند. الکترون های ظرفیت به تعیین خواص شیمیایی یک عنصر کمک می کنند.
الکترون های پوسته بیرونی قدرتمند تر از الکترون های پوسته داخلی هستند. تشکیل پیوندها توسط الکترون های ظرفیتی انجام می شود. الکترون های ظرفیت را می توان به اشتراک گذاشت و درون اتم ها منتقل کرد. برای دستیابی به پیکربندی گاز نجیب می توانند قاعده هشت گانه را برآورده کنند. تعداد الکترون های ظرفیت یک اتم را می توان با کمک جدول تناوبی تعیین کرد.
رسانایی الکتریکی هر عنصری را می توان با کمک این الکترون ها مشخص کرد. آنها به تعیین اینکه آیا یک اتم، فلزی، غیرفلزی یا فلزی است کمک می کند. تعداد الکترون ها به تعیین رفتار پیوندی یک اتم کمک می کند. عناصری که تعداد الکترون های ظرفیت یکسانی دارند در یک جدول تناوبی با هم دسته بندی می شوند. الکترون های ظرفیت را می توان به راحتی با کمک جدول تناوبی تعیین کرد.
الکترون های ظرفیت را می توان به راحتی با کمک جدول تناوبی تعیین کرد. می توان آن را در همه عناصر یافت، حتی اگر از گروه ۳ تا گروه ۱۲ عناصر باشند. الکترون های این گروه ها را می توان به راحتی تعیین کرد، اما پیش بینی آنها دشوار است.
الکترون های ظرفیت را می توان با بررسی ستون عمودی جدول تناوبی تعیین کرد. با کمک اعداد گروهی به راحتی می توانیم تعداد الکترون های ظرفیت یک عنصر را محاسبه کنیم. روش دیگر برای محاسبه الکترون ظرفیت، تعیین پیکربندی الکترونیکی یک عنصر است.
الکترون ظرفیت عناصر واسطه
عناصر واسطه یا فلزات واسطه در گروههای ۳ تا ۱۲ جدول تناوبی قرار دارند. ویژگی مهم این عناصر وجود اوربیتالهای d است که نقش مهمی در خواص شیمیایی این عناصر دارند. ظرفیت الکترونی عناصر واسطه از ۱ تا ۳ متغیر است بنابراین آنها می توانند الکترونهای d و s را از دست داده یا به دست بیاورند. در این عناصر، الکترون های d بهعنوان الکترونهای ظرفیت هستند و باعث نقطه ذوب و جوش بالا، هدایت الکتریکی و غیره در این عناصر می شوند. این اکترون های باعث می شوند عناصر واسطه حالت های اکسیداسیون مختلفی داشته باشند که برای واکنش های شیمیایی بسیار حائز اهمیت است. بطور کلی الکترونهای ظرفیت در عناصر واسطه خواص شیمیایی و فیزیکی پیچیده و جالب این عناصر را تعیین می کنند بنابراین بهتر است آنها را به خوبی یاد بگیرید.