رابطه قدرت اسید با ثابت تعادل در چیست؟

قدرت اسید بر اساس توانایی یا تمایل آن در از دست دادن یک پروتون سنجیده می شود. قطبیت شیمیایی پیوند H—A و بزرگی اتم A از عوامل مهمی هستند که در از دست دادن پروتون نقش دارند. علاوه بر این، قدرت یک اسید به پایداری باز مزدوج آن نیز بستگی دارد.
ثابت تعادل پارامتری است که بر اساس غلظت واکنش دهنده های مختلف در واکنشی که به تعادل رسیده، تعریف می شود. ثابت تعادل کمک می کند تا متوجه شویم که در یک واکنش در حال تعادل، غلظت کدام یک از واکنش دهنده ها یا فرآورده ها بیشتر است.
به این ترتیب، با کمک ثابت تعادل و تعیین جهت واکنش، می توان قدرت اسید را تعیین کرد. در این مقاله از نشریه علمی جهان شیمی به بررسی ثابت تعادل، روش محاسبه ی آن و تعیین قدرت اسیدی می پردازیم.
تعادل شیمیایی چیست
واکنش ها تمایل دارند به نقطه ای برسند که فرآیند های رفت و برگشت، با یک آهنگ و به صورت هم زمان اتفاق بیافتند. از آن جایی که آهنگ واکنش های رفت و برگشت یکسان است، غلظت واکنش دهنده ها و فرآورده ها در نقطه تعادل یکسان خواهند بود.
توجه به این نکته ضروری است که اگر چه غلظت ها در نقطه تعادل یکسان هستند اما، واکنش همچنان در حال انجام است. از این رو، به این وضعیت تعادل دینامیکی یا پویا نیز می گویند.
ثابت تعادل چیست
بر اساس غلظت واکنش دهنده های مختلف یک واکنش که به تعادل رسیده است، می توان پارامتری به نام ثابت تعادل تعریف کرد. این پارامتر را با علامت Kc ،K و Keq نشان می دهند. حرفc حرف اول کلمه ی غلظت (Concentration) است. زیرا ثابت تعادل، بیانی برای غلظت های تعادلی بر حسب مولار (mol/L) و دمای مشخص است.
ثابت تعادل کمک می کند تا بفهمیم که در یک واکنش در حال تعادل، غلظت کدام یک از واکنش دهنده ها یا فرآورده ها بیشتر است. علاوه بر این، به کمک این عبارت حالت تعادلی یا غیر تعادلی یک واکنش را می توان تعیین کرد.
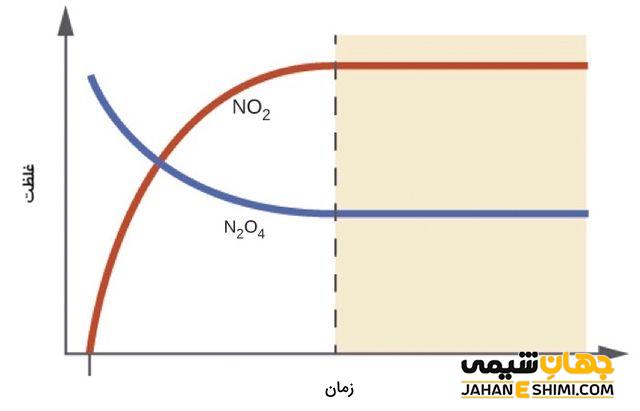
روش محاسبه ثابت تعادل
برای محاسبه ی ثابت تعادل، واکنش تعادلی زیر را در نظر بگیرید.
aA + bB ⇌ cC + dD
اگر غلظت مولار هر یک از اجزای واکنش دهنده و فرآورده را داشته باشیم، می توان ثابت تعادل از به کمک رابطه زیر محاسبه کرد.
Kc = [C]c[D]d/[A]a[B]b
در این رابطه [A] و [B] غلظت های تعادلی واکنش دهنده ها بر حسب مولاریته، [C] و [D] غلظتهای تعادلی فرآوردهها بر حسب مولاریته است. c ،b ،a و d ضرایب استوکیومتری معادله موازنه شده بر حسب مولاریته هستند.
نکات مربوط به محاسبه ثابت تعادل
برای محاسبه ی ثابت تعادل باید نکات مهمی را در نظر گرفت. در ادامه به این نکات می پردازیم.
- KC تابعی از دما نیز است. این موضوع نشان می دهد که این عبارت برای یک واکنش خاص در دمای ثابت، مقداری ثابت است. اما همزمان با تغییر دما، میزان KC نیز تغییر می کند.
- جامدات خالص، مانند مایعات خالص که شامل حلال ها نیز می شوند، در رابطه بالا قرار نمی گیرند.
- KC معمولا پارامتری بدون واحد است.
- واکنش باید به صورت موازنه شده و با کمترین اعداد صحیح ممکن بازنویسی شود تا مقادیر درستی از KC به دست آید.
- لازم به ذکر است، در صورتی که هر یک از واکنش دهنده ها یا فرآورده ها به صورت گاز باشند، ثابت تعادل بر اساس فشار جزئی گاز نوشته می شود. در این صورت ثابت تعادل با Kp نمایش داده می شود تا از محاسبات ثابت تعادل بر حسب مولاریته جدا باشد.
اطلاعات حاصل از ثابت تعادل
مقدار KC اطلاعاتی در خصوص غلظت واکنش دهنده ها و فرآورده های واکنش در حال تعادل، به ما می دهد که در ادامه به آن می پردازیم.
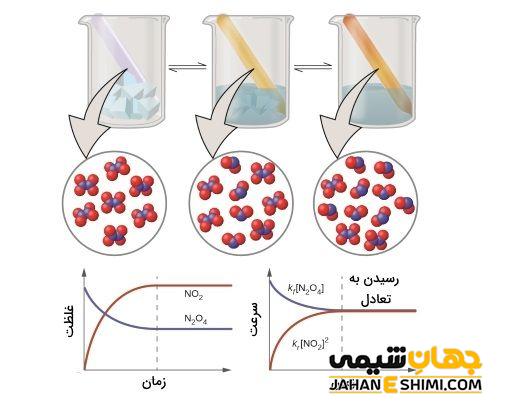
- اگر مقادیر KCبیش از ۱۰۰۰ باشد بیان می کند که در واکنش، میزان فرآورده در حالت تعادل بیشتر است.
- چنانچه مقدار KC در واکنش تعادلی، بسیار کم و در حدود ۰/۰۰۱ یا کمتر باشد، میزان واکنش دهنده ها بیشتر است.
- اگر مقدار KC بین ۰/۰۰۱ و ۱۰۰۰ باشد، نشان می دهد غلظت های خوبی از هر دو ماده واکنش دهنده و فرآورده داریم.
نکته
با توجه به نکات مطرح شده می توان به این نتیجه رسید که اگر مقدار KCخیلی بزرگ و یا خیلی کوچک باشد، به ترتیب تمایل واکنش در حال تعادل، به تولید فرآورده و یا واکنش دهنده است.
قدرت اسید به چه مواردی بستگی دارد
قدرت اسید بر اساس توانایی یا تمایل آن اسید در از دست دادن یک پروتون (+H) سنجیده می شود. قطبیت شیمیایی پیوند H—A و بزرگی اتم A که در قدرت پیوند H—A تاثیر می گذارد، دو عامل مهمی هستند که در از دست دادن پروتون نقش دارند. علاوه بر این، قدرت اسید به پایداری باز مزدوج آن نیز بستگی دارد.
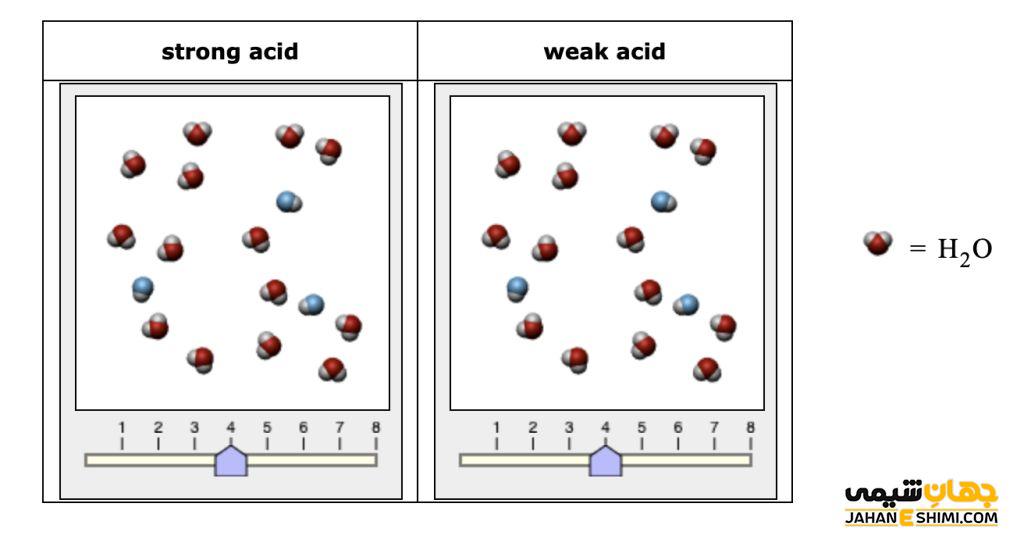
اسید قوی چیست
اسیدی است که در یک محلول به طور کامل یونیزه یا تفکیک می شود. به عنوان مثال، یک مول از یک اسید قوی HA در آب یک مول+H و یک مول باز مزدوج–A تولید می کند و به این ترتیب هیچ اثری از اسید یونیزه نشده ی HA باقی نمی ماند.
از جمله اسیدهای قوی شناخته شده می توان به اسید های هیدروکلریک (HCl)، هیدرویدیک (HI)، هیدروبرومیک (HBr)، پرکلریک (HClO۴)، نیتریک (HNO۳) و سولفوریک (H۲SO۴) اشاره کرد. هر چقدر اسید قوی تر باشد، ثابت تفکیک آن (Ka) بزرگتر و ثابت لگاریتمی آن کوچکتر است.
اسید ضعیف چیست
اسیدی است که در محلول تنها به صورت جزئی دچار تفکیک می شود. به عنوان مثال، اسید های کربنیک (H۲CO۳)، استیک (CH۳COOH)، فسفریک، هیدروفلوئوریک و اگزالیک نمونه هایی از اسید های ضعیف هستند.

این اسیدها به گونه ای هستند که در یک محلول، به صورت اسید و باز مزدوج در حالت تعادل دیده می شوند. بیشتر اسیدها از نوع ضعیف هستند. از این رو، اسید ضعیف هنگام انحلال در حلال، پروتون هایش را به طور کامل به حلال ندهد.
ثابت تفکیک اسید چیست
ثابت تفکیک اسید که با علامت Ka نشان داده می شود، معیاری است که قدرت آن در یک محلول را تعیین می کند. در واقع، به منظور تعیین قدرت نسبی اسید و باز می توان از مقدار ثابت تعادل در یک واکنش یونش یا یونیزاسیون استفاده کرد. به طور کلی، واکنش یونش یا تفکیک اسید ضعیف در آب، به صورت زیر است.
HA(aq)+H۲O(l)⇌H۳O+(aq)+A−(aq)
در رابطه ی فوق HA، اسید و A-، باز مزدوج آن است. ثابت تعادل برای این معادله به صورت زیر تعریف می شود.
K=[H۳O+][A−][H۲O][HA]
توجه به این نکته ضروری است که غلظت آب خالص، در تمام واکنش های محلول در آب، مقدار ثابتی است. از این رو، غلظت آب در معادله ی فوق را می توان با کمیت ثابت تفکیک اسید یا ثابت یونش اسید (Acid Ionization Constant) و به صورت زیر تعریف کرد.
Ka=K[H۲O]=[H۳O+][A−][HA]
بنابراین، می توان نتیجه گرفت مقادیر عددی K و Ka، با یکدیگر به اندازه غلظت آب یعنی ۵۵/۳ مولار، تفاوت دارند. از این رو، برای سادگی کار می توان عبارت H+ را به جای عبارت H۳O+ مورد استفاده قرار داد.
توجه به ین نکته ضروری است که H+ به صورت آزاد در هیچ یک از محلول های آبی وجود ندارد. پروتون در واکنش های یونش به H۲ منتقل می شود تا یون هیدرونیوم (H۳O+) تشکیل دهد. هر چقدر میزان Ka بیشتر باشد، قدرت اسید و غلظت H+ در حالت تعادل، بیشتر است.
مانند تمامی ثابت های تعادل، ثابت های تفکیک اسید و باز را می توان بر اساس فعالیت یا اکتیویته H+ یا OH− اندازه گیری کرد. به همین دلیل، این مقادیر مقادیری بدون واحد هستند.
مقایسه قدرت اسید به کمک pKa
از آن جایی که در محاسبه pKa از لگاریتم منفی استفاده می شود، مقادیر کم از pKa بیانگر ثابت تفکیک اسید بزرگتر و به دنبال آن، قدرت اسیدی بیشتر است. به عنوان مثال، نیتروس اسید با فرمول HNO۲ دارای pKa برابر با ۳/۲۵ است.
این ترکیب حدود یک میلیون بار قوی تر از هیدروسیانیک اسید (HCN) با pKa برابر با ۹/۲۱ است. به این ترتیب، مقادیر کم pKb متناظر با باز های قوی و ثابت تفکیک بازی بیشتر ذکر می شود.
نکته
باز مزودج یک اسید قوی، خود یک باز بسیار ضعیف و بر عکس، اسید مزدوج یک باز قوی، خود اسیدی بسیار ضعیف است.
ثابت تفکیک اسید و تعیین جهت واکنش
از قدرتهای نسبی اسیدها و بازها می توان برای پیش بینی جهت واکنش های اسید و باز استفاده کرد. برای این کار می توان از قانون ساده زیر بهره گرفت.
یک واکنش تعادلی اسید و باز همواره به سمتی پیش می رود که اسید و باز ضعیف داشته باشیم. در این نوع واکنش ها، پروتون همواره با باز قوی وارد واکنش می شود.
به عنوان مثال، هیدروکلریک اسید، نوعی اسید قوی محسوب می شود که عموما، در محلول های رقیق به طور کامل تفکیک می شود. به این ترتیب، H۳O+ و Cl− تولید شده و تنها مقادیر بسیار کمی از مولکول های HCl تفکیک نشده باقی می ماند.
در نتیجه، جهت واکنش به طور کامل به طرف راست خواهد بود. همان طور که در زیر نشان داده شده است، معادله این واکنش و جهت آن با یک فلش نشان داده می شود.
HCl(aq)+H۲O(l)→H۳O+(aq)+Cl−(aq)

در مقابل، استیک اسید یکی از اسیدهای ضعیف و آب نیز یک باز ضعیف است. در نتیجه، محلول های آبی استیک اسید بیشتر شامل مولکول های استیک اسید در تعادل با غلظت های کم از H۳O+ و یون های استات است. جهت پیشرفت واکنش تعادلی به سمت چپ خواهد بود.
به طور مشابه، در واکنش آمونیاک با آب، یون هیدروکسید یک باز قوی و آمونیاک یک باز ضعیف است. این درحالی است که یون آمونیوم، اسیدی قوی تر از آب به شمار می آید. از این رو، تعادل در این واکنش به طرف چپ جابجا خواهد شد.



















