فلز و نافلز چیست و از شباهت و تفاوت آنها چه می دانید؟

فلز و نافلز دو دسته از ترکیباتی هستند که همه ما با نگاه به پیرامون خود می توانیم انواع آنها را مشاهده کنیم. مبحث ویژگی فلزات و نافلزات علوم هفتم بطور کامل به این ترکیبات پرداخته است. ما با انواع فلز و نافلز در جدول تناوبی آشنا می شویم و تاحدودی با ویژگی این ترکیبات آشنا هستیم.
بطورکلی عناصر را می توان به عنوان فلز ، نافلز یا شبه فلزات طبقه بندی کرد. فلزات رسانای خوبی برای گرما و الکتریسیته هستند، بیشتر فلزات در دمای اتاق جامد هستند و دارای درخشش نقره ای مشخصی می باشند.
نافلزات معمولاً رسانای ضعیف گرما و برق هستند و چکش خوار و شکل پذیر نیستند. بسیاری از غیر فلزات اساسی در دمای اتاق گاز هستند ، در حالی که برخی از آنها مایع و برخی دیگر جامد هستند. در ادامه مقاله در نشریه جهان شیمی فیزیک توضیحات بیشتری در این رابطه ارائه می شود.
مقایسه فلز و نافلز
فلز
فلزات دسته ای از مواد با هدایت الکتریکی و حرارتی بالا و همچنین قابلیت انعطاف پذیری و شکل پذیری با قابلیت انعکاس نور هستند. تقریباً سه چهارم عناصر شیمیایی شناخته شده فلزات هستند. فراوانترین انواع آنها پوسته زمین شامل آلومینیوم ، آهن ، کلسیم ، سدیم ، پتاسیم و منیزیم است.
اکثریت قریب به اتفاق فلزات در سنگ معدن ها (مواد حامل مواد معدنی) یافت می شود ، اما تعداد کمی از آنها مانند مس ، طلا ، پلاتین و نقره نیز در حالت آزاد وجود دارند زیرا به راحتی با عناصر دیگر واکنش نمی دهند. مبحث ویژگی فلزات علوم هفتم به این مقوله پرداخته است.
فلزات معمولاً جامدات بلوری هستند و در بیشتر موارد ساختار کریستالی نسبتاً ساده ای دارند که با تراکم نزدیک اتم ها و درجه تقارن بالا مشخص می شود. به طور معمول ، اتمهای فلزات حاوی تعداد کمی الکترون در خارجی ترین پوسته خود هستند.
به دلیل این ویژگی ، فلزات تمایل ندارند که با یکدیگر ترکیبات تشکیل دهند. با این حال ، آنها به راحتی با غیر فلزات ترکیب می شوند ترکیب فلز با نافلز نیز بر اساس همین ویژگی به راحتی صورت می گیرد. فلزات از نظر واکنش شیمیایی بسیار متفاوت هستند. واکنش پذیرترین آنها شامل لیتیوم ، پتاسیم و رادیوم است ، در حالی که طلا ، نقره ، پالادیوم و پلاتین کمترین واکنش پذیری را دارند.
نافلز
نافلزات را می توان به دو دسته تقسیم کرد: ۱) مواد کووالانسی که حاوی اتمهایی با اندازه های کوچک ، بار منفی الکتریکی زیاد ، تمایل شدید به تشکیل یون های منفی در واکنش های شیمیایی و دارای حالت های اکسیداسیون منفی در ترکیباتشان هستند. ۲) مواد یونی ، که حاوی دو اتم کوچک و بزرگ هستند. یون ها ممکن است با افزودن الکترون به (اتم های کوچک والکترونگاتیو) یا با استخراج الکترون از اتم های (بزرگ ، الکتروپوزیتی) ایجاد شوند.
این ترکیبات دارای انرژی فعال سازی محدودی برای هدایت الکترون هستند. این بدان معناست که غیر فلزات رسانایی الکتریکی کم (عایق) تا متوسط (نیمه رسانا) را نشان می دهند که با افزایش دما افزایش می یابد. این ترکیبات در ولتاژ و دمای بالا در معرض تجزیه دی الکتریک قرار می گیرند. مانند فلزات ، نافلزات نیز ممکن است به شکل جامد ، مایع یا گازی وجود داشته باشند. با این حال ، بر خلاف فلزات ، غیر فلزات طیف گسترده ای از خواص مکانیکی و نوری را از شکننده تا پلاستیک و از شفاف تا مات نشان می دهند.

خصوصیات شیمیایی فلز و نافلز
عناصر فلزی بسیار واکنش پذیر هستند آنها تمایل دارند الکترونها را به راحتی از دست بدهند و یونهایی با بار مثبت تشکیل دهند. این مسئله اجازه می دهد تا فلزات به راحتی با عناصر دیگر ترکیب تشکیل دهند.
فلزات به راحتی خورده می شوند. آنها در اثر اکسیداسیون آسیب دیده و دچار زنگ زدگی یا لکه می شوند. تقریباً تمام فلزات با اکسیژن ترکیب شده و اکسید فلزی تشکیل می دهند. فلزاتی مانند سرب ، مس ، نقره و طلا به هیچ وجه با آب واکنش نشان نمی دهند. با اینحال فلزات با اسید واکنش می دهند و نمک و هیدروژن می دهند.
غیر فلزات اکسیدهایی تشکیل می دهند که ماهیت اسیدی دارند. غیر فلزات به راحتی الکترون های ظرفیت را بدست می آورند یا به اشتراک می گذارند. نافلزات با گرفتن الکترون، آنیون تشکیل می دهند. مبحث ویژگی نافلزات علوم هفتم به بیشتر این خصوصیات اشاره کرده است.
خصوصیات فیزیکی فلز و نافلز
فلزات به جز سدیم و پتاسیم همگی سخت هستند. نقاط جوش و ذوب فلزات زیاد است و همچنین چگالی بالایی دارند. فلزات به جز جیوه هنگام ضربه زدن صدا تولید می کنند. فلزات را می توان با چکش به ورق های نازک تبدیل کرد که به این حالت چکش خواری گفته می شود. فلزات را می توان به سیمهای نازک تبدیل کرد.
در مقایسه خصلت نافلزی باید گفت که غیر فلزات بیشتر به شکل گاز یافت می شوند به جز برم که در حالت مایع یافت می شود. غیر فلزات به جز ید و گرافیت سطح کدری دارند و هنگام ضربه زدن سر و صدا ایجاد نمی کنند. ذره سازنده عناصر نافلز و فلز اتم است که در سطوح پایین تر به الکترون ، پروتون و نوترون می رسد. غیر فلزات به جز الماس همگی نرم هستند.
تنها فلز مایع در طبیعت کدام است؟
تنها فلز مایع در طبیعت جیوه است که یک فلز مایع سنگین می باشد که هزاران سال مردم را مجذوب خود کرده است. با این حال ، به دلیل سمی بودن بسیاری از کاربردهای جیوه در حال از بین رفتن هستند. این عنصر اکنون به طور عمده در صنایع شیمیایی به عنوان کاتالیزور استفاده می شود. جیوه همچنین در برخی از کلیدهای برق و یکسوسازها مورد استفاده قرار می گیرد. پیش از این عمده ترین کاربرد این فلز در ساخت هیدروکسید سدیم و کلر توسط الکترولیز آب نمک بود.
جیوه به راحتی با فلزات دیگری مانند طلا ، نقره و قلع آلیاژهایی تشکیل می دهد که آمالگام نامیده می شوند. سهولت ادغام آن با طلا ، آن را در بازیابی طلا از سنگ معادن خود مفید کرده است. از آمالگام های جیوه در پر کردن دندان نیز استفاده می شد.
تنها نافلز مایع در طبیعت کدام است؟
تنها نافلز مایع در طبیعت برم است. برم آزاد مایعی قهوه ای مایل به قرمز با فشار بخار قابل توجه در دمای اتاق است. بخار برم به رنگ کهربایی است. برم بوی تندی دارد و برای پوست ، چشم و سیستم تنفسی تحریک کننده است. قرار گرفتن در معرض بخار برم غلیظ ، حتی برای مدت کوتاه ممکن است کشنده باشد. مانند سایر هالوژن ها ، برم به صورت مولکول های دیاتومیک در تمام حالت های تجمعی وجود دارد.
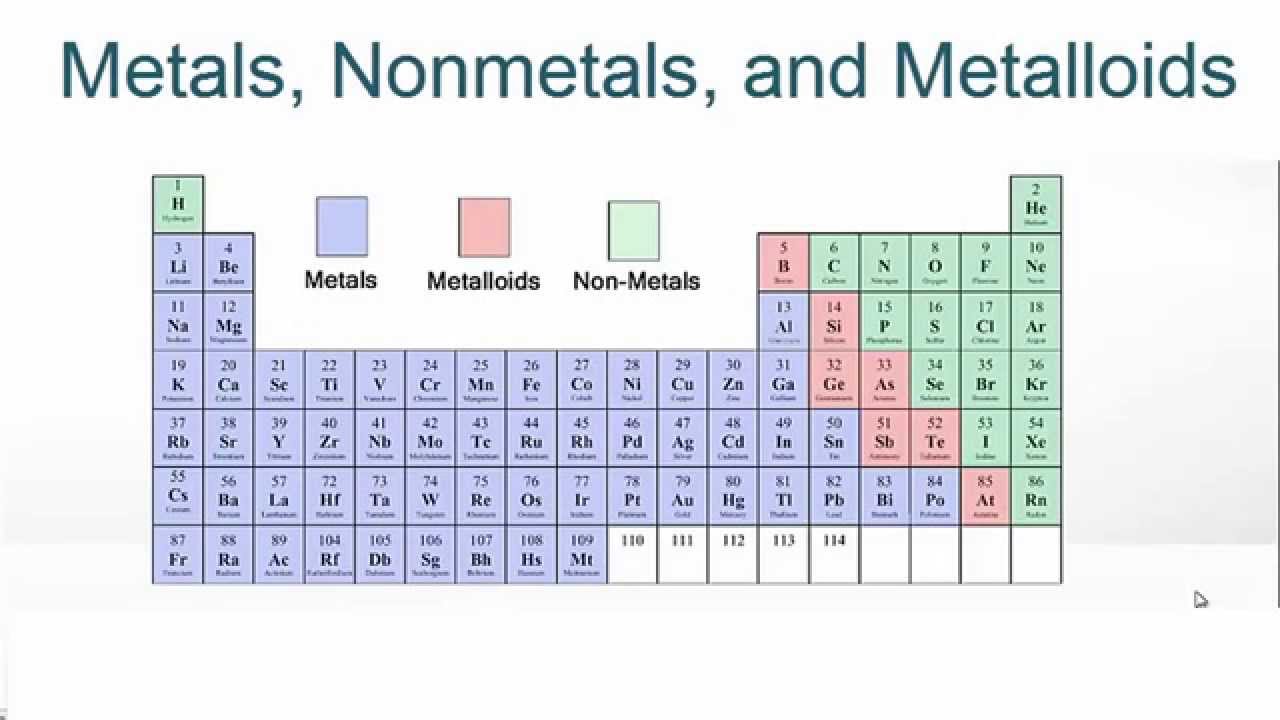
تشخیص فلز و نافلز در جدول تناوبی
تمام عناصر اطراف ما به سه دسته فلزات، غیرفلزها و متالوئیدها طبقه بندی می شوند. بنابراین می توان گفت که تمام عناصر جدول تناوبی به این سه دسته تقسیم می شوند. فلزات و غیرفلزات دو نوع ماده ای هستند که ممکن است خصوصیات فیزیکی و شیمیایی آنها را متمایز کند. فلزات عناصری هستند که معمولاً به دلیل وجود یک اتصال فلزی قوی بین اتم ها سخت هستند. از طرف دیگر، غیرفلزها عموماً نرم هستند.
فلزات به عناصری گفته می شود که دارای یک، دو یا سه الکترون در لایه ظرفیت خود هستند. غیرفلزها عناصری هستند که دارای ۴، ۵، ۶ یا ۷ الکترون در بیرونی ترین پوسته خود هستند. اتم های فلز در واکنش با غیر فلزات الکترون خود را از دست می دهند. هنگامی که این کار را انجام می دهند، یون هایی با بار مثبت تشکیل می دهند. به طور کلی، فلزات گروه ۱ نسبت به فلزات گروه ۲ واکنش پذیرتر هستند و این فلزات نسبت به فلزات گروه ۳ واکنش پذیرتر هستند. همچنین، با پایین آمدن در یک گروه، فلزات واکنش پذیرتر می شوند. این بدان معنی است که واکنش پذیرترین فلزات در سمت چپ پایین جدول تناوبی یافت می شوند.
عناصر انتقالی (بلوک بزرگی از فلزات بین گروه های ۲ و ۳) در مقایسه با فلزات دیگر نسبتاً غیر فعال هستند. آنها عبارتند از فلزاتی مانند طلا و پلاتین که به دلیل براق ماندن در ساخت جواهرات استفاده می شوند.
اتم های غیر فلزی در واکنش با فلزات الکترون می گیرند. هنگامی که این کار را انجام می دهند، یون هایی با بار منفی تشکیل می دهند. به طور کلی، غیرفلزهای گروه ۷ واکنش پذیرتر از غیر فلزات گروه ۶ هستند و اینها نسبت به غیر فلزات گروه ۵ واکنش پذیرتر هستند. همچنین، با بالا رفتن در یک گروه، غیر فلزات واکنش پذیرتر می شوند. این بدان معنی است که واکنش پذیرترین نافلزات در سمت راست بالای جدول تناوبی یافت می شوند.