با انواع پیوند شیمیایی بیشتر آشنا شویم

همه ی ما میدانیم که مواد از اتم ها و مولکول ها ساخته شده اند .برای همین منظور باید بین اتم ها یا مولکول ها پیوند هایی برقرار شود تا در کنار هم قرار بگیرند و مواد مختلف را بسازند.به این پیوند ها پیوند های شیمیایی گفته میشود.معروف ترین پیوند های موجود پیوند کوالانسی پیوند یونی و پیوند هیدروژنی هستند.در ادامه این مقاله نشریه جهان شیمی فیزیک درباره شباهت ها و تفاوت ها و کاربرد این پیوند ها را توضیح خواهیم داد.
با انواع پیوند شیمیایی بیشتر آشنا شویم
میدانیم که گرافیک و الماس هر دو از اتم های کربن ساخته شده اند و اتم سازنده ی هر دو یکی است . پس چه چیزی تفاوت میان این دو را ایجاد میکند که یکی چنان نرم و دیگری سخت تر از فولاد باشد؟ تفاوت در پیوند های شیمیایی است . نحوه ی قرارگیری اتم ها در کنار هم نوع و تعداد پیوند های شیمیایی باعث ایجاد ساختار های مختلف می شود.
در دنیایی زندگی می کنیم که مواد ما را احاطه کرده اند. اتم ها را به عنوان کوچکترین ذرات سازنده مواد می شناسیم .گاهی اتم ها در کنار یکدیگر موادی را می سازند مانند; مس یا آهن .اتم ها نیز می توانند تشکیل ساختاری به نام مولکول بدهند مانند آب یا اکسیژن بعد مولکول ها در کنار هم مواد را می سازند. مولکول ها می توانند از اتم های یکسان مانند اکسیژن باشند که در این حالت به آن مولکول جور هسته یا از اتم های متفاوت مانند آب تشکیل میشوند که به آن مولکول ناجور هسته میگوییم.
میان مولکول ها نیز پیوند هایی وجود دارد و تفاوت در نحوه قرار گیری آن ها ، نوع و تعداد پیوند های میان آن ها نیز ساختار های متفاوتی ایجاد میکند. به آب و یخ توجه کنید. برای کنار هم نگه داشتن اتم ها به انرژی نیاز است. پس پیوند ها انرژی دارند.هر نوع از پیوند با توجه اینکه میان چه اتم ها یا مولکول هایی قرار گرفته است سطح انرژی متفاوتی دارند. همچنین بدانید استحکام پیوند های شیمیایی را با الکترونگاتیوی می سنجند. پیوند ها را به طور کلی به ۲ دسته تقسیم می کنیم:
- پیوند های بین اتمی : پیوند کووالانسی و پیوند یونی
- پیوند های بین مولکولی : پیوند واندروالسی و پیوند هیدروژنی
پیوند های بین اتمی
در حالت عادی و خنثی درون اتم ها تعداد پروتون ها و الکترون ها برابر است .میدانیم که اتم ها درون هسته؛ پروتون و نوترون دارند و الکترون ها در لایه هایی ابر مانند در اطراف هسته قرار دارند. به آخرین لایه ابری اتم لایه ظرفیت گفته میشود. معمولا الکترون های این لایه ، در تشکیل پیوند ها شرکت میکنند.
پروتون ها داری بار مثبت و الکترون ها دارای بار منفی و نوترون ها خنثی هستند .اتم ها میتوانند با گرفتن یا از دست دادن الکترون به یون تبدیل شوند.به یون مثبت کاتیون می گویند مانند یون سدیم +Na چون اتم سدیم یک الکترون از آخرین لایه ابری خود از دست داده و تبدیل به کاتیون شده است.به یون منفی آنیون می گویند مانند یون کلرید -cl چون اتم کلر یک الکترون گرفته پس به آنیون تبدیل شده .
در طی یک واکنش شیمیایی پیوندهای شیمیایی جدید ایجاد می شوند.برای مثال به فرایند تشکیل نمک توجه کنید.در این حالت در طی واکنش شیمیایی که میان اتم های سدیم و کلر انجام میشود انتقال الکترون صورت میگیرد.یعنی اتم سدیم الکترون خود را به اتم کلر می دهد.پس در نتیجه یون های سدیم و کلرید به وجود می آیند.این در حالی است که بار مثبت و منفی همدیگر را جذب می کنند پس یون سدیم و کلرید هم به سوی هم کشیده میشوند ،باعث ایجاد پیوندی قوی میان دو یون میشود که به پیوند یونی معروف است.
پس نمک NaCl تشکیل می شود. اگر به ذرات نمک دقت کنید حالت کریستالی آنها را متوجه می شوید علت این موضوع به نحوه قرار گیری پیوند های یونی مربوط است .چون پیوند های یونی در سه بعد قرار میگیرند ساختار منظم و کریستالی ایجاد میکنند .یعنی امکان دارد یک یون در چهار طرف خود پیوند یونی ایجاد کند. در فیزیولوژی یون ها اهمیت زیادی دارند و به نام الکترولیت ها شناخته میشوند .معروف ترین الکترولیت ها سدیم و پتاسیم و کلسیم هستند.
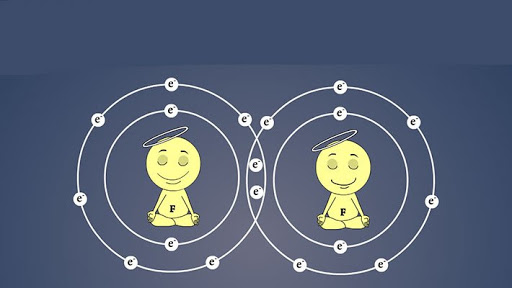
پیوند کووالانسی
وقتی اتم ها به جای انتقال الکترون ، الکترون به اشتراک بگذارند پیوند کووالانسی ایجاد میشود.در دنیای زنده از جمله بدن ما پیوند کووالانسی از یونی معمول تر است.اگر اتم ها هر کدام یک الکترون به اشتراک بگذارند پیوند یگانه ؛ اگر دو الکترون به اشتراک بگذارند پیوند دوگانه و اگر هر کدام سه الکترون به اشتراک بگذارند پیوند سه گانه ایجاد می شود.
در پیوند کووالانسی لایه های ابری درون هم فرو میروند مثلا در تشکیل مولکول آب دو اتم هیدروژن و یک اتم اکسیژن با هم پیوند کووالانسی تشکیل میدهند . اتم هیدروژن کلا یک الکترون دارد و اتم اکسیژن در لایه ظرفیت خود دو الکترون دارد . اتم اکسیژن هر کدام از الکترون هایش را با یک هیدروژن به اشتراک گذاشته و در نهایت بین اکسیژن و هیدروژن ها پیوند های کووالانسی ایجاد میشود. وقتی میگویم اشتراک گذاری الکترون یعنی الکترون علاوه بر این که ; مدتی در لایه ابری اتم خود قرار دارد مدت زمانی را نیز در لایه ابری اتم مجاور می گذراند ؛ یعنی بین این لایه و آن لایه در رفت و آمد است. پیوند های کووالانسی بر دو نوع اند: قطبی و غیرقطبی
پیوند کووالانسی قطبی
زمانی پیوند کووالانسی قطبی دارید که الکترون به اشتراک گذاشته شده مدت زمان بیشتری را در یکی از لایه های یکی از اتم ها بگذراند. در واقع میل بیشتری به یکی از اتم ها داشته باشه.این عدم توازن و هماهنگی باعث قطبی بودن پیوند کووالانسی می شود. وقتی الکترون زمان بیشتری را در یکی از لایه ها می گذارند بار جزئی به آن اتم می دهد و همان قدر بار از اتم دیگر کاسته می شود.
پس مولکول دارای دو سر قطبی می شود که یک اتم بار جزیی منفی اتم دیگر بار جزئی مثبت میگیرد.مولکول آب یک مولکول قطبی است چون اتم اکسیژن الکترونگاتیوی بیشتری دارد یعنی تمایل بیشتری به جذب الکترون دارد .الکترون های به اشتراک گذاشته شده مدت بیشتری را در اطراف اتم اکسیژن می گذرانند.بنابراین در مولکول آب ،اتم اکسیژن بار جزئی منفی و اتم هیدروژن بار جزئی مثبت میگیرد به دلیل همین قطبی بودن پیوند های کووالانسی آب، چون مولکول ها جهت گیری میکنند آب خاصیت رسانایی دارد. چطور قطبی بودن یا نبودن پیوند کووالانسی را بفهمیم؟ در این حالت باید به تفاوت الکترونگاتیوی میان اتم های مولکول توجه کنیم .
پیوند کووالانسی غیر قطبی
اگر پیوند میان دو اتم یکسان مانند مولکول اکسیژن O2 یا میان اتم هایی که تمایل آنها به جذب الکترون (الکترونگاتیوی) یکسان باشدمانند مولکول متان CH4 در این حالت پیوند غیر قطبی است . در متان چون الکترونگاتیوی هیدروژن و کربن تقریبا یکسان است ، پس الکترون های به اشتراک گذاشته شده مدت زمان یکسانی در لایه های هر دو اتم می گذرانند پس تعادل برقرار است و مولکول های متان جهت گیری نمی کنند و پیوند کووالانسی غیر قطبی است.
پیوند های بین مولکولی
میان مولکول ها هم باید پیوند هایی برقرار باشد . گر چه پیوند های بین مولکولی از پیوندهای میان اتم ها ضعیف تر هستند ولی اهمیت کمتری ندارند که شاید مهم تر هم هستند.دنیای زنده به این پیوند ها وابسته است. اصلی ترین مواد بدن ما از جمله DNA و پروتئین ها با تغییر جزئی در این پیوند ها بهم میریزند .
پیوند هیدروژنی
اتم هیدروژنی معمولا کمترین الکترونگاتیوی را دارد وقتی با اتمی پیوند کووالانسی قطبی تشکیل میدهد اتم هیدروژن دارای بار جزئی مثبت میشود . حال اگر اتمی با بار جزئی منفی به این اتم هیدروژن نزدیک شود یک نیروی جاذبه بین این دو برقرار میشود و منجر به تشکیل پیوند هیدروژنی میشود.در طبیعت پیوند هیدروژنی بسیار معمول است . مثل آب یا ترکیبات آلی .
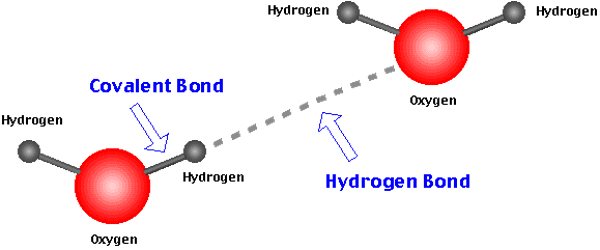
پیوند واندروالسی
این پیوند به نیروی پراکندگی لاندن نیز معروف است. یک پیوند با نیروی ضعیف بین مولکول ها است.برخلاف پیوند هیدروژنی که باید اتم هیدروژن حضور داشته باشد پیوند واندروالسی میتواند بین انواع اتم ها و مولکول ها برقرار شود. حالا چگونه این پیوند ایجاد میشود؟وقتی الکترون ها در حال چرخیدن هستند در یک لحظه ،توده ی الکترون در یک سمت اتم یا مولکول قرار می گیرد و سمت دیگر خالی از الکترون می شود در این لحظه اتم یا مولکول دچار قطبیت لحظه ای می شود و در همین زمان اتم ها یا مولکول های مجاور نیز تحت تاثیر این قطبیت لحظه ای قرار می گیرند و توزیع الکترونی آنها به هم می خورد ، در نتیجه دارای بار جزئی در یک سمت میشوند در نهایت بین این اتم ها یا مولکول ها جاذبهای برقرار می شود که منجر به ایجاد پیوند واندروالسی میشود . در برخی از مواقع منابع به هر دو پیوند هیدروژنی و لاندن پیوندهای واندر وانسی میگویند.
تفاوت پیوند کووالانسی و واندروالسی
اتم ها می توانند چندین نوع پیوند شیمیایی تشکیل دهند. این پیوندها برهمکنش بین دو اتم هستند که اتم ها را در کنار هم نگه می دارند. درک انواع مختلف پیوندها بسیار مهم است زیرا آنها به تعیین نحوه عملکرد مولکول های مختلف در یک ارگانیسم کمک می کنند. چهار نوع پیوند یا برهمکنش وجود دارد: پیوند کووالانسی، یونی، پیوند هیدروژنی و برهمکنش واندروالسی.
قوی ترین در بین نیروهای بین مولکولی پیوند یونی است. یک پیوند یونی بین دو یون مختلف که بارهای مخالف دارند تشکیل می شود. به عنوان مثال: کلرید سدیم دارای پیوندهای یونی بین یون های سدیم و یون های کلر است. مورد بعدی که بعد از پیوند یونی می آید، پیوند هیدروژنی است، یک مثال بسیار رایج از مولکولی که دارای پیوند هیدروژنی در مولکول های آب است که منجر به پیوند بین یون هیدروژن و یون هیدروکسیل می شود. بعد از پیوند هیدروژنی برهمکنش های دوقطبی-دوقطبی، یک دوقطبی بین دو اتم با الکترونگاتیوی متفاوت ایجاد می شود. فعل و انفعالات بین دوقطبی های دارای بار مخالف جذاب هستند. برهمکنش های دوقطبی-دوقطبی را می توان در مولکول های دی اکسید کربن مشاهده کرد. ضعیف ترین نیروی جاذبه بین مولکولی، نیروهای واندوالس است. اینها نشان دهنده جاذبه بین دوقطبی های آنی در یک مولکول هستند. به عنوان مثال: مولکول های متان دارای نیروهای جذب ضعیف هستند، یعنی نیروهای پراکندگی واندروالس. باید بدانیم که برای هیدروکربنها و سایر مولکولهای غیرقطبی که فاقد دوقطبی قوی هستند، این نیروهای پراکندگی واقعاً تنها نیروهای جذاب بین مولکولها هستند. نیروهای جاذبه بین یون های دارای بار مخالف توسط قانون کولن توضیح داده شده است که در آن نیرو با افزایش بار افزایش می یابد و با افزایش فاصله بین این یون ها کاهش می یابد.