پل نمکی چیست و چه نقشی در الکتروشیمی دارد؟
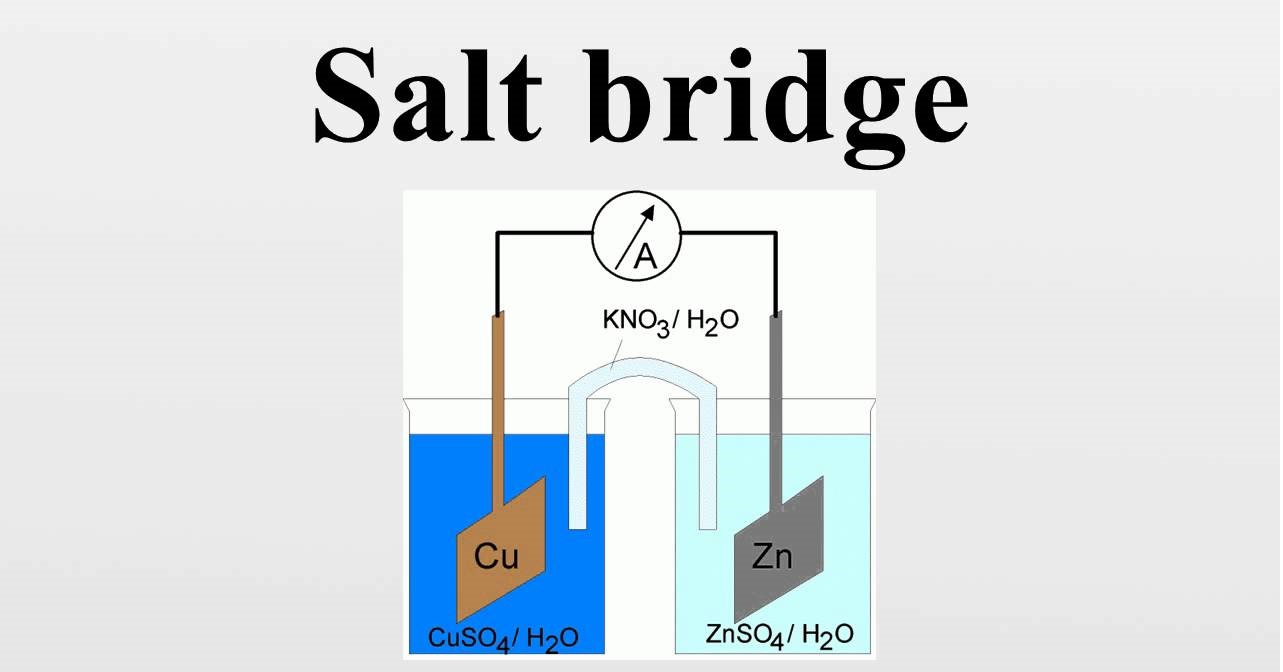
پل نمکی (Salt Bridge) وسیله ای است که در سلول الکتروشیمیایی برای اتصال نیم سلول اکسیداسیون و کاهش استفاده می شود. به عبارت دیگر پل نمکی وسیله ای است که محفظه های آندی و کاتدی را در یک سلول یا محلول الکترولیتی متصل می کند.
پل نمکی معمولاً از یک الکترولیت قوی تشکیل شده است که بیشتر AgNO3 ،KCl هستند. این پل ها بطورکلی در یک سلول گالوانی مانند سلول ولتایی یا سلول دانیل استفاده می شوند. پل نمکی در شیمی و الکتروشیمی کاربرد گسترده ای دارد و در اکثر دروس شیمی پایه با این وسیله آشنا می شوید. در ادامه مقاله در نشریه جهان شیمی فیزیک توضیحات بیشتری در این رابطه ارائه می شود.
عملکرد پل نمکی
عملکرد اصلی این پل کمک به خنثی سازی الکتریکی در مدار داخلی پیل های الکتریکی است. این پل ها همچنین به جلوگیری از اینکه واکنش سلول به سمت تعادل برود کمک می کنند. اگر پل های نمکی وجود نداشته باشد یا از آنها استفاده نشود ، واکنش احتمالاً ادامه خواهد یافت و محلول موجود در یکی از الکترودها با تجمع بار منفی مواجه می شود. به همین ترتیب ، در نیمه دیگر ، الکترود با تجمع بار مثبت روبرو خواهند شد. این امر بیشتر منجر به توقف واکنش می شود و هیچ الکتریسته ای تولید نخواهد شد.
اهمیت پل نمکی
این پل اساساً به جلوگیری از تجمع بارهای مثبت و منفی در اطراف الکترودهای مربوطه کمک می کند و باعث می شود که یک واکنش بدون اشکال انجام شود. این وسیله همچنین به جریان مداوم الکترون ها کمک می کند. با این حال ، هدف از استفاده از این پل حرکت الکترون ها از الکترولیت نیست بلکه حفظ تعادل بار است زیرا الکترون ها از یک نیم سلول به نیم سلول دیگر منتقل می شوند.
این پل از انتشار یا جریان مکانیکی محلول از یک نیم سلول به سلول دیگر جلوگیری می کند و پتانسیل اتصال مایع و مایع مهار کرده یا آنرا به حداقل می رساند. پتانسیل بین دو محلول هنگامی ایجاد می شود که با یکدیگر در تماس باشند. پل نمکی به عنوان یک تماس الکتریکی بین دو نیم سلول عمل می کند. لازم به ذکر است که در سیستم های بیولوژیکی و بدن موجودات زنده پل نمکی در پروتئین ها تشکیل می شود و حتی یک پل نمکی در هموگلوبین نیز موجود است.
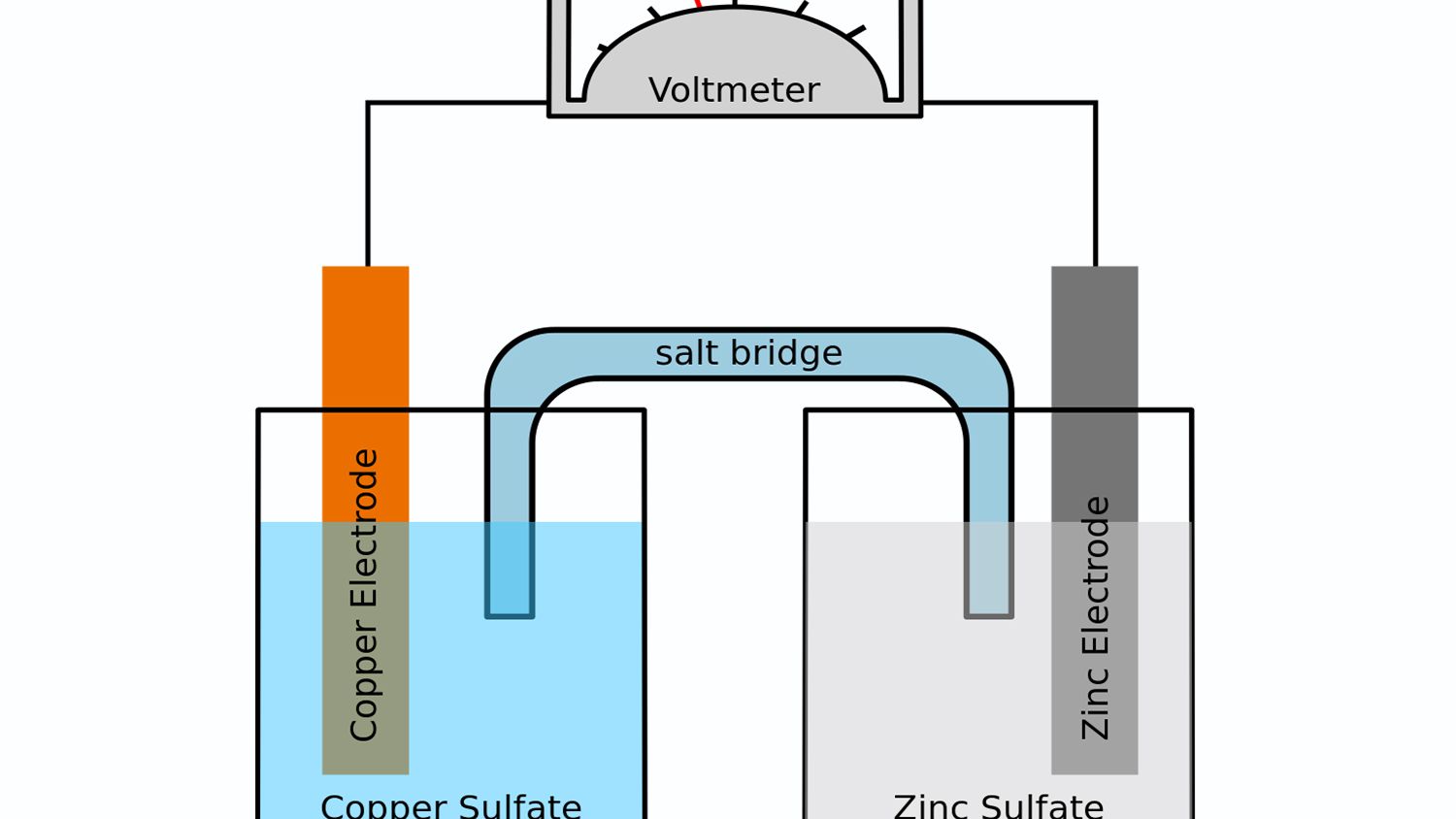
انواع پل نمکی
عمدتا دو نوع پل در سلول های الکتروشیمیایی وجود دارد که در ادامه شرح داده می شود:
پل نمکی شیشه ای
این پل ها لوله هایی به شکل U هستند که با الکترولیت پر شده اند. کلرید سدیم (NaCl) ، کلرید پتاسیم (KCl) ، نیترات پتاسیم (KNO3) به طورکلی به عنوان الکترولیت استفاده می شوند. الکترولیت باید با سایر مواد شیمیایی موجود در سلول نسبتاً غیرواکنشی باشد و حاوی کاتیون و آنیون با سرعت مهاجرتی مشابه (بار یونی و وزن مولکولی مشابه) باشد.
الکترولیت ها اغلب به صورت ژل هایی مانند آگار نگهداری می شوند. غلظت محلول نمک و قطر لوله شیشه ای نقش مهمی در رسانایی دارد. کاهش غلظت و قطر لوله ، رسانایی پل را کاهش می دهد.
پل نمکی کاغذی
این نوع از پل ها از کاغذ صافی یا مواد متخلخل آغشته به الکترولیت تشکیل شده اند که معمولاً از الکترولیت کلرید سدیم (NaCl) یا کلرید پتاسیم (KCl) استفاده می شود. غلظت الکترولیتی ، تخلخل و زبری کاغذ صافی بر هدایت تأثیر می گذارد. برای رسانایی بالاتر از یک کاغذ صافی نرم با جاذبه بالا استفاده می شود ، آنها رسانایی بالاتری نسبت به کاغذ صافی زبر با جاذبه کم دارند.
همانطور که در بالا گفته شد عملکرد اصلی یک پل نمکی حفظ خنثی بودن الکتریکی بین دو ظرف الکترولیت است. برای این کار نمک مورد استفاده باید خنثی باشد و یون ها باید بین دو نیم سلول جابجا شوند. برخلاف سایر نمک ها ، کلرید پتاسیم (KCl) و نیترات پتاسیم (KNO3) نمکهای بی اثر بهتری هستند.
از نمک های خنثی برای جلوگیری از بروز واکنش بین نمک و محلول استفاده می شود. نمک خنثی کلرید پتاسیم (KCl) نمکی است که معمولاً مورد استفاده قرار می گیرد زیرا یون های پتاسیم و کلرید دارای ضریب انتشار بسیار معمولی هستند و پتانسیل اتصال را به حداقل می رسانند ، اما از کلرید پتاسیم هنگام استفاده از سرب یا نقره به عنوان الکترولیت استفاده نمی شود.
طرز تهیه پل نمکی
برای آماده سازی پل نمکی نیازمند نخ ، پنبه یا مواد کاغذی هستیم که در محلول الکترولیت خیس شوند. برای تهیه پل ، مواد را به اندازه کافی تهیه کنید که حداقل به دو لیوان برسد. این مواد را در مخزن الکترولیت قرار دهید تا زمانی که از محلول اشباع شوند. با دقت مواد را از محلول الکترولیتی خارج کرده و مقدار اضافی الکترولیت را از آنها خارج کنید.
آماده سازی ژل برای عملکرد به عنوان پل
ژل را در محلول الکترولیتی به حالت سوسپانسیون درآورده و آنرا با محلول بافر تیمار کرده و بعداً حرارت دهید. سپس این ژل چسبناک را روی صفحه یا داخل لوله شیشه ای قرار دهید تا سفت شود و از آن به عنوان پل نمکی استفاده کنید.
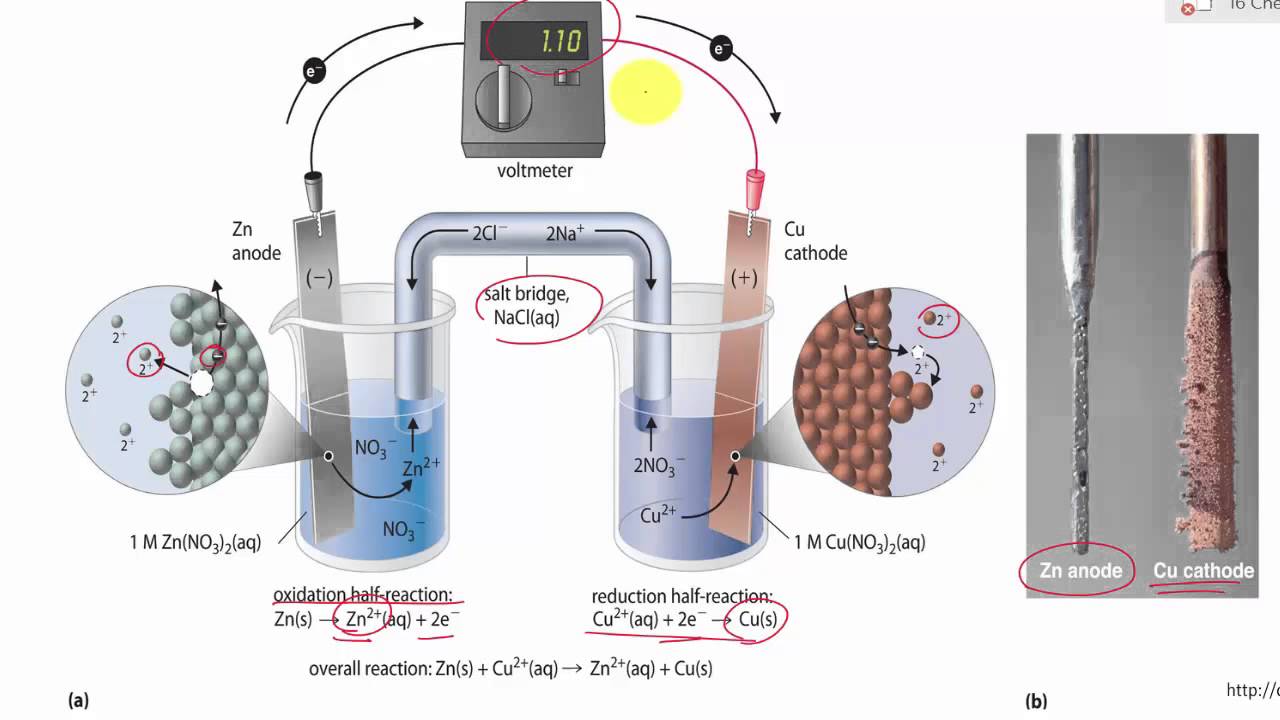
پل نمکی چگونه کار می کند؟
اکسیداسیونی که در آند اتفاق می افتد ، الکترون و یون های مثبت تولید می کنند. اکنون الکترون ها از طریق سیم جریان می یابند و بار مثبت نامتعادلی را در ظرف ایجاد می کنند. به منظور حفظ خنثی بودن الکتریکی ، یون با بار منفی (NO3–) به سمت ظرف با بار مثبت (نیم سلول آندی) حرکت می کند.
وضعیت مشابهی در سلول کاتد ایجاد می شود اما برعکس این حالت است. در اینجا یون های + Cu2 مصرف می شوند. بنابراین برای حفظ خنثی بودن الکتریکی ، یونهای K + از پل نمکی به داخل این نیم سلول منتقل می شوند. از این رو خنثی بودن الکتریکی محلول با استفاده از این پل حفظ می شود.
کاربرد پل نمکی در الکترولیز
مانند سلول های الکتروشیمیایی ، پل های نمکی نیز در سلول های الکترولیتی عملکرد مشابهی دارند. اگر دو الکترود را در یک محلول و در یک ظرف غوطه ور کنیم ، هیچ پل نمکی لازم نیست ، اما اگر هر الکترود را در یک محلول متفاوت و در ظرف های جداگانه قرار دهیم برای تکمیل مدار به یک پل نیاز داریم که حاوی یونهای متحرک است که به عنوان حامل بار عمل می کنند.
اگر از پل نمکی در سلول گالوانی استفاده نشود چه اتفاقی می افتد؟
سلول گالوانی به سلولی گفته می شود که در اثر واکنش اکسایش – کاهش برق تولید می کند. پل نمکی نقش مهمی در یک سلول گالوانیک دارد. بگذارید ببینیم اگر پل نمکی در سلول گالوانی وجود نداشته باشد ، چه اتفاقی می افتد.
قبل از اتصال سیم ها ، محلول در هر دو ظرف خنثی است. بنابراین تعداد بارهای مثبت و منفی آنها برابر است. تیغه روی (آند مورد استفاده در یک سلول گالوانیک) ۲ الکترون را از دست می دهد و الکترون ها از طریق سیم به تیغه مس (کاتدی که در سلول گالوانیک استفاده می شود) جریان می یابد.
از آنجا که روی الکترون از دست می دهد ، محلول بار مثبت به دست می آورد. تیغه مس (کاتد) دو الکترون گرفته که باعث می شود یک یون مثبت مس (Cu+ ۲) محلول را ترک کند و دو الکترون را بپذیرد. وقتی این اتفاق می افتد ، یک اتم مس روی تیغه مس رسوب می کند. از این رو محلول بار منفی بدست می آورد.
اکنون دو ولتاژ وجود دارد ، یکی بین الکترودها (تیغه فلزی) و دیگری بین محلول های باردار است. ولتاژ بین تیغه فلزی یا الکترود مثبت است و ولتاژ بین محلول باردار منفی است. بنابراین این ولتاژها از بین می روند و هیچ جریانی تولید نمی شود. این امر اهمیت پل های نمکی را در سلول الکتروشیمیایی یا الکترولیز اثبات می کند.



















