از اسید های چند ظرفیتی، واکنش ها و ثابت های تفکیک آن ها چه می دانیم؟
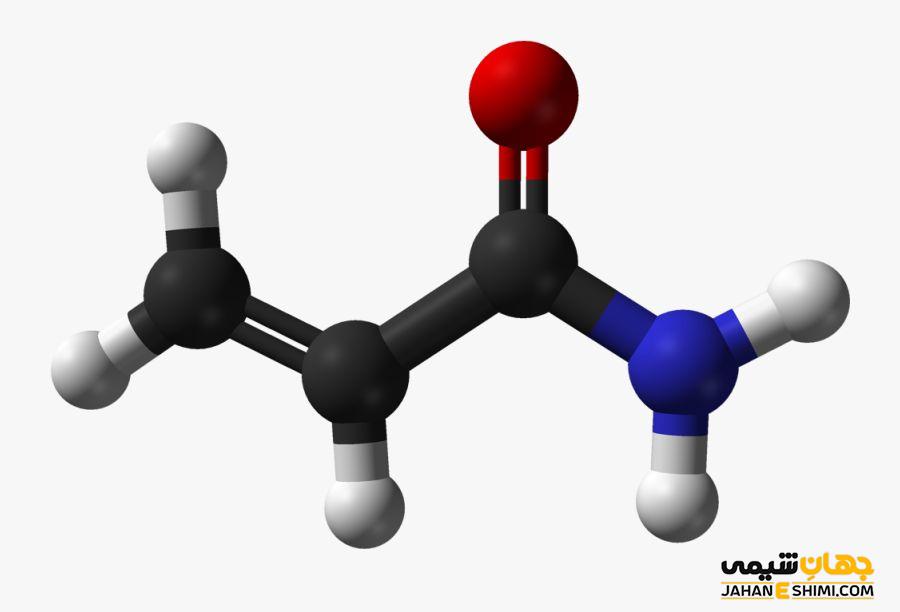
اسید های چند ظرفیتی به اسید هایی گفته می شود که دارای بیش از یک هیدروژن اسیدی بوده و به طور متوالی تفکیک می شوند. به این ترتیب، دارای چند واکنش و ثابت تفکیک هستند. این در حالی است که اسیدهای تک ظرفیتی یا تک پروتونی تنها یک واکنش تکفکیک و یک ثابت تفکیک اسید دارند.
در این مقاله از نشریه علمی جهان شیمی به بررسی انواع اسید های چند ظرفیتی، قدرت، ثابت تفکیک، کاربرد و … می پردازیم.
تعریف اسید
اسید (Acid) به آن دسته از ترکیبات گفته می شود که pH آن در محدوده بین ۰ تا ۷ است. بر اساس تعریفی ساده تر، اسید مولکولی است دارای یون مثبت هیدروژن است. این ترکیب قادر به از دست دادن یک پروتون یا H+ و تشکیل پیوند کووالانسی با یک جفت الکترون است.
اسید با غلظت بالا، به این معنی است که یون های هیدروژن مثبت بیشتری داشته و خاصیت خورندگی دارد. از اسید ها به منظور تغییر رنگ شناساگرها و خنثی کردن بازها نیز استفاده می شود.
تعاریف علمی متعدد برای اسید
اسید لی بیگ
بر اساس تعریف لی بیگ، اسید ماده ای است که در ساختار خود یک یا چند هیدروژن داشته و در واکنش با فلزها توسط یون های فلز جایگزین می شود.
اسید برونستد (Bronsted acids)
بنا بر تعریف اسید برونستد، به ترکیباتی که پروتون یا H+ از دست می دهند اسید گفته می شود.
اسید لوئیس (Lewis acids)
بر اساس نظریه لوئیس، اسیدها ترکیبات پذیرنده پیوند داتیو هستند و می توانند یک جفت الکترون بپذیرند.
اسید آرنیوس
بنا بر نظریه آرنیوس، اسید به ترکیبی گفته می شود که پروتون خود را در آب از دست داده و به یون هیدرونیوم تبدیل می شود.
انواع اسید بر اساس تعداد هیدروژن

تعداد هیدروژن های موجود در اسیدها، نشان دهنده ی تعداد پروتون هایی است که آن اسید می تواند آزاد کند. اگر ترکیب دارای یک هیدروژن اسیدی باشد، اسید تک پروتونی نامیده می شود. چنانچه بیش از یک هیدروژن داشته باشد که به طور متوالی تفکیک شوند، اسید چند پروتونی نامیده می شود.
نکته
نام گذاری اسیدها به گونه ای است که بر اساس نام آنیون یا نافلزهایشان نام گذاری می شوند.
انواع اسید بر اساس قدرت
اسیدها براساس پروتون ها به دو دسته اسید قوی و اسید ضعیف تقسیم بندی می شوند. قدرت یک اسید بر اساس ثابت تفکیک اسیدی آن مشخص می شود.
اسید قوی چیست
اسید قوی، اسیدی است که وقتی در حلال حل شود، پروتون های خود را به طور کامل به حلال دهد. به بیانی ساده تر، به طور کامل تفکیک شود. به این تریب در واکنش تعادلی، اسید قوی تعادل را به سمت راست پیش می برد.
اسید قوی دارای Ka بزرگ یا ثابت تفکیک اسید بالایی است. منظور از تعادل اسيد و باز تنظيم غلظت يون هيدروژن است.
اسیدهای قوی به طور کامل در آب یونش یافته و یون هیدرونیوم (H۳O+) تولید می کنند.
از جمله اسید های قوی می توان به هیدروبرمیک اسید، هیدروکلریک اسید، هیدرویدیک اسید، نیتریک اسید، سولفوریک اسید، پرکلریک اسید، اسید کلریک و … اشاره کرد.
اسید ضعیف چیست
اسیدی که وقتی در حلال حل می شود، پروتون های خود را به طور کامل به حلال نداده و به طور کامل تفکیک نشود، اسید ضعیف گفته می شود.این اسید ها به طور جزئی واکنش می دهند.
می توان گفت همه اسیدهای آلی، اسید ضعیف هستند. زیرا، ثابت تفکیک این اسیدها کم و Ka کوچکی دارند. از اسیدهای ضعیف معدنی می توان بوریک اسید، کربونیک اسید، هیدروفلوریک اسید، فسفریک اسید، هیدروسولفوریک اسید، فسفرو اسید، هیدروسیانیک اسید، هیپوفسفورواسید و … را نام برد.
از اسیدهای ضعیف آلی نیز می توان به استیک اسید، بنزوئیک اسید، بوتیریک اسید، سیتریک اسید، فرمیک اسید، لاکتیک اسید، مالئیک اسید، اگزالیک اسید، پروپانوئیک اسید، پیروویک اسید، والریک اسید و … اشاره کرد.
اسیدهای چند ظرفیتی (چند پروتونی)
اسیدهای چند ظرفیتی یا چند پروتونی، ترکیبهایی هستند که دارای بیش از یک هیدروژن اسیدی بوده و به طور متوالی تفکیک می شوند. در مقابل، اسیدهای تک ظرفیتی یا تک پروتونی تنها یک واکنش تکفکیک و یک ثابت تفکیک اسید دارند.
HA(aq) + H۲O(l) ⇌ H۳O+(aq) + A−(aq) Ka
اسید دو ظرفیتی
یک اسید دو ظرفیتی که در این جا آن را با H۲A نشان می دهیم، بسته به مقدار pH می تواند شامل یک یا دو واکنش تکفکیک باشد. هر واکنش یک ثابت تفکیک اسید دارد که با نماد های Ka1 و Ka2 نشان داده می شوند.
H۲A(aq) + H۲O(l) ⇌ H۳O+(aq) + HA−(aq) Ka1
HA−(aq) + H۲O(l) ⇌ H۳O+(aq) + A۲−(aq) Ka2
ثابت تفکیک واکنش اول همواره از واکنش دوم بیشتر است. به این معنی که Ka1> Ka2 است. برای مثال، سولفوریک اسید H۲SO۴ می تواند یک پروتون داده و به آنیون بی سولفات،HSO۴– تبدیل شود.
اگرKa1 بسیاز بزرگ باشد، در این صورت می تواند دومین پروتون خود را از دست داده و به آنیون سولفات،SO۴۲- تبدیل شود. آنیون سولفات هم مقدار متوسطی دارد. مقدار بزرگ Ka1 در اولین تفکیک سبب می شود که سولفوریک اسید، اسیدی قوی باشد.
به همین روش، مقدار کوچک کربنیک اسید نیز می تواند اولین پروتون را از دست داده و به آنیون بیکربنات تبدیل شود. در ادامه با از دست دادن دومین پروتون، به کربنات تبدیل می شود. هر دو مقدارKa کوچک هستند اما رابطه یKa1> Ka2 بر قرار است.
اسید سه ظرفیتی
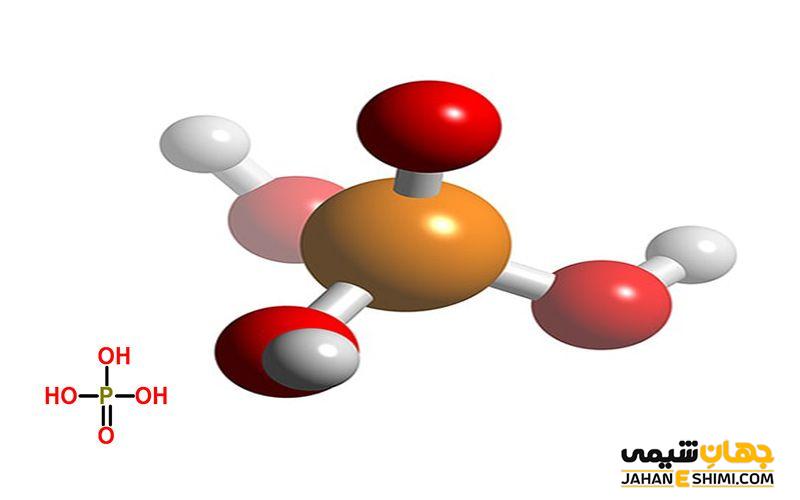
یک اسید سه ظرفیتی که در این جا به صورت H3A نشان داده می شود، می تواند یک، دو یا سه پروتون از دست بدهد. از این رو، سه مقدار ثابت تفکیک برای آن وجود داشته و رابطه ی Ka1> Ka2> Ka3 برقرار است.
H۳A(aq) + H۲O(l) ⇌ H۳O+(aq) + H۲A−(aq) Ka1
H۲A−(aq) + H۲O(l) ⇌ H۳O+(aq) + HA۲−(aq) Ka2
HA۲−(aq) + H۲O(l) ⇌ H۳O+(aq) + A۳−(aq) Ka3
فسفریک اسید یک مثال غیر آلی از اسید های سه ظرفیتی است. تمام پروتون ها می توانند از اسید جدا شده و به H۲PO۴−، سپس HPO۴۲− و در آخر به PO۴۳− تبدیل شود. یک مثال آلی از اسید سه ظرفیتی اسید سیتریک است که می تواند تمام پروتون های خود را از دست داده و در انتها به یون سیترات تبدیل شود.
اسید های چند ظرفیتی قوی
اسید سولفوریک یک اسید دو ظرفیتی قوی است. با این وجود، از اسیدهای چند ظرفیتی شناخته شده ای نیست که همه یونش های آن قوی باشد. تفکیک یا یونیزاسیون اول اسید سولفوریک کامل است. این در حالی است که یونیزاسیون دوم آن ضعیف است.
اسیدهای چند ظرفیتی حاصل از انحلال گاز مربوطه در آب
محلول های دی اکسید کربن به صورت اسیدی هستند. دی اکسید کربن با آب ترکیب شده و اسید کربنیک (H۲CO۳) تولید می کند. این واکنش کامل نبوده و قسمت عمده دی اکسید کربن در محلول، به صورت مولکول های CO۲ وجود دارد. البته وضعیت مشابهی هم برای محلول های SO۲ در آب وجود دارد.
قدرت اسیدی SO۲ به یونیزاسیون H۲SO۳ بستگی دارد. خود این اسید هرگز به صورت خالص تفکیک نمی شود. ظاهرا این اسید در محلول با SO۲ (aq) در تعادل است.
مراحل تفکیک اسید های چند ظرفیتی چگونه است
همان طور که پیش از این نیز به آن اشاره شد، اسیدهای چند ظرفیتی در مولکول خود بیش از یک هیدروژن اسیدی دارند. از آن جمله می توان به اسید فسفریک، اسید سولفوریک، اسید اگزامیک و … اشاره کرد.
اسیدهای چند ظرفیتی به صورت مرحله ای تفکیک یا یونیزه می شوند. به عنوان مثال، تفکیک اسید فسفریک که یک اسید سه ظرفیتی است را در آب در نظر بگیرید. در محلول اسید فسفریک سه تعادل همراه با آب وجود دارند. در این محلول، گونه های H۳PO۴ ،H۲PO۴– ،H۲PO۴۲- ،PO۴۳- ، H+،OH– و H۲O وجود دارند.
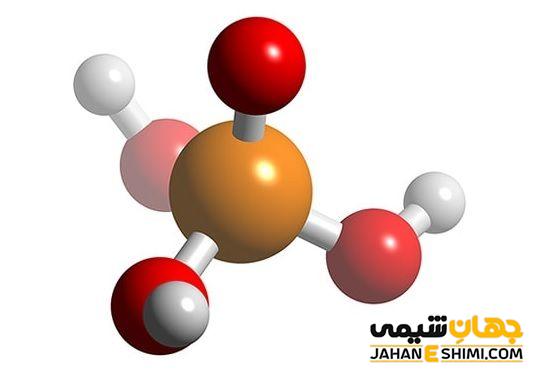
یونش اسید فسفریک شاخص اسیدهای چند ظرفیتی است. در این گونه اسیدها K۱ بیشتر از K۲ و K۲ هم بیشتر از K۳ است. به این صورت که، آزاد شدن پروتون از یک مولکول بدون بار در مقایسه با یک یون با یک بار منفی آسان تر صورت می گیرد. این عمل در یک یون با یک بار منفی، آسان تر از یک یون با دو بار منفی است.
نمک اسید های چند ظرفیتی
اسید های چند ظرفیتی بیش از یک نمک تشکیل می دهند. در واکنش NaOH و H۲SO۴ با توجه به نسبت استوکیومتری واکنش دهنده ها، نمک Na۲SO۴ یا نمک NaHSO۴ تشکیل می شود. از اسید فسفریک سه نوع نمک Na۲HPO۴،Na۲HPO۴ و Na۳PO۴ به دست می آید.
اسیدها چه کاربرد هایی دارند
انواع اسید در بدن انسان
این ترکیبات نقش بسیار مهمی در بدن ایفا می کنند. به عنوان مثال، کلریدریک اسید با تجزیه مولکول های غذایی بزرگ و حجیم در معده، به هضم غذا در بدن کمک می کند.
اسیدهای آمینه برای رشد و ترمیم بافت های بدن و جهت سنتز پروتئین های مورد نیاز، بسیار ضروری هستند. اسیدهای چرب نیز برای رشد و ترمیم بافت های بدن بسیار ضروری هستند.
اسیدها در مواد غذایی
سیتریک اسید در مرکبات مانند پرتقال و لیمو وجود دارد. اسفناج، گوجه فرنگی و به خصوص ریواس و کارامبولا دارای اگزالیک اسید هستند. اسکوربیک اسید که نوعی ویتامین c است به عنوان یکی از ضروری ترین ویتامین ها برای بدن انسان شناخته می شود که در غذاهایی نظیر لیمو، مرکبات، آملا (انگور فرنگی هندی) و گواوا وجود دارد.
انواع اسیدها در صنعت
تقریبا در همه فرآیندهای صنعتی امروز، اسید ها از واکنش دهنده های اصلی و اساسی هستند. سولفوریک اسید که یک اسید دیپروتیک است در اغلب تولیدات مواد شیمیایی در صنعت دخالت داشته و پرکاربردترین اسید در صنعت به شمار می رود. بر اساس داده های موجود در سال ۲۰۱۱، مقدار مصرف سولفوریک اسید ۲۰۰ میلیون تن در سال بوده است.

برای نمونه مواد معدنی فسفات با سولفوریک اسید جهت تولید کودهای فسفاته واکنش داده و فسفریک اسید را تولید می نماید؛ و تصفیه محلول با حل شدن اکسید روی در این ترکیب انجام می گیرد. لازم به ذکر است که اسیدها وارد واکنش در ترکیبات و واکنش های خنثی سازی شده و باعث تولید نمک می شوند.
دیگر کاربرد های اسید ها در صنعت
- اغلب از اسیدها به منظور حذف زنگ زدگی و جلوگیری از خوردگی فلزات استفاده می شود که در واقع به عنوان لعاب عمل می کند.
- به عنوان الکترولیت در سلول مرطوب باتری مانند اسید سولفوریک در باتری خودرو، مورد استفاده قرار می گیرند.
- در صنایع شیمیایی، برای واکنش های خنثی سازی کاربرد فراوانی دارند.
- برای تولید نمک در واکنش های شیمیایی مورد استفاده قرار می گیرند.
- در صنایع غذایی به عنوان مکمل برای نوشیدنی ها و غذاها کاربرد دارند.
- به عنوان نگهدارنده در محصولات آرایشی و غذایی به کار می روند.
- به عنوان کاتالیزورهای شیمیایی صنعتی و ارگانیک مورد استفاده قرار می گیرند. به عنوان مثال، اسید سولفوریک در تولیدات بنزین، در مقادیر بسیار زیاد در فرایند آلکالایی استفاده می شود.
- در بیوشیمی از اسیدها به عنوان کاتالیزور برای آنزیم ها استفاده می شود.



















