آشنایی با اسرار شگفت انگیز جدول تناوبی عناصر شیمیایی
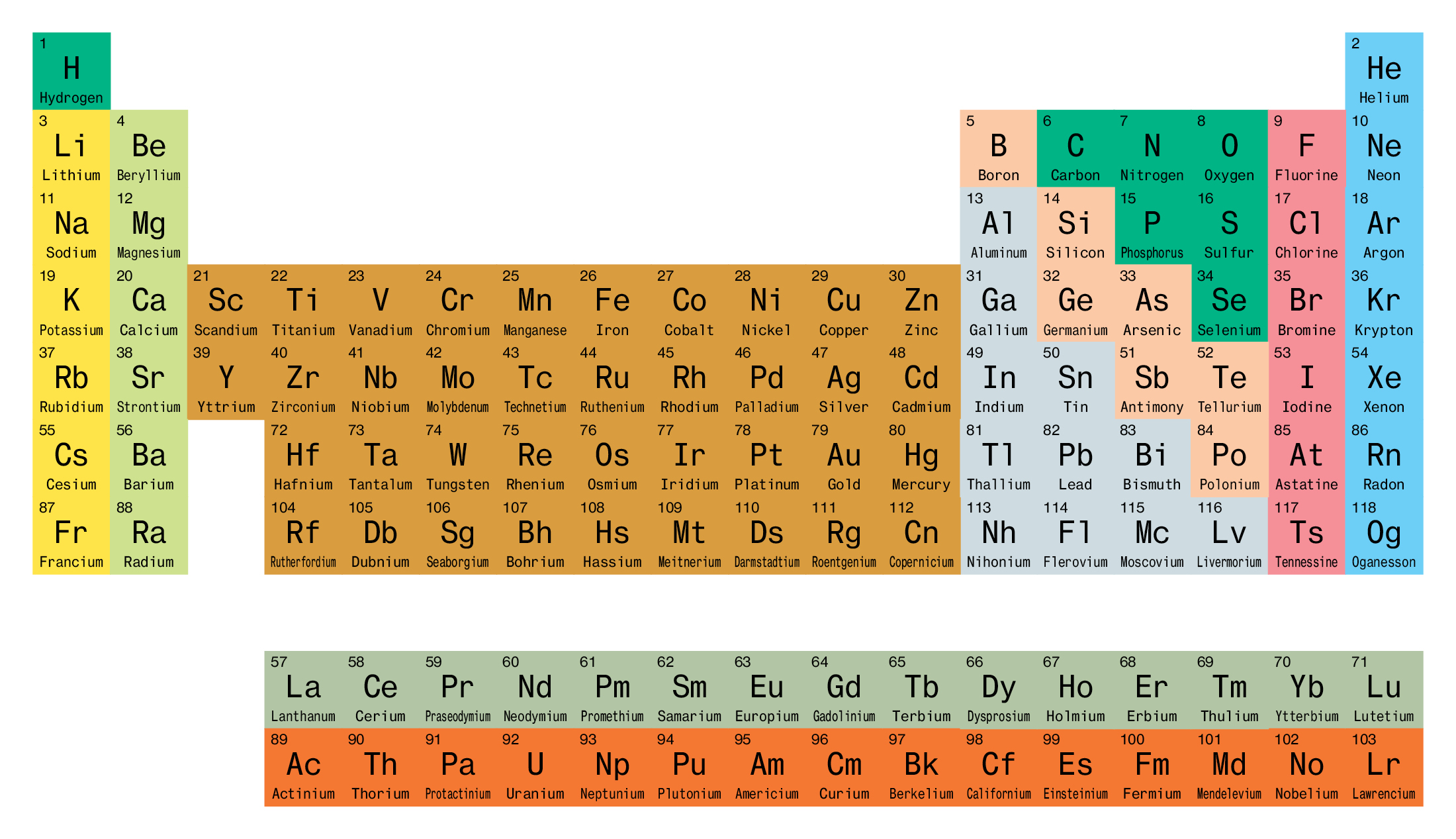
جدول تناوبی عناصر شیمیایی آرایشی سازمان یافته از همه عناصر شیمیایی به ترتیب افزایش عدد اتمی است. هنگامی که عناصر شیمیایی به این ترتیب مرتب می شوند یک الگوی تکرار شونده به نام “قانون دوره ای” در خصوصیات آنها وجود دارد ، که در آن عناصر یک ستون (گروه) دارای خواص مشابه هستند.
خالق جدول تناوبی ، دیمیتری مندلیف ، در سال ۱۸۶۹ ، هنگام سفر با قطار ، شروع به جمع آوری و مرتب سازی خصوصیات شناخته شده عناصر کرد. او متوجه شد که گروه هایی از عناصر هستند که خصوصیات مشابهی را به نمایش می گذارند ، اما همچنین متوجه شد که استثناهای زیادی در مورد الگوهای در حال ظهور وجود دارد.
وی همچنین پیش بینی کرد که عناصر خاصی باید وجود داشته باشند که بتوانند این الگوها را تکرار کنند و پس از او خانه های خالی موجود در جدول مندلیف به تدریج پر و درنهایت کامل شدند. در ادامه مقاله در نشریه جهان شیمی فیزیک توضیحات بیشتری در رابطه با این جدول مهم ارائه می شود لطفا ما را همراهی کنید.
روش خواندن جدول تناوبی
این جدول تا به امروز مهمترین مرجع شیمی است که همه عناصر شناخته شده در آن مرتب شده است. عناصر در این جدول به ترتیب افزایش عدد اتمی از چپ به راست و بالا به پایین مرتب شده اند. این نظم با افزایش جرم اتمی نیز همراه است.
به ردیف های مختلف عناصر ، پریود یا دوره گفته می شود. تعداد دوره یک عنصر نشان دهنده بالاترین سطح انرژی الکترون در آن عنصر است (در حالت تحریک نشده). در این جدول گروه های مختلفی نیز وجود دارد که با ویژگیهای شیمیایی مشابه کنار هم قرار گرفته اند.
حقایقی در رابطه با جدول تناوبی
جدول مندلیف حاوی اطلاعات حائز اهمیت بسیاری است که در ادامه شرح داده شده است:
عدد اتمی
به تعداد پروتون های یک اتم عدد اتمی آن عنصر گفته می شود. تعداد پروتون ها نوع عنصر و همچنین رفتار شیمیایی آن را تعیین می کند. به عنوان مثال ، اتمهای کربن دارای شش پروتون ، اتمهای هیدروژن یک و اتم های اکسیژن دارای هشت پروتون هستند.
نماد اتمی
نماد اتمی علامتی انتخاب شده برای نشان دادن یک عنصر است ( مثلا C برای کربن ، H برای هیدروژن و O برای اکسیژن و غیره). این نمادها در سطح بین المللی مورد استفاده قرار می گیرند و گاهی غیر منتظره هستند. به عنوان مثال ، نماد تنگستن “W” است زیرا نام دیگر آن عنصر wolfram است. همچنین ، نماد اتمی برای طلا “Au” می باشد زیرا کلمه طلا در لاتین aurum است.
وزن اتمی
وزن اتمی استاندارد یک عنصر ، میانگین جرم عنصر براساس واحد جرم اتمی است. اتمهای منفرد همیشه تعداد صحیحی از واحدهای جرم اتمی را دارا می باشند. با این حال ، جرم اتمی در جدول تناوبی به عنوان یک عدد اعشاری بیان می شود زیرا میانگینی از ایزوتوپ های مختلف یک عنصر است. علاوه بر این با کم کردن تعداد پروتون ها (عدد اتمی) از جرم اتمی ، می توان تعداد متوسط نوترون های یک عنصر را بدست آورد.
وزن اتمی برای عناصر ۹۳-۱۱۸
برای عناصر طبیعی ، وزن اتمی از میانگین وزنی فراوانی طبیعی ایزوتوپهای آن عنصر محاسبه می شود. با این حال ، برای عناصر ترانس اورانیوم آزمایشگاهی – عناصر با تعداد اتمی بالاتر از ۹۲ – فراوانی طبیعی وجود ندارد و بر اساس قرارداد باید وزن اتمی ایزوتوپی که نیمه عمر طولانی تری دارد در جدول تناوبی نوشته شود. این اوزان اتمی باید موقت در نظر گرفته شوند زیرا در آینده می توان ایزوتوپ جدیدی با نیمه عمر طولانی تر تولید کرد.
در این گروه عناصر ابر سنگین یا عناصر با عدد اتمی بالاتر از ۱۰۴ قرار دارند. هرچه هسته اتم بزرگتر باشد – که با افزایش تعداد پروتون ها در داخل افزایش می یابد – این عناصر ناپایدارتر خواهند شد. به گفته اتحادیه بین المللی شیمی محض و کاربردی (IUPAC) این عناصر بزرگ بسیار ناپایدار هستند و فقط قبل از تجزیه به عناصر سبک تر ، در حد میلی ثانیه وجود دارند. به عنوان مثال ، عناصر ابر سنگین ۱۱۳ ، ۱۱۵ ، ۱۱۷ و ۱۱۸ توسط IUPAC در دسامبر ۲۰۱۵ تأیید شدند و ردیف هفتم یا دوره جدول را تکمیل کردند. اعداد اتمی ، نام های موقت و نام های رسمی آنها عبارتند از:
- ۱۱۳: (ununtrium (Uut), nihonium (Nh
- ۱۱۵: (ununpentium (Uup), moscovium (Mc
- ۱۱۷: (ununseptium (Uus), tennessine (Ts
- ۱۱۸: (ununoctium (Uuo), oganesson (Og
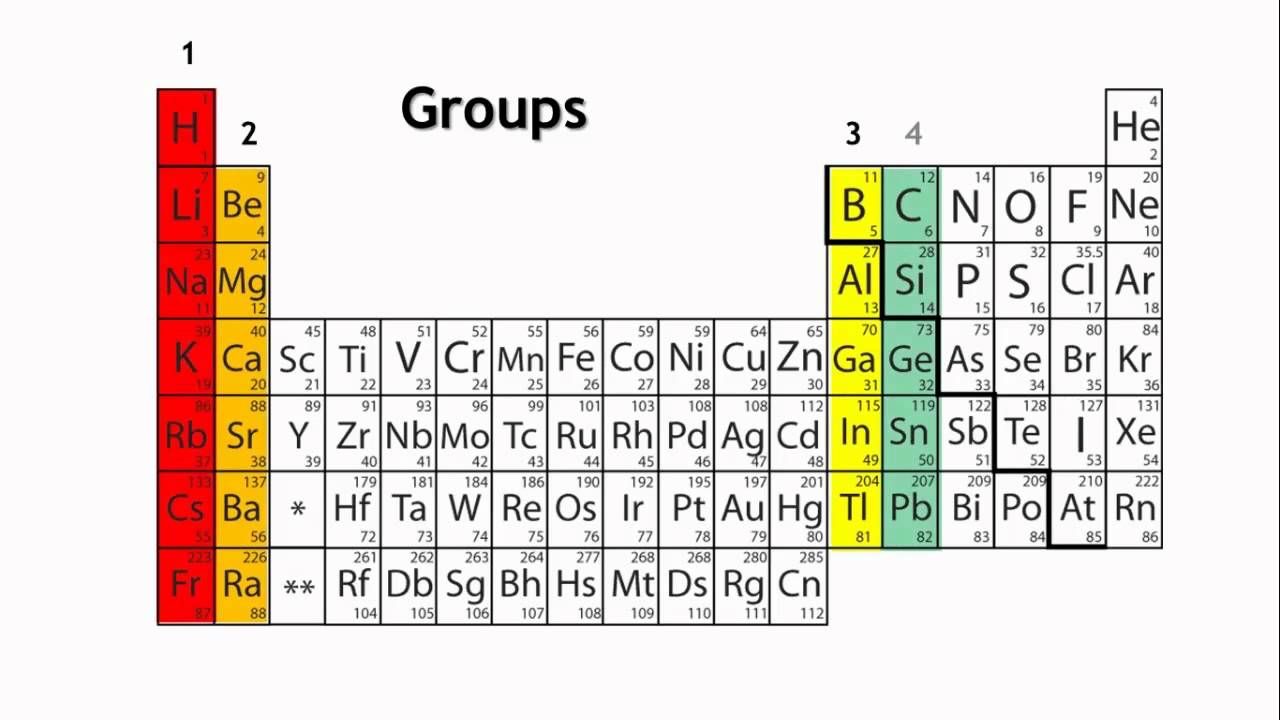
تعریف گروه و دوره در جدول تناوبی یا مندلیف
دوره ، یک ردیف افقی از جدول تناوبی است. در جدول تناوبی هفت دوره وجود دارد که هر کدام از انتهای سمت چپ شروع می شوند. یک دوره جدید زمانی شروع می شود که سطح اصلی انرژی جدید با الکترون پر می شود. دوره ۱ فقط دو عنصر دارد (هیدروژن و هلیوم) ، در حالی که دوره های ۲ و ۳ دارای ۸ عنصر هستند. دوره های ۴ و ۵ دارای ۱۸ عنصر هستند. دوره های ۶ و ۷ دارای ۳۲ عنصر هستند زیرا دو ردیف پایین که از بقیه جدول جدا شده مربوط به آن دوره ها است. آنها بیرون کشیده می شوند تا جدول در یک صفحه قرار گیرد.
گروه ، یک ستون عمودی از جدول تناوبی است که بر اساس ساختار الکترون های لایه بیرونی بنا شده است. در مجموع ۱۸ گروه در جدول مندلیف وجود دارد. دو سیستم شماره گذاری مختلف برای این گروه ها وجود دارد که معمولاً برای تعیین گروه ها استفاده می شود و باید با هر دو آشنا باشید.
سیستم سنتی مورد استفاده شامل استفاده از حروف A و B است. دو گروه اول ۱A و ۲A هستند ، در حالی که شش گروه آخر ۳A تا ۸A هستند. گروه های میانی از B در عناوین خود استفاده می کنند. متأسفانه در اروپا سیستم متفاوتی برای گروه های جدول تناوبی وجود داشت. بنابراین اتحادیه بین المللی شیمی محض و کاربردی (IUPAC) برای از بین بردن این سردرگمی ها تصمیم گرفت که سیستم رسمی شماره گذاری گروه ها از چپ به راست۱ تا ۱۸ ساده باشد. بسیاری از جداول تناوبی هر دو سیستم را به طور همزمان نشان می دهند.
چگونه عناصر در جدول تناوبی گروه بندی می شوند؟
همانطور که گفتیم جدول تناوبی دارای ۷ ردیف و ۱۸ ستون است. ستون های جدول مندلیف عناصر گروه ها یا خانواده ها را نشان می دهد. عناصر موجود در یک گروه معمولاً رفتار مشابهی دارند زیرا در خارجی ترین پوسته خود تعداد الکترون یکسانی دارند. به عنوان مثال ، عناصر گروه ۱۸ ، در سمت راست انتهای جدول لایه ظرفیت کاملا پری دارند و بندرت در واکنش های شیمیایی شرکت می کنند.
عناصر معمولاً به عنوان فلز یا غیر فلز طبقه بندی می شوند ، اما خط تقسیم فلزات و نافلزات جدول تناوبی مبهم است. عناصر فلزی معمولاً رساناهای خوبی برای برق و گرما هستند. زیر گروه های موجود در فلزات بر اساس خصوصیات مشابه و خصوصیات شیمیایی این مجموعه ها ساخته شده اند. هشت گروه اصلی جدول تناوبی در ادامه شرح داده شده است.
گروه های جدول تناوبی
فلزات قلیایی
فلزات قلیایی گروه ۱ ستون اول جدول مندلیف را تشکیل می دهند. این فلزات با لیتیوم (Li) شروع می شوند و با فرانسیوم (Fr) پایان می یابند. آنها براق ، چکش خوار و بسیار واکنش پذیر هستند و در اثر تماس با آب شعله ور یا حتی منفجر می شوند ، بنابراین شیمی دانان آنها را در روغن ها یا گازهای بی اثر نگهداری می کنند. هیدروژن با تک الکترون خود نیز عضو گروه ۱ است اما این عنصر یک گاز است و فلز محسوب نمی شود.
فلزات قلیایی خاکی
فلزات قلیایی خاکی گروه ۲ جدول تناوبی را تشکیل می دهند ، از بریلیم (Be) تا رادیوم (Ra). هر یک از این عناصر دارای دو الکترون در بیرونی ترین سطح انرژی خود هستند که باعث می شود آنها به اندازه کافی واکنش پذیر باشند. این فلزات بندرت در طبیعت به صورت آزاد یافت می شوند. اما آنها به اندازه فلزات قلیایی واکنش پذیر نیستند. واکنش های شیمیایی آنها معمولاً با سرعت کمتری اتفاق می افتد و در مقایسه با فلزات قلیایی گرمای کمتری تولید می کنند.
لانتانیدها
گروه سوم خیلی طولانی است و در یک ستون سوم قرار نمی گیرد ، بنابراین شکسته می شود و به پهلو می چرخد تا تبدیل به ردیف بالایی دو دوره ای شود که در پایین جدول قرار دارند. لانتانیدها ، عناصر ۵۷ تا ۷۱ را شامل می شوند از لانتانیم (La) تا لوتتیوم . (Lu) عناصر موجود در این گروه رنگ سفید نقره ای دارند و در اثر تماس با هوا لکه دار می شوند.
اکتینیدها
اکتینیدها در ردیف پایین دو گروه پایینی جدول تناوبی قرار دارند و شامل عناصر ۸۹ ، آکتینیم (Ac) ، تا ۱۰۳ ، لارنسیوم (Lr) هستند. از این عناصر ، فقط توریم (Th) و اورانیوم (U) به طور طبیعی در زمین به مقدار قابل توجهی وجود دارند و همه رادیواکتیو هستند. اکتینیدها و لانتانیدها با هم گروهی را تشکیل می دهند به نام فلزات واسطه داخلی.
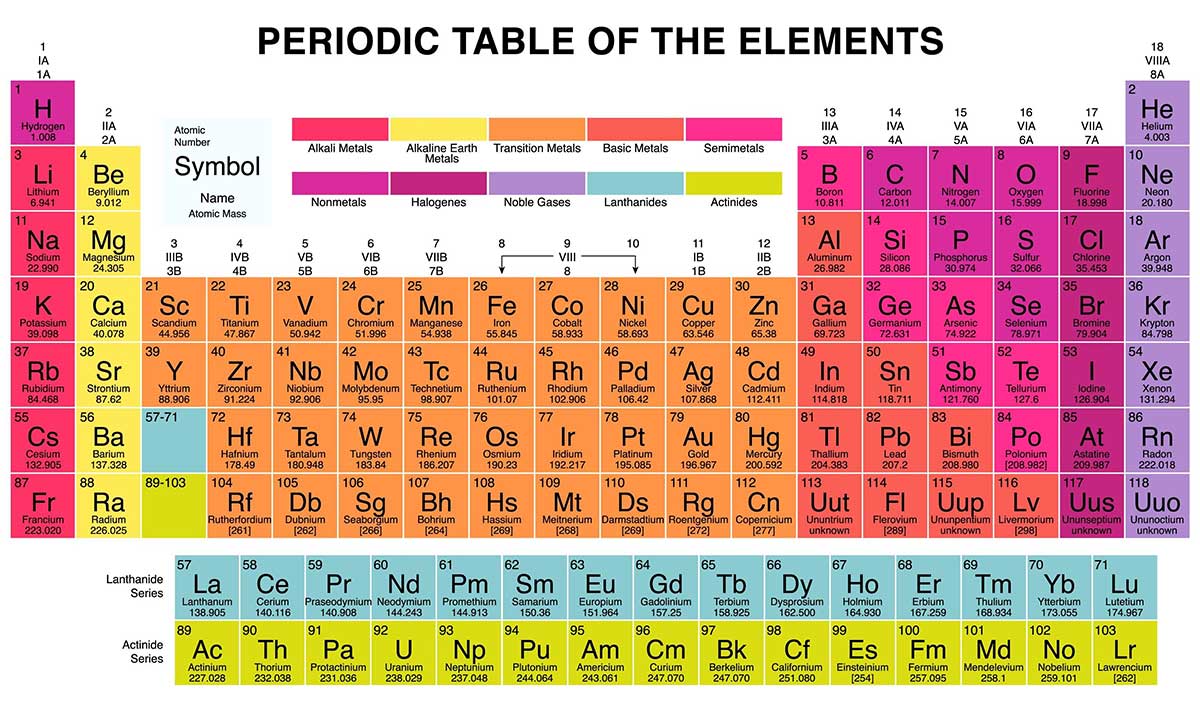
فلزات واسطه
با بازگشت به بدنه اصلی جدول ، بقیه گروه های ۳ تا ۱۲ نمایانگر بقیه فلزات واسطه هستند. این عناصر سخت اما انعطاف پذیر ، براق و دارای هدایت الکتریکی خوب هستند ، همان چیزی که شما معمولاً با شنیدن کلمه فلز به آن فکر می کنید. بسیاری از پرطرف دارترین فلزات دنیا – از جمله طلا ، نقره ، آهن و پلاتین – در این گروه قرار دارند.
فلزات پس واسطه
در آستانه جهش به دنیای غیر فلزات ، ویژگی های مشترک در امتداد خطوط عمودی گروه تقسیم نمی شوند. فلزات پس واسطه آلومینیوم (Al) ، گالیوم (Ga) ، ایندیوم (In) ، تالیوم (Tl) ، قلع (Sn) ، سرب (Pb) و بیسموت (Bi) هستند و گروه ۱۳ را به گروه ۱۷ وصل می کنند. این عناصر برخی از خصوصیات کلاسیک فلزات واسطه را دارند ، اما نرم تر هستند و عملکرد ضعیف تری نسبت به سایر فلزات واسطه دارند. در بسیاری از جدول های تناوبی یک خط “پلکانی” پررنگ در زیر بور قرار دارد که به شکل مورب آنرا به استاتین وصل می کند. فلزات پس واسطه در پایین سمت چپ این خط قرار دارد.
متالوئیدها
متالوئیدها شامل فلزها بور (B) ، سیلیسیم (Si) ، ژرمانیوم (Ge) ، آرسنیک (As) ، آنتیموان (Sb) ، تلوریم (Te) و پولونیوم (Po) هستند. آنها پله ای را تشکیل می دهند که انتقال تدریجی فلزات به غیر فلزات را نشان می دهد. این عناصر بعضی اوقات به عنوان هادی یا نیمه هادی رفتار می کنند. به متالوئیدها “شبه فلزات” یا “فلزات ضعیف” نیز گفته می شود.
غیر فلزات
هر چیز دیگری که در سمت راست بالای پلکان قرار دارد – به علاوه هیدروژن (H) که در گروه ۱ قرار دارد ، غیر فلز است. اینها شامل کربن (C) ، نیتروژن (N) ، فسفر (P) ، اکسیژن (O) ، گوگرد (S) و سلنیوم (Se) هستند.
هالوژن ها
چهار عنصر برتر گروه ۱۷ ، از فلوئور (F) تا آستاتین (At) ، نشان دهنده یكی از دو زیر مجموعه غیر فلزات است. هالوژن ها کاملاً از نظر شیمیایی واکنش پذیر هستند و تمایل دارند با فلزات قلیایی جفت شوند و انواع مختلف نمک را تولید کنند. به عنوان مثال نمک خوراکی آشپزخانه شما از پیوند بین سدیم که یک فلز قلیایی است و کلر که یک هالوژن است تشکیل می شود.
گازهای نجیب
گازهای نجیب گازهایی بی رنگ ، بی بو و تقریباً غیرفعالی هستند که در گروه ۱۸ قرار دارند. بسیاری از شیمی دانان انتظار دارند oganesson ، یکی از چهار عنصر تازه کشف شده نیز از این ویژگی ها برخوردار باشد. با این حال ، از آنجا که این عنصر دارای نیمه عمر میلی ثانیه است ، هیچ کس نتوانسته است آن را مستقیماً آزمایش کند. این گاز دوره هفتم جدول تناوبی را به پایان می رساند ، بنابراین اگر کسی موفق به کشف عنصر ۱۱۹ شود ، می تواند کار را برای شروع ردیف هشت در ستون فلز قلیایی شروع کند.
عکس جدول تناوبی دایره ای
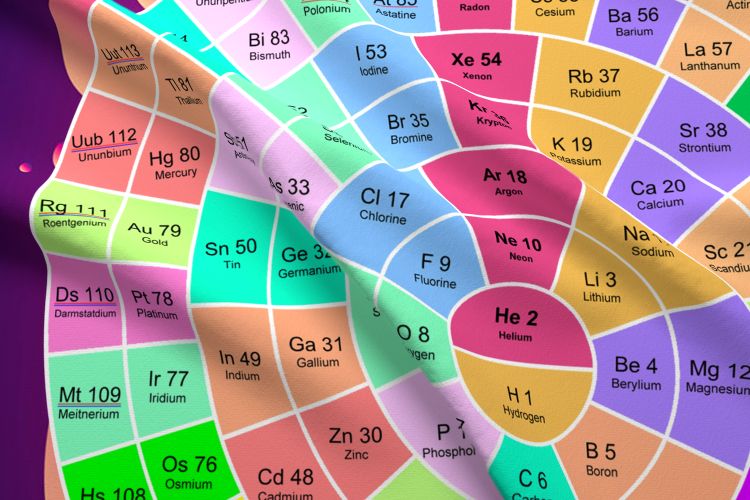
به دلیل ماهیت دوره ای ایجاد شده توسط عناصر به جدول مندلیف جدول تناوبی می گویند. برخی از شیمی دانان ترجیح می دهند جدول مندلیف را به صورت یک دایره تجسم کنند که در زیر نشان داده شده است.
اعتقاد بر این است که ترتیب قرارگیری عناصر به شکل دایره ای، درک بهتری از اندازه نسبی اتم ها ارائه می دهد زیرا اتم ها با نزدیک شدن به مرکز دایره ، شعاع اتمی کوچک تری خواهند داشت. همچنین با قرار گرفتن هلیوم و هیدروژن در مرکز این دایره مسئله جایگاه نامتعارف آنها در جدول مندلیف حل خواهد شد.