سلول الکترولیتی چیست و چه کاربردهایی دارد؟
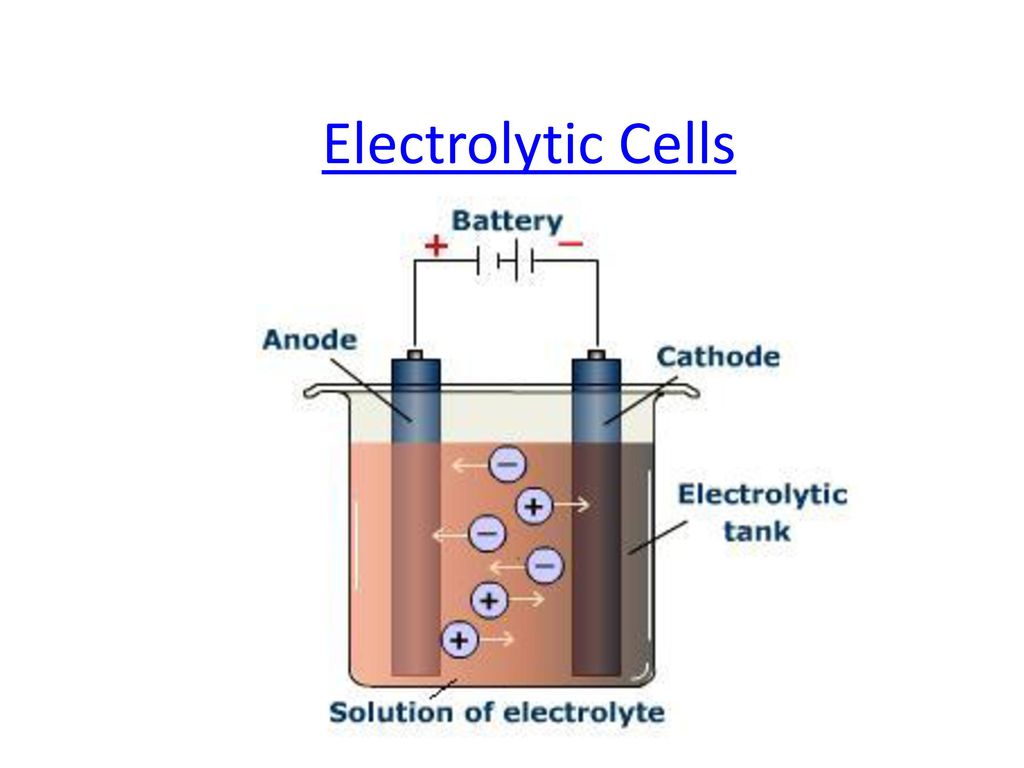
سلول الکترولیتی که پایه و اساس باتری های امروزی را تشکیل می دهد از دو الکترود تشکیل شده که در یک محلول قرار گرفته اند و انرژی الکتریکی را به انرژی شیمیایی تبدیل می کند. این سلول در فرآیندی موسوم به الکترولیز برای تجزیه ترکیبات شیمیایی مورد استفاده قرار می گیرد و فرآیند آبکاری نیز با استفاده از این سلول ها انجام می شود. سلول الکترولیتی در درس شیمی پایه دوازدهم شرح داده شده است و همه ما با عملکرد آن آشنا هستیم.
شایان ذکر است که یک سلول الکترولیتی از انرژی الکتریکی برای هدایت واکنش ردوکس غیر خود به خودی استفاده می کند و نوعی سلول الکتروشیمیایی است. برای کسب اطلاعات بیشتر در این زمینه با ما در نشریه جهان شیمی فیزیک همراه باشید.
شباهت و تفاوت سلول الکترولیتی و گالوانی
سلول الکترولیتی مانند سلول گالوانی از دو نیم سلول اکسایش و کاهش تشکیل شده است. جهت جریان الکترون ها در این سلول عکس جهت جریان در سلول گالوانی اما ردیف کاتد و آند آنها مشابه است یعنی در محل کاتد، کاهش و در محل آند، اکسایش صورت می گیرد. جریان پیوسته الکترون از آند به کاتد نیز در هر دو سلول وجود دارد.
از تفاوت های سلول های فوق این است که در سلول گالوانی انرژی حاصل از واکنش خودبهخودی به انرژی الکتریکی تبدیل می شود ولی در سلول الکترولیتی به انرژی شیمیایی تبدیل خواهد شد.
سلول الکترولیتی از چه اجزائی تشکیل شده است؟
اجزاء یک سلول الکتروشیمیایی شامل یک الکترولیت و دو الکترود کاتد و آند است. الکترولیت معمولاً محلول آبی یا حلال دیگری است که یونها در آن حل می شوند. نمک های مذاب مانند کلرید سدیم نیز می توانند به عنوان الکترولیت استفاده شوند. هنگامی که الکترودها تحت یک ولتاژ خارجی قرار می گیرند یون های موجود در الکترولیت جذب الکترود با بار مخالف می شوند ، جایی که واکنش های انتقال بار (فارادایک یا ردوکس) اتفاق می افتد.
فقط با یک پتانسیل الکتریکی خارجی (به عنوان مثال ، ولتاژ) با قطبیت صحیح و اندازه کافی ، یک سلول الکترولیتی می تواند یک ترکیب شیمیایی به طور معمول پایدار یا بی اثر را در محلول تجزیه کند. انرژی الکتریکی ارائه شده می تواند یک واکنش شیمیایی ایجاد کند که به صورت خود به خود اتفاق نمی افتد.
کاربردهای سلول الکترولیتی
شارژ باتری
یکی از کاربردهای سلول الکترولیتی شارژ باتری های قابل شارژ از طریق فرآیند الکترولیز است. این باتری ها موقع استفاده مانند یک سلول ولتائی عمل می کنند اما زمان شارژ شدن نقش یک سلول الکترولیتی را بازی می کنند.
تولید سدیم
تولید فلز سدیم در صنعت از طریق الکترولیز سدیم کلرید مذاب صورت می گیرد. طی این فرآیند جهت کاهش نقطه ذوب سدیم کلرید آن را با کلرید کلسیم ترکیب می کنند. به دلیل اینکه الکترونگاتیوی کلسیم از سدیم بیشتر است، هیچ کلسیمی روی کاتد تشکیل نمی شود.
استخراج بعضی از فلزات از سنگ معدن آنها، آبکاری فلزات مانند آبکاری مس توسط نقره و پالایش بعضی از فلزات مانند نقره ، طلا ، مس و غیره از دیگر کابردهای سلول الکترولیتی است.
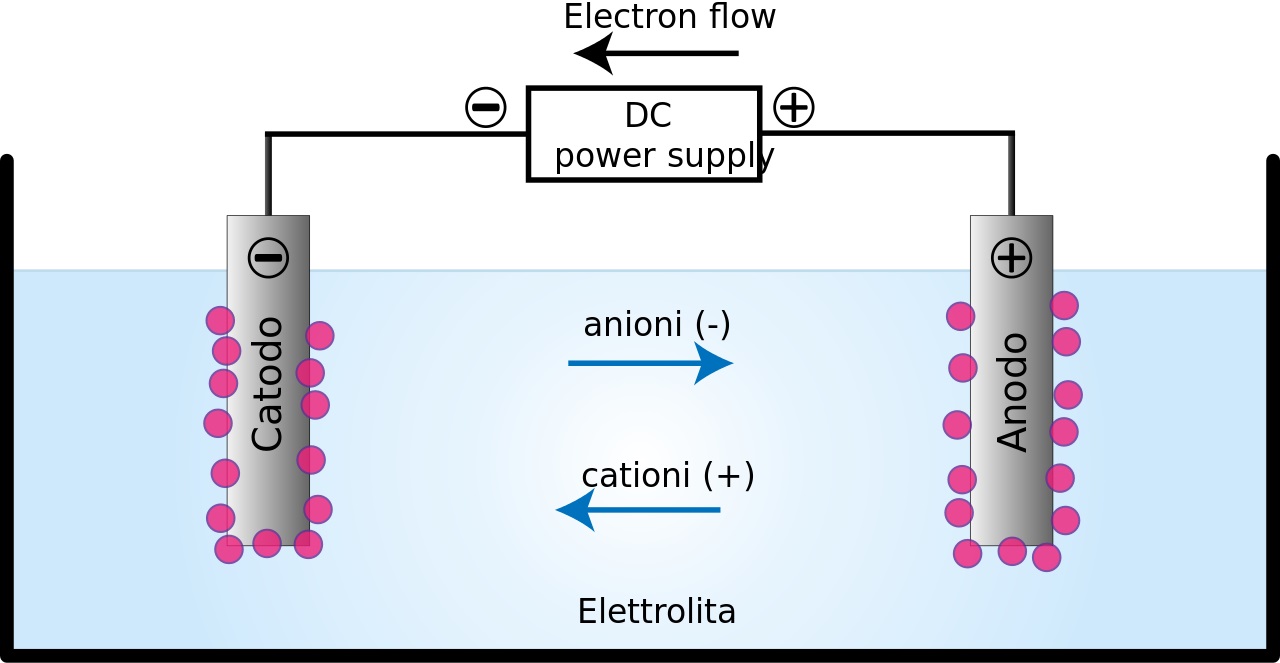
مثال هایی از سلول الکترولیتی
سلول الکترولیتی روی مس
در این سلول از آنجا که در سـری الکتروشیمیایی، عنصر روی بالاتر از مس قرار گرفته است، در شرایط معمول انتظار می رود که الکترون ها از روی به ســمت مس حرکت کنند اما حضور یک منبع تغذیه که به عنوان یک پمپ عمل می کند با صرف انرژی الکترون ها را از الکترود مس (مثبت) گرفته و به سمت روی روانه می سازد. بنابراین در این سلول یک واکنش غیر خودبه خودی انجام می شود.
سلول الکترولیتی آبکاری نقره
در آبکاری یک لایه از یک فلز بر روی سطح دیگر نشسته و معمولا برای محافظت از سطح زیرین استفاده می شود. برای آبکاری نقره ، نقره به عنوان الکترود آند + و فلز دیگر به عنوان کاتد – در نظر گرفته می شود. در این سلول الکترولیت حاوی یونها + Ag است و طی واکنش تیغۀ آند اکسید شده و یونها از طریق الکترولیت به سمت کاتد می روند. در نتیجه با گذشت زمان لایه نازکی از نقره بر روی فلز کاتد قرار می گیرد. باید به این نکته توجه کنید که فلز پوشاننده باید E بزرگتری نسبت به آب داشته باشد تا در رقابت برای کاهش، بر مولکول آب غلبه کند.
انواع سلول های الکتروشیمیایی را نام ببرید
انواع سلول الکتروشیمیایی شامل سلول های گالوانی و الکترولیتی هستند. کاربرد سلولهای گالوانی تولید انرژی الکتریکی از طریق واکنش های اکسایش و کاهش است که می توان از انرژی الکتریکی تولید شده برای انجام کار استفاده کرد.
نقش دیواره متخلخل در سلول گالوانی تبادل و انتقال یون ها بین این دو ظرف الکترولیت است و به کامل شدن مدار الکتریکی و جلوگیری از اختلاط دو محلول کمک می کند. پل نمکی همچنین مانع از تجمع بیش از حد یونهای مثبت و منفی در محلول الکترولیت می شود.



















