اسید و باز چیست و چگونه می توان آنها را شناسایی کرد؟
اسید و باز یک اصطلاح نسبی در شیمی است زیرا اسیدی یا بازی بودن یک ماده به شرایط مختلفی بستگی دارد.

طبق جدیدترین تعریف اسید ماده ای است که پروتون اهدا می کند یا یک جفت الکترون ظرفیت را برای تشکیل پیوند می پذیرد. باز ماده ای است که می تواند پروتون ها را بپذیرد یا یک جفت الکترون ظرفیت را برای تشکیل پیوند اهدا کند.در واقع می توان بازها را ماده شیمیایی مخالف اسیدها دانست. واکنش بین یک اسید و باز را یک واکنش خنثی سازی می نامند. قدرت یک اسید به توانایی یا تمایل آن برای از دست دادن یک پروتون اشاره دارد. اسید قوی اسیدی است که کاملاً در آب تفکیک می شود. ما در درس علوم هشتم و درس شیمی پایه دوازدهم با اسیدها و بازها آشنا می شویم.
چند نمونه اسید و باز خوراکی به ترتیب شامل اسید سیتریک و اسید استیک و جوش شیرین و شربت معده هستند. در ادامه مقاله در نشریه جهان شیمی فیزیک توضیحات بیشتری در این رابطه ارائه می شود.
PH اسید و باز
برای توضیح PH ما با دو مولکول آب شروع می کنیم. در حین واکنش یکی از مولکول های آب هیدروژن به دست می آورد و بنابراین بار مثبت به خود می گیرد، در حالی که مولکول دیگر آب یک اتم هیدروژن را از دست می دهد و بار منفی به خود می گیرد. H3O + یون هیدرونیوم نامیده می شود و باعث اسیدی شدن مواد می شود برعکسOH- یون هیدروکسیل نامیده می شود همه چیز را قلیایی می کند.
با این حال، در آب، بین یون هیدرونیوم و هیدروکسیل تعادل وجود دارد، بنابراین آنها بارهای های یکدیگر را خنثی می کنند. بر همین اساس آب خالص نه اسیدی است نه بازی بلکه خنثی است. ترکیب اسید و باز همواره باعث تولید یک ماده خنثی می شود.
–۲H2O ⇌ ۱ H3O+ + ۱ OH
بنابراین چگونه یک ماده اسیدی یا بازی می شود؟ این اتفاق زمانی می افتد که یون هیدرونیوم و هیدروکسیل از تعادل خارج شوند. اگر یون هیدرونیوم با بار مثبت بیشتر از هیدروکسیل با بار منفی باشد، ماده اسیدی است. اگر هیدروکسیل با بار منفی بیشتر از هیدرونیوم با بار مثبت باشد، ماده بازی می شود. PH در واقع مخفف پتانسیل (یا قدرت) یون هیدروژن است.
PHمقیاسی است که ما قدرت اسیدها و بازها را بر اساس آن اندازه گیری می کنیم. pH اندازه گیری میزان اسیدیته در مقیاس ۱۴ درجه ای است، جایی که ۷ نقطه میانی و خنثی است. PH یک مقیاس لگاریتمی است (مانند مقیاس ریشتر برای زلزله)، بنابراین ماده ای با PH 4 تقریبا ۱۰ برابر اسیدی تر از ماده ای با pH 5 و ۱۰۰ برابر اسیدی تر از ماده ای با PH 6 است.
شناساگر اسید و باز ابزارهایی هستند که به روش های مختلف برای شناسایی این ترکیبات مورد استفاده قرار می گیرند. برای تحقیق درباره اسید و باز باید با PH و روش های اندازه گیری آن آشنا بود.

روش های شناسایی اسید و باز
اسيدها و بازها دو دسته از مواد شيميایی بسیار معروف در شیمی هستند. ساده ترین راه شناسایی این ترکیبات بر اساس مزه و فرمول شیمیایی آنهاست. اسيدها ترکیباتی ترش مزه اند و ابتدای فرمول شيميایی آنها حاوی یک یا دو اتم هيدروژن است مانند سولفوريک اسيد (H2SO4). بازها ترکیباتی تلخ مزه هستند که در انتهای فرمول شيميایی خود يک يا چند گروه هيدروکسيد OH دارند مانند سديم هيدروکسيد (NaOH) به بازها مواد قليایی نیز گفته می شود
شناسایی اسيدها و بازها به روش های مختلفی صورت می گیرد مثلا بازها و اسيدهای خوراکی را می توان از طریق مزه آنها تشخيص داد. روش دیگر شناسایی این ترکیبات استفاده از شناساگر یا معرف هاست که با تغيير رنگ خود در محيط اسيدی و بازی این ترکیبات را شناسایی می کنند.
شناساگر می تواند طبيعی یا شیمیایی باشد، انواع طبیعی شامل عصاره گل يا ميوه گياهان هستند که در قدیم مورد استفاده قرار می گرفتند. از بین شناساگرهای شيمیایی می توان به ليتموس (تورنسل)، فنول فتالئين و متيل اورانژ (متيل نارنجی) اشاره کرد.
تعاریف اسید و باز از دیدگاه های مختلف
واکنش اسید و باز یک واکنش شیمیایی است که بین یک اسید و یک باز رخ می دهد. مفاهیم مختلفی وجود دارد که تعاریف جایگزینی برای مکانیسم های واکنش درگیر و کاربرد آنها در حل مشکلات مربوطه ارائه می دهند. علیرغم تفاوت های مختلف در تعاریف، اهمیت آنها به عنوان روش های مختلف تجزیه و تحلیل زمانی آشکار می شود که در واکنش های اسید- باز برای گونه های گازی یا مایع استفاده شوند، یا وقتی که ویژگی اسید یا باز تا حدودی کمتر آشکار باشد.
نظریه آرنیوس
تعریف آرنیوس از واکنش های اسید – باز توسعه نظریه هیدروژن اسیدها است که برای ارائه تعریفی مدرن از اسیدها و بازها مورد استفاده قرار گرفت و از کار آرنیوس با فردریش ویلهلم استوالد در رابطه با حضور یونها در محلول آبی در سال ۱۸۸۴ حاصل شد که منجر به دریافت جایزه نوبل شیمی در سال ۱۹۰۳ توسط آرنیوس شد.
بر این اساس اسید آرنیوس ماده ای است که در آب تفکیک شده و یون های هیدروژن (H +) تشکیل می دهد. به عبارت دیگر یک اسید باعث افزایش غلظت یونهای H + در محلول آبی می شود. این پروتون سازی در آب باعث تولید یون هیدرونیوم (H3O +) می شود. در شیمی مدرن H + به عنوان مختصر + H3O در نظر گرفته می شود زیرا اکنون مشخص شده است که یک پروتون برهنه (H +) به عنوان یک گونه آزاد در محلول آبی وجود ندارد.
باز آرنیوس ماده ای است که در آب تفکیک شده و یون های هیدروکسید (OH–) تشکیل می دهد. به عبارت دیگر بازها باعث افزایش غلظت یونهای OH– در یک محلول آبی می شوند.
محدودیت های تعریف آرنیوس
تعاریف آرنیوس از اسیدیته و قلیایی بودن به محلول های آبی محدود شده و به غلظت یون های محلول اشاره دارد. تحت این تعریف H2SO4 خالص یا HCl محلول در تولوئن اسیدی نیستند، با وجود این واقعیت که هر دوی این اسیدها یک پروتون به تولوئن اهدا می کنند. علاوه بر این، تحت تعریف آرنیوس محلول سدیم آمید (NaNH2) در آمونیاک مایع علی رغم این واقعیت که یون آمید (NH2- ( به راحتی آمونیاک را دپورتونه می کند باز محسوب نمی شود. بنابراین، تعریف آرنیوس فقط می تواند اسیدها و بازها را در یک محیط آبی توصیف کند.
واکنش اسید و باز آرنیوس
واکنش اسید- باز آرنیوس به عنوان واکنش پروتون و یون هیدروکسید برای تشکیل آب تعریف می شود که یک واکنش خنثی سازی است.
نمک + آب → اسید + باز
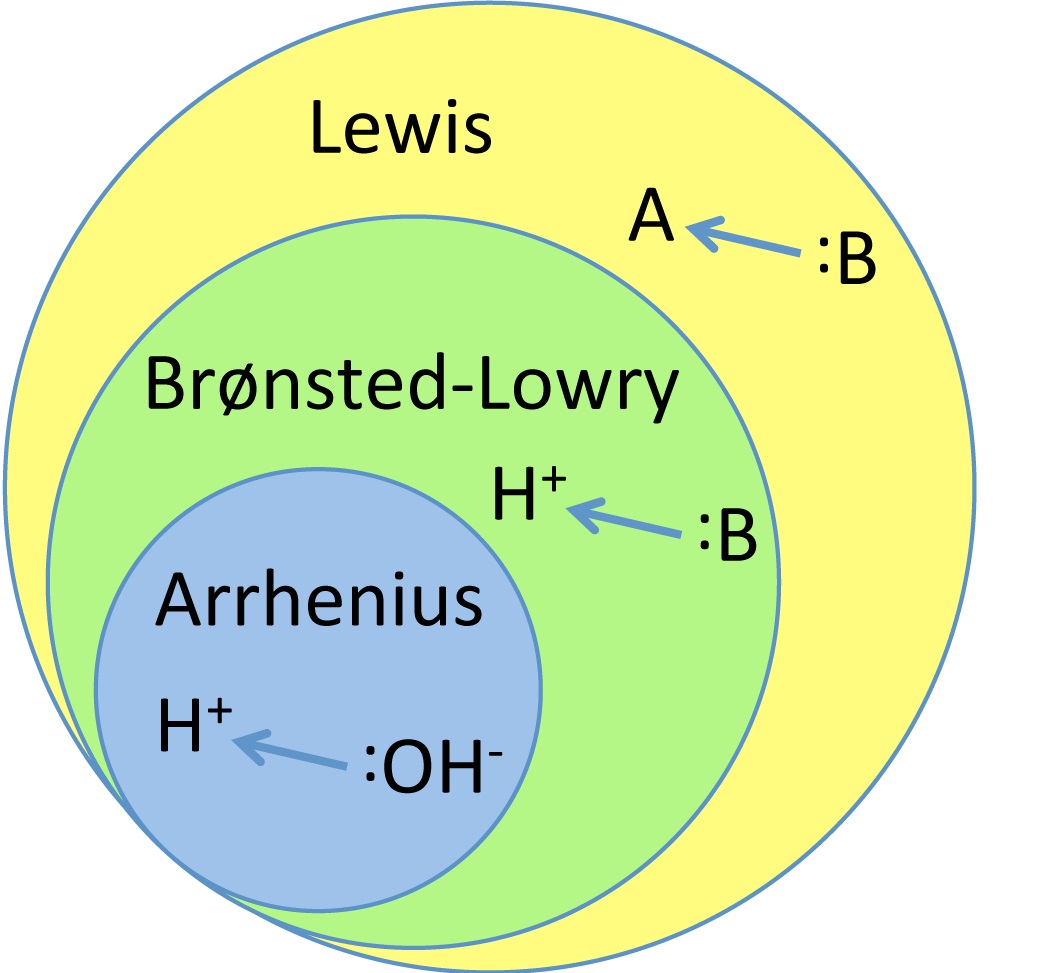
نظریه برونستد – لوری
طبق این تعریف اسید ماده ای است که بتواند پروتون اهدا کند و باز هر ترکیبی است که قادر به پذیرش پروتون باشد. از آنجاییکه تعریف آرنیوس به محلول های آبی محدود می شود و به حل شدن یون های آبی اشاره دارد، بنابراین شامل اسیدهای محلول در حلال های آلی نمی شود. برای حل این مشکل، یوهانس نیکلاس برونستد و توماس مارتین لوری، در سال ۱۹۲۳، هر دو به طور مستقل تعریف جایگزینی از اسیدها و بازها را ارائه دادند.
در این سیستم جدید، اسید به عنوان هر مولکول یا یونی تعریف می شود که توانایی اهدای کاتیون هیدروژن (پروتون، H +) را داشته باشد، در حالی که باز گونه ای با توانایی بدست آوردن یا پذیرش هیدروژن است. طیف گسترده ای از ترکیبات را می توان در چارچوب برونستد – لوری طبقه بندی کرد که شامل اسیدهای معدنی و مشتقات آنها مانند سولفونات ها، اسیدهای کربوکسیلیک، آمین ها، اسیدهای کربن و بسیاری دیگر از ترکیبات هستند.
اسید و باز مزدوج
به خاطر داشته باشید که اسیدها و بازها باید همیشه دو به دو واکنش نشان دهند. دلیل این امر این است که اگر قرار است ترکیب اهدا کننده پروتون به عنوان یک اسید رفتار کند، لزوماً باید بازی برای پذیرش پروتون آن وجود داشته باشد. طرح کلی واکنش اسید / باز مزدوج برونستد- لوری را می توان به صورت زیر مشاهده کرد:
اسید کنژوگه + باز کنژوگه ⇌ اسید + باز
در اینجا، یک باز مزدوج گونه ای است که پس از اهدای پروتون توسط اسید برونستد تولید شده است. اسید مزدوج وقتی تشکیل می شود که باز برونستد پروتون را از اسید برونستد می پذیرد. بنابراین طبق تعریف برونستد – لوری یک واکنش اسید-باز واکنشی است که در آن یک باز مزدوج و یک اسید مزدوج تشکیل می شود.
نظریه لوئیس
اسید باز لوئیس یکی از جامع ترین نظریه ها در خصوص اسیدها و بازها بوده و بسیار کاربردی تر از اسید – باز آرنیوس یا برونستد لوری است. در این نظریه اسیدها و بازها به عنوان دهنده و پذیرنده پروتون مورد توجه قرار می گیرند. این نظریه در سال ۱۹۲۳ توسط گیلبرت لوییس (Gilbert Lewis) در دانشگاه برکلی ارائه شد که یک توصیفی عمومی برای اسیدها و بازها بر اساس ساختار و پیوند آنهاست.
لوییس به جای استفاده از مفهوم انتقال پروتون، از الکترون استفاده می کند بر این اساس اسید ماده ای است که یک جفت الکترون می پذیرد و باز ماده ای است که یک جفت الکترون می دهد.
واکنش اسید و باز لوییس باعث ایجاد پیوند داتیو بین ترکیبات ( پیوند کووالانسی کوئوردیناسی) می شود. این پیوند در واقع نوعی پیوند کووالانسی محسوب می شود که در آن یک ترکیب جفت الکترون خود را به دیگری می دهد. در این واکنش باز لوییس الکترون های خود را به اسید لوییس داده و فرآورده حاصل ترکیب افزایشی یا اداکت (Adduct) نامیده می شود.
اسید بازی چیست
اسید بازی اصطلاحی پرکاربرد در علم شیمی است که بسته به شرایط ماده متفاوت است. اسید و باز در شیمی تعاریف مختلفی دارند مثلا اگر ماده ای پروتون اهدا کند اسید و اگر پروتون جذب کند باز نامیده می شود. اسید و باز بر اساس تولید یون هیدرونیوم و هیدروکسیل نیز در شیمی تعریف شده اند و روش های مختلفی نیز برای شناسایی آنها وجود دارد.
اسید چیست
اسید یک گونه از مواد شیمیایی پرکاربرد در علم شیمی و صنایع مختلف است. این ماده معمولا پروتون یا یون هیدروژن اهدا می کند و یا الکترون می پذیرد. اکثر اسیدها حاوی یک اتم هیدروژن هستند که می توانند آن را آزاد کنند. در نتیجه یک کاتیون و یک آنیون در آب تولید می کنند. هر چه غلظت یون هیدروژن تولید شده توسط اسید بیشتر باشد، اسیدیته آن نیز بیشتر است و pH محلول کمتر از ۷ می شود.
کلمه اسید از کلمه لاتین acidus یا acer گرفته شده است که به معنی ترش است. یکی از ویژگی های اسیدهای موجود در آب طعم ترش است، مانند سرکه یا آب لیمو که یک نوع اسید ضعیف هستند.
روش های مختلفی برای تعریف اسیدها در علم شیمی وجود دارد. در علم شیمی کلمه اسید، معمولا به اسید آرنیوس یا برونستد-لوری اشاره می کند. اسید لوئیس معمولا با نام «اسید لوئیس» در صنعت شناخته می شود. دلیل تعاریف متفاوت موجود این است که اسیدها مجموعه مولکول های یکسانی را شامل نمی شوند. تعاریف مختلف اسیدها عبارتند از:
اسید آرنیوس
بر اساس این تعریف، اسید ماده ای است که غلظت یون هیدرونیوم (+H3O) را با اضافه شدن به آب افزایش می دهد. همچنین ممکن است افزایش غلظت یون هیدروژن (+H) را به عنوان یک جایگزین در این تعریف در نظر بگیرند.
اسید برونستد- لوری
بر اساس این تعریف، اسید ماده ای است که می تواند به عنوان دهنده پروتون عمل کند. این یک تعریف محدودتر است، زیرا حلال ها به جز آب از این امر مستثنی نیستند. اساسا، هر ترکیبی که می تواند پروتون زدایی کند، یک اسید برونستد – لوری است. این تعریف پرکاربرد ترین تعریف اسید در علم شیمی است.
اسید لوئیس
بر اساس این تعریف اسید لوئیس، می تواند یک جفت الکترون را برای تشکیل یک پیوند کووالانسی از ترکیبات دیگر بپذیرد. برخی از ترکیبات فاقد هیدروژن از جمله تری کلرید آلومینیوم و تری فلوراید بور براساس این تعریف واجد شرایط هستند.
فرمول اسید
اسید ها معمولا بر اساس نافلزات موجود در ترکیب شیمیایی خود نام گذاری می شوند. فرمول شیمیایی اسید نیز بر اساس همین تعریف شکل می گیرد. برای درک بهتر این مسئله نمونه های از این سیستم نام گذاری برای شما ارائه شده است که در ادامه شرح داده شده است:
اسیدهای معدنی بدون اکسیژن
هیدرو + نام نافلز + پسوند یک + اسید (مانند HCl یا هیدروکلریک اسید)
اسیدهای معدنی اکسیژن دار
نام نافلز + پسوند یک + اسید (مانند H۲CO۳ یا کربنیک اسید)
همچنین باید توجه داشته باشید که اگر نافلز دارای دو حالت اکسید متفاوت باشد، به صورت زیر نامگذاری می شود.
- H۳PO۳ یا فسفرو اسید
- H۳PO۴ یا فسفریک اسید
اسیدهای آلی
نام آلکان های هم کربن + پسوند وییک + اسید (مانند HCOOH یا متانوییک اسید)
برخی دیگر از فرمول شیمیایی اسیدهای معروف عبارتند از:
- هیدرویدیک اسید یا HI
- سولفوریک اسید یا H۲SO۴
- نیتریک اسید یا HNO۳
- هیدروبرمیک اسید یا HBr
اسید خوراکی
اسید خوراکی نوعی از اسید است که بدون داشتن هیچ گونه عوارض جانبی در صنایع غذایی و تولید محصولات خوراکی استفاده می شود. اسید های خوراکی مورد استفاده در صنایع غذایی، معمولا به دو دسته مفید و مضر تقسیم می شوند. اسید های خوراکی مفید معمولا در محصولات غذایی مزه ترش را ایجاد می کنند. برخی از اسید های خوراکی مفید شامل اسید سیتریک، تارتاریک اسید و مالئیک اسید هستند. این گونه اسید ها به طور طبیعی در میوه هایی همچون توت، آلو، گیلاس و بلوبری یافت می شود.
در مقابل اسیدهای خوراکی مضر در محصولات غذایی باعث شدیدتر شدن طعم مواد غذایی می شود. این مواد همچنین به عنوان نگهدارنده محصولات غذایی نیز استفاده می شوند. برخی از اسیدهای خوراکی مضر، شامل اسید تانیک، اسید اوریک، فسفریک اسید و اگزالیک اسید هستند. این گونه اسید ها را می توانید در محصولات غذایی همچون فلفل، چای، کاکائو و اسفناج یافت کرد.
انواع اسید
اسید ها انواع مختلفی دارند. این مواد را بیشتر بر اساس قدرت دسته بندی می کنند. اما دسته بندی های دیگری همچون اسید های معدنی، اسید های آلی، اسید های خوراکی و اسید های صنعتی نیز وجود دارد. برای مثال اسید های معدنی، موادی هستند که در نتیجه ترکیب با هیدروژن بوجود می آیند. از این اسیدها بیشتر در صنایع و آزمایشگاه ها استفاده می شوند. این اسید ها بسیار قوی هستند و در صورت تماس با پوست باعث خوردگی و آسیب می شوند. برخی از این اسید های معدنی شامل هیدروکلریک اسید، سولفوریک اسید، نیتریک اسید، هیدروبرمیک اسید وهیدرویدیک اسید هستند.
نوع دیگری از اسید های پرکاربرد، اسید های آلی هستند. این اسید ها بیشتر توسط برخی از موجودات زنده در طبیعت ساخته می شوند. بیشتر اسید های آلی خوراکی هستند و خاصیت اسیدی ضعیفی دارند. برخی از اسید های آلی شامل استیک اسید، سیتریک اسید، فرمیک اسید، لاکتیک اسید، مالئیک اسید و بسیاری دیگر هستند.
چند نمونه اسید و باز
اسیدها و بازها به وفور در شیمی مورد استفاده قرار می گیرند از بین اسیدهای قوی پرکاربرد می توان به سولفوریک اسید (H۲SO۴ )، هیدروکلریک اسید(HCl) ، هیدروبرمیک اسید (HBr)، نیتریک اسید (HNO۳ )، هیدرویدیک اسید (HI) و پرکلریک اسید (HClO۴) اشاره کرد. ترکیباتی مانند هیدروفلوئوریک اسید (HF )، هیدرو سولفریک اسید (H2S )، فرومیک اسید (HCOOH) و بسیاری دیگر از اسیدها جزء اسیدهای ضعیف طبقه بندی می شوند.
هیدروکسید های فلزات گروه I و گروه II جدول تناوبی بیشتر بازهای قوی موجود را تشکیل می دهند که برخی از آنها عبارتند از لیتیم هیدروکسید (LiOH )، سدیم هیدروکسید (NaOH )، پتاسیم هیدروکسید (KOH) و روبیدیم هیدروکسید (RbOH) . از بین بازهای ضعیف می توان به آمونیاک (NH3)، متیل آمین و غیره اشاره کرد. در ادامه اسیدهای پرکاربرد در شیمی شرح داده شده است.
اسید استیک
استیک اسید یک اسید ضعیف با فرمول مولکولی(CH3COOH) است که جزء کربوکسیلیک اسیدها طبقه بندی می شود. این اسید با تخمیر و فساد اکثر مواد غذایی تولید می شود و تحت عنوان سرکه در صنایع مختلف کاربرد گسترده ای دارد.
اسید سولفوریک
اسید سولفوریک یک اسید قوی و پرکاربرد است که در صنایع مختلف مورد استفاده قرار می گیرد. اسید سولفوریک برای تولید کودهای شیمیایی، استخراج اورانیوم و وانادیوم و صنایع فولاد و آهن مورد استفاده قرار می گیرد.
اسید نیتریک
اسید نیتریک یا جوهر شوره یک اسید قوی و قدیمی است که بسیار خورنده است. از این اسید برای تولید بسیاری از ترکیبات شیمیایی استفاده می شود. اسید نیتریک در تولید کودهای شیمیایی و همچنین ساخت مواد منفجره و برخی از واسطه های تولید رنگ استفاده می شود.
اسید سیتریک
اسید سیتریک یک اسید ضعیف با فرمول شیمیایی C6H8O7 است که بیشتر به عنوان یک افزودنی مواد غذایی مورد استفاده قرار می گیرد. این اسید ابتدا از آبلیمو استخراج شد ولی اکنون به صورت صنعتی نیز تواید می شود و در صنایع غذایی و دارویی کاربرد وسیعی دارد.
اسید فرمیک
اسید فرمیک یا اسید متانوئیک یک اسید خورنده و فرار با بوی تند است که بیشتر به عنوان نگهدارنده و سموم دفع آفات مورد استفاده قرار می گیرد. این اسید اثرات آنتی باکتریال دارد و در سیلوهای کشاورزی مورد استفاده قرار می گیرد.
اسید لاکتیک
اسید لاکتیک ترکیبی با فرمول مولکولی CH3CH (OH) COOH است که به صورت مصنوعی و طبیعی تولید می شود. لاکتیک اسید در بیشتر محصولات لبنی تخمیر شده مانند کفیر و ماست یافت می شود و در تولید لوازم آرایشی – بهداشتی و پلیمرها مورد استفاده قرار می گیرد.
مالئیک اسید
اسید مالیک ترکیبی با فرمول مولکولی C4H6O5 است و طعمی شبیه اسید سیتریک دارد. این اسید در بدن همه موجودات زنده تولید می شود. اسید مالیک به عنوان آنتی اکسیدان و شلات کننده در صنایع غذایی مورد استفاده قرار می گیرد. همچنین در تولید محصولات مراقبت از پوست کاربرد دارد.
اسید کلریدریک
اسید کلریدریک یا جوهر نمک یک اسید معدنی قوی و بسیار خورنده با کاربرد گسترده است. این اسید در تولید پلاستیک، آلیاژ و فولاد ضد زنگ، اچینگ آلومینیوم و تمیز کردن فلزات مورد استفاده قرار می گیرد. در صنایع غذایی نیز در فرآوری مواد غذایی کاربرد دارد.
فسفریک اسید
اسید فسفریک یک اسید بسیار پرکاربرد است که بیشتر از منابع طبیعی استخراج می شود. در صنایع غذایی از اسید فسفریک در تولید نوشیدنی های گازدار استفاده می شود و در کشاورزی برای تولید کودهای کشاورزی مورد استفاده قرار می گیرد.
اگزالیک اسید
اسید اگزالیک یا اسید اتاندیوئیک یک ترکیب طبیعی است که در انواع سبزیجات وجود دارد و در بدن ما نیز تولید می شود. اسید اگزالیک کاربرد فراوانی در صنایع دارد و برای سفید کردن منسوجات و فرآوری چرم و همچنین به عنوان کاتالیزور مورد استفاده قرار می گیرد.
ترکیب اسید و باز چه می شود
اسیدها ترش مزه هستند و طبیعتاً خورنده همراه با طعم ترش هستند، اسیدها نیز قابلیت خوردگی دارند. به همین دلیل اسیدها معمولاً در ظروف شیشه ای ذخیره می شوند. اسیدهای معدنی مانند اسیدهای نیتریک و سولفوریک می توانند در اثر تماس بافت انسان را بسوزانند و به لباس، کاغذ و غیره آسیب برسانند. بنابراین، باید با احتیاط از اسیدها استفاده کرد. اسیدها در آب محلول هستند اکثر اسیدها در دمای اتاق یا در حرارت دادن در آب حل می شوند و محلولی شفاف تشکیل می دهند. بسته به مقدار آب، اسیدها می توانند رقیق یا غلیظ باشند.
بازها موادی هستند که در هنگام لمس صابونی و طعم آنها تلخ است. موادی که دارای باز هستند، مواد بازی نامیده می شوند. هیدروکسید سدیم (NaOH) و هیدروکسید کلسیم [Ca(OH)2] نمونه هایی از بازهای مورد استفاده در آزمایشگاه هستند. نشاسته ذرت، سفیده تخم مرغ تازه و غیره نمونه های دیگری از بازها هستند. بازها ممکن است بوی تحریک کننده قوی داشته باشند و باید با احتیاط استفاده شوند زیرا می توانند به پوست و چشم آسیب برسانند. باز ماده ای است، معمولاً اکسید یا هیدروکسید یک فلز، که می تواند با اسید واکنش داده و نمک و آب تولید کند.
در واکنش های اسید-باز یک پروتون از اسید به باز منتقل می شود. اگر اسید و باز مولکول های خنثی باشند، محصول یک یون مثبت و یک یون منفی است و به عنوان نمک شناخته می شود. واکنش اسید و باز را واکنش خنثی سازی می نامند. در این واکنش، اسیدیته یک اسید توسط یک قلیایی خنثی می شود. در همان زمان، قلیاییت قلیایی توسط اسید خنثی می شود. نمک و آب تنها محصولات واکنش خنثی سازی هستند.
اسید + قلیایی → نمک + آب
واکنش خنثی سازی زمانی رخ می دهد که یک قلیایی با اسید واکنش می دهد و نمک و آب تشکیل می دهد.



















