واکنش گرماگیر چیست؟ – تغییرات آنتالپی و مثال هایی از آن
واکنش شیمیایی که برای انجام آن انرژی مصرف می شود واکنش گرماگیر نامیده می شود. هیچ کدام از واکنش های گرماگیر نمی تواند به طور خود به خود انجام شود و حتما باید انرژی به آن داده شود. در طی انجام این واکنش ها دمای محیط اطراف واکنش کاهش می یابد. در کتاب علوم پایه هشتم واکنش های گرماگیر و گرماده بررسی شده است. برای شناخت بهتر واکنش های گرماگیر که برای انجام آن ها باید کار روی سیستم واکنش انجام شود، این مقاله نشریه جهان شیمی فیزیک را همراهی کنید.
تعریف واکنش های گرماگیر و گرماده
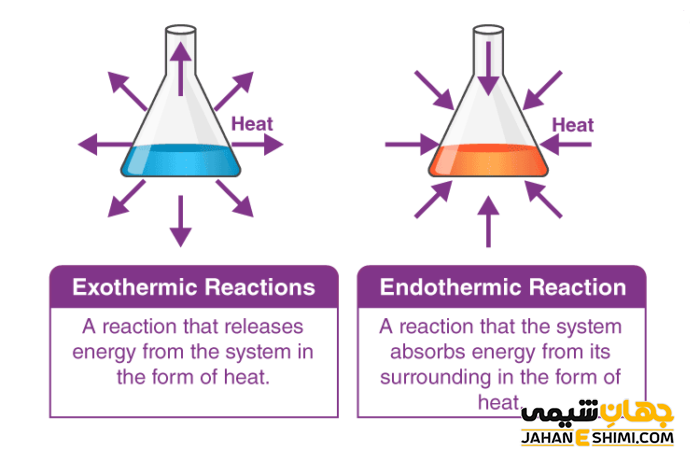
واکنش های شیمیایی که در حین انجام واکنش، تغییرات انرژی صورت می گیرد و دو نوع هستند، به نام واکنش های گرماده و گرماگیر می باشند. این واکنش ها بر اساس ورود یا خروج انرژی طبقه بندی می شوند. وقتی در حین انجام واکنش گرما از محیط گرفته شده و دمای محیط کاهش می یابد، نشان دهنده نیاز این واکنش به گرما و انرژی برای انجام می باشد و به این نوع واکنش، گرماگیر می گویند. این نوع از واکنش ها نمی توانند به طور خود به خودی پیشرفت کنند. به جزء وقتی که انرژی آزاد گیبس (G∆) منفی باشد که می تواند واکنش، خود به خودی باشد.
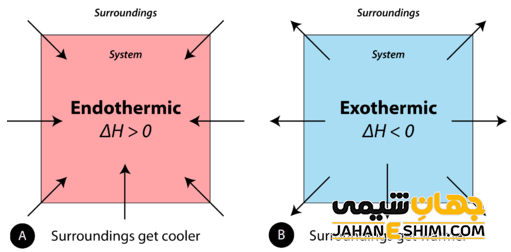
اما واکنش هایی که در حین انجام آن انرژی به صورت گرما، نور و یا صدا آزاد شده و به محیط داده می شوند و موجب افزایش دمای محیط می شوند واکنش های گرماده یا گرمازا می گویند. این نوع از واکنش ها به صورت خود به خودی انجام می شود و باعث افزایش آنتروپی (بی نظمی) سیستم می شوند.
به واکنش های گرماگیر و گرماده نام های اندوترمیک و اگزوترمیک نیز می گویند (اندو به معنای داخل، اگزو به معنای خارج و ترمیک به معنای حرارت است). در واکنش های گرماده علامت H∆ (تغییرات آنتالپی) منفی و در واکنش های گرماگیر تغییرات آنتالپی مثبت خواهد بود.
سطح انرژی مواد در واکنش اندو ترمیک
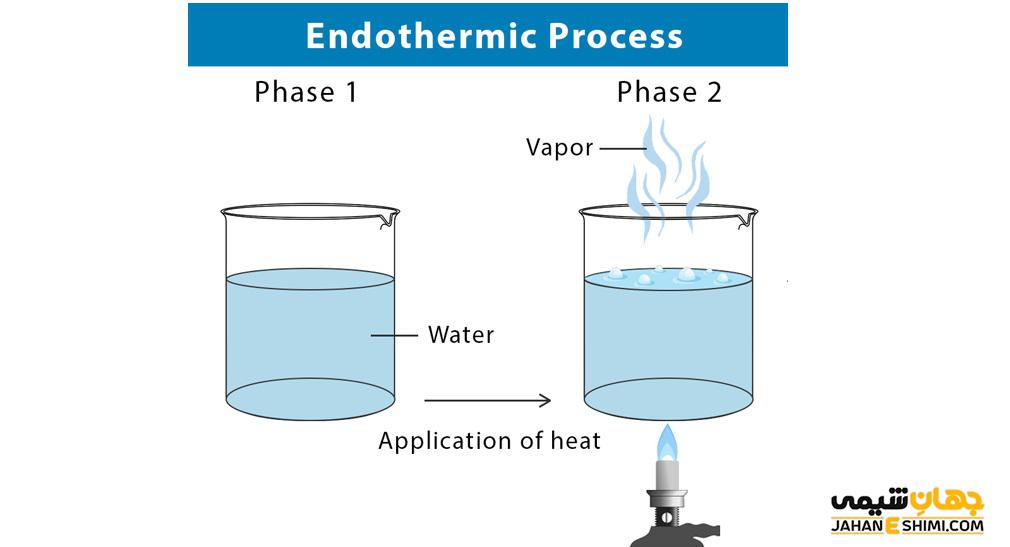
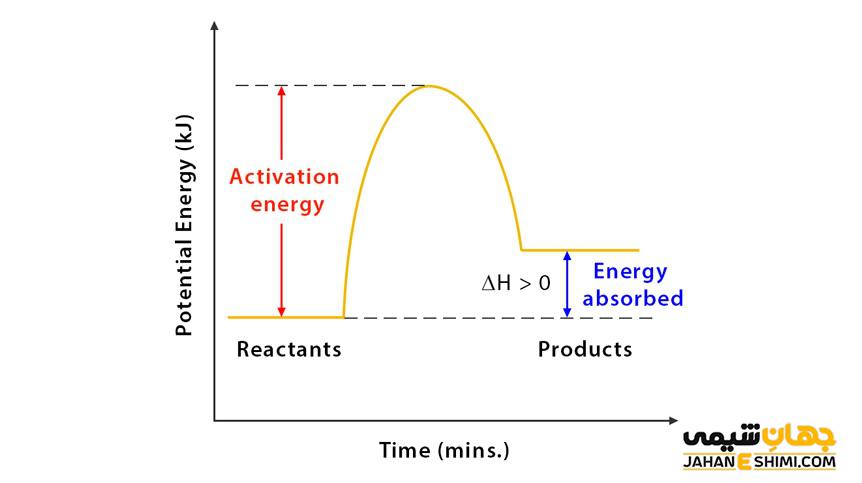
در این واکنش ها چون مواد در حین انجام واکنش گرما می گیرد، سطح انرژی محصولات بالاتر از سطح انرژی مواد اولیه می باشد. به عبارتی دیگر آنتالپی واکنش، در فشار ثابت، افزایش می یابد. در واکنش های گرماگیر انرژی درونی واکنش نیز افزایش می یابد. انرژی لازم برای انجام واکنش از محیط بیرون گرفته می شود. یعنی بر روی سیستم کار باید انجام شود تا واکنش اتفاق بیفتد.
بررسی ترمودینامیکی و اکنش گرماگیر
در یک واکنش، بر طبق اصل قانون پایستگی انرژی، نه انرژی به وجود می آید و نه از بین می رود، بلکه فقط از صورتی به صورت دیگر تبدیل می شود. ترمودینامیک تبادلات انرژی در یک واکنش شیمیایی و تأثیر تغییر حالت های مختلف بر واکنش را بررسی می کند. اگر واکنش در فشار ثابت انجام شود آنتالپی سیستم افزایش می یابد. اگر واکنش در حجم ثابت انجام شود انرژی درونی سیستم افزایش می یابد. در واکنش های گرماگیر در معادله
∆ G = ∆ H _ T ∆S
G ˃ ۰∆ ( انرژی آزاد گیبس مثبت) بوده در نتیجه H ˃ ۰∆ (تغییرات آنتالپی مثبت) است. در یک واکنش خود به خودی نیز تغییرات آنتروپی منفی است و انرژی آزاد گیبس مثبت می باشد.
مثال هایی از واکنش گرماگیر
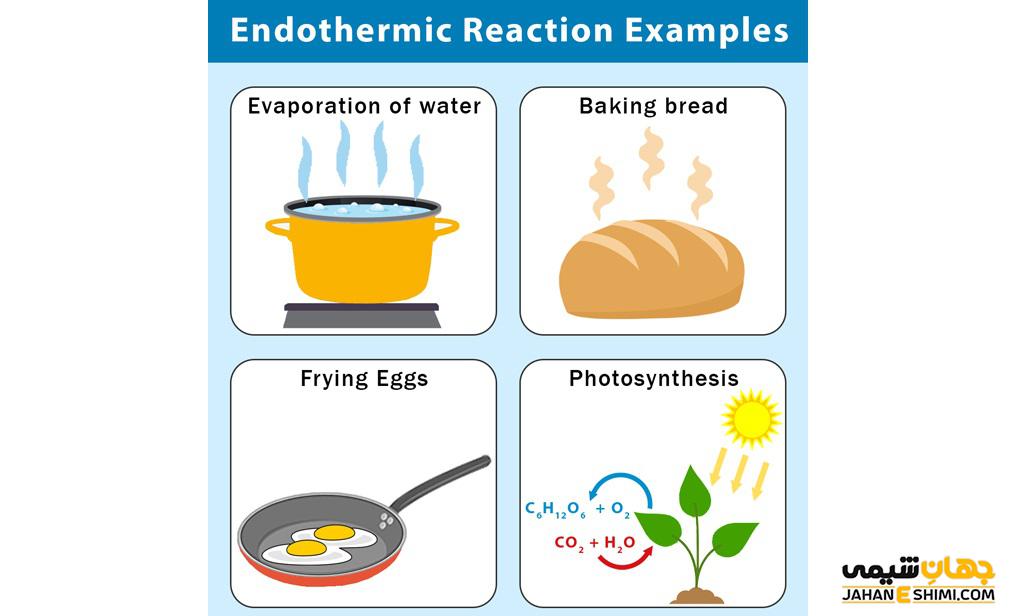
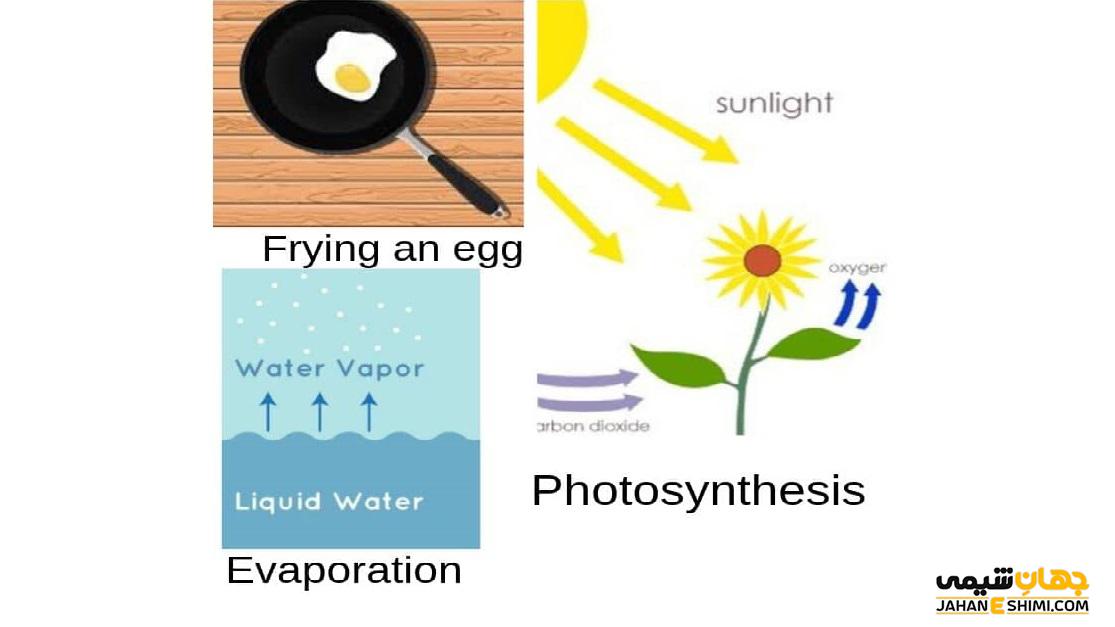
یکی از مثال های بارز واکنش اندوترمیک فرآیند فتوسنتز است که در آن در هرم چرخه غذایی، گیاهان با گرفتن انرژی خورشید، آب و دی اکسید کربن را به گلوکز و اکسیژن تبدیل می کنند. این گیاهان نور را در برگ خود گرفته و فتوسنتز را انجام می دهند که بدون نور این فرآیند انجام نمی شود، پس این واکنش اندوترمیک است. یکی دیگر از مثال های این نوع واکنش ها، فرآیند تبخیر است و مولکول های آب از محیط اطراف انرژی گرفته و انرژی ارتعاشی و حرکتی آن ها افزایش یافته و به بخار تبدیل می شوند. ذوب یخ نیز مانند تبخیر مثالی از واکنش اندو ترمیک است و برای آب شدن احتیاج به گرفتن انرژی از محیط اطراف خود دارد.
فرآیند الکترولیز نیز به دلیل این که احتیاج به انرژی بیرونی برای تجزیه مولکول به یون های تشکیل دهنده ی خود دارد، فرآیند گرماگیر است.کیسه های سرمازا که برای کاهش درد عضلانی از آن ها استفاده می شود نیز بر اساس واکنش اندوترمیک، عمل می کند. در داخل کیسه های کوچکی نیترات آمونیوم است که درون کیسه های بزرگتر محتوی آب قرار گرفتند. با قرار دادن این کیسه ها روی محل درد و فشار دادن آن ها نیترات آمونیوم وارد آب می شود و گرمای لازم برای انجام واکنش خود با آب را از بدن تأمین می کند. در نتیجه فرد درد کمتری را احساس می کند.
از دیگر وا کنش های گرماگیر می توان به شکستن پیوند ها در انجام واکنش ها، حل شدن بسیاری از نمک ها در آب، تصعید (تبدیل جامد به بخار)، تجزیه ی نمک ها مثل کربنات ها و… اشاره کرد.
استفاده از آنتالپی واکنش برای محاسبه گرمای واکنش
برای محاسبه تغییرات گرمای یک واکنش، آنتالپی یعنی محتوای گرمایی تعریف می شود. هر سیستم محتوای آنتالپی خاص خود را دارد که با تغییرات فیزیکی یا شیمیایی واکنش، محتوای آنتالپی آن نیز تغییر می کند. محاسبه آنتالپی در فشار ثابت انجام می شود. وقتی یک واکنش شیمیایی می خواهد انجام شود، باید پیوند بین مواد واکنش دهنده شکسته شده و بین محصولات پیوند تازه ای برقرار شود. شکستن پیوندها گرماگیر و تشکیل پیوندها، فرآیندی گرمازاست. اگر میزان گرمای مصرف شده بیشتر از گرمای آزاد شده در یک واکنش باشد، واکنش اندوترمیک و اگر برعکس این باشد، واکنش اگزوترمیک خواهد بود. داریم :
∆ H = ∑ ∆ H (products) _ ∑ ∆ H (reactants)
به عنوان مثال :
N۲ (g) + O۲ (g) → ۲ NO (g) (∆ H = + 180.5 kj ˃ ۰ )
یک واکنش اندوترمیک است.
تشخیص و تفاوت واکنش گرماده و گرماگیر
در واکنش گرماگیر دمای سیستم کاهش می یابد و گرمای واکنش مثبت است. اما در یک واکنش گرماده دمای سیستم افزایش یافته و گرمای واکنش منفی و گرما در محیط اطراف پخش می شود. واکنش های گرماده و گرماگیر سبب تغییر در آنتالپی و سطح انرژی واکنش می شوند. این تغییرات که در سیستم اتفاق می افتد در واکنش های گرماگیر، مثبت و در واکنش های گرماده، منفی خواهد بود. در واکنش های گرماگیر برای شروع واکنش باید به آن ها گرما داد، اما در واکنش های گرمازا، انجام واکنش به صورت خود به خودی خواهد بود. در واکنش های گرماگیر تغییرات آنتروپی منفی و برعکس در واکنش گرماده تغییرات آنتروپی مثبت است.
ثابت تعادل
ثابت تعادل یک واکنش شیمیایی که با K نمایش داده می شود از تقسیم حاصل ضرب غلظت محصولات واکنش به توان ضریب استوکیومتری آن ها به حاصل ضرب غلظت مواد واکنش دهنده به توان ضریب آن ها به دست می آید. طبق اصل لوشاتلیه هر گونه تغییری در غلظت، دما یا فشار در یک واکنش، باعث تغییر و به هم خوردن این ثابت تعادل شده و واکنش را در جهت اعمال آن تغییر پیش می برد. حال اگر این تغییر در دما و گرما باشد نیز واکنش را جا به جا می کند. اگر واکنش ها را به شکل کلی زیر در نظر بگیریم :
a A + b B → c C + d D
و اگر واکنش، اندو ترمیک باشد، با افزایش دما واکنش به سمت راست جا به جا می شود. اگر دما در یک واکنش اندو ترمیک کاهش یابد، طبق اصل لوشاتلیه واکنش به سمت چپ پیشرفت می کند.
گرماگیر و گرماده چیست علوم هشتم
تفاوت اصلی بین واکنش های گرمازا و گرمازا در تبادل حرارت با محیط اطراف نهفته است. واکنش های گرماگیر انرژی را به شکل گرما از محیط اطراف خود جذب می کنند که منجر به سردتر شدن محیط می شود. این بدان معنی است که محصولات انرژی بیشتری نسبت به واکنش دهنده ها دارند و واکنش به گرما نیاز دارد که منجر به تغییر مثبت در آنتالپی (ΔH) می شود.
واکنش های گرمازا انرژی را به شکل گرما به محیط اطراف خود آزاد می کنند که منجر به گرم شدن محیط می شود. در این حالت، محصولات انرژی کمتری نسبت به واکنش دهنده ها دارند و واکنش گرما آزاد می کند که منجر به تغییر منفی در آنتالپی (ΔH) می شود. در یک واکنش گرمازا، انرژی آزاد می شود که منجر به افزایش دمای مخلوط واکنش می شود. در مقابل، در یک واکنش گرماگیر، انرژی جذب می شود و در نتیجه دما کاهش می یابد.
تغییر در آنتالپی (ΔH) تفاوت بین انرژی محصولات و انرژی واکنش دهنده ها است. اگر ΔH منفی باشد، نشان دهنده یک واکنش شیمیایی گرمازا است، زیرا انرژی بیشتری در هنگام تشکیل محصولات نسبت به تجزیه واکنش دهنده ها آزاد می شود. اگر ΔH مثبت باشد، نشان دهنده یک واکنش شیمیایی گرماگیر است، زیرا انرژی کمتری در هنگام تشکیل محصولات نسبت به انرژی مورد استفاده برای تجزیه واکنش دهنده ها آزاد می شود.
واکنش های گرمازا گرما را به محیط آزاد می کند که می تواند اثرات زیست محیطی مثبت و منفی داشته باشد. آنها در فرآیندهایی مانند تنفس، احتراق و تولید انرژی نقش دارند. با این حال، واکنش های گرمازا می تواند به مشکلات زیست محیطی مانند آلودگی هوا و آب نیز کمک کند.
واکنش های گرمازا گرما را از محیط اطراف جذب می کنند. اگرچه آنها برای فرآیندهایی مانند فتوسنتز و پخت و پز ضروری هستند، اما معمولاً در مقایسه با واکنش های گرمازا تأثیر مستقیم کمتری بر محیط دارند.