اصل آفبا (Aufbau) یا اصل بناگذاری یک قاعده معروف شیمی کوانتوم است که بیانگر اساس و ترتیب پر شدن لایه های الکترونی در اوربیتال ها می باشد. در واقع این اصل جهت پر شدن اوربیتال های اتمی به وسیله الکترون ها در حالت پایه به کار می رود. این اصل بیان می کند که الكترون ها به ترتیب ابتدا در اوربیتال هایی قرار می گیرند كه كم ترین سطح انرژی را داشته باشند. در این مقاله در نشریه جهان شیمی فیزیک به بررسی اصل آفبا و قواعد آن پرداخته می شود. لطفا با ما همراه باشید.
فهرست مطالب این مقاله
۱- مقدمه
۱-۱- اوربیتال چیست ؟
۲-۱- اصل طرد پاولی چیست ؟
۳-۱- اصل هوند چیست ؟
۲- اصل آفبا شیمی دهم
۳- موارد استثنا در اصل آفبا
۱-۳- فلزات واسطه
۲-۳- لانتانید ها و اکتینید ها
۴- جدول تناوبی و اصل آفبا
۱-۴- بلوک های جدول تناوبی
مقدمه
آرایش الكترونی (Electron configuration) یک عنصر در حقیقت نحوه پر شدن اوربیتال ها به وسیله الكترون های آن عنصر را نشان می دهد. لازم به ذکر است که با تعیین و مشخص کردن آرایش الکترونی یک اتم، خواص فیزیکی و شیمیایی آن عنصر را می توان پیش بینی کرد. جهت مشخص کردن آرایش الكترونی عناصر در حالت پایه، الكترون ها را در اوربیتال های مختلف اتم مورد نظر به ترتیب سطح انرژی آنها (البته با رعایت ظرفیت اوربیتال)، اصل طرد پاولی و قاعده هوند قرار می دهند. در این حالت می توان گفت که از اصل آفبا استفاده کرده اید. در ادامه مروری کوتاه بر موارد گفته شده خواهیم داشت.
اوربیتال چیست ؟
به مناطق خاصی در اطراف هسته اتم که بیشترین احتمال حضور الکترون در آن فضا وجود دارد، اوربیتال گفته می شود. انواع اوربیتال ها عبارتند از :p ،s d و f. توجه داشته باشید که در اوربیتال s حداکثر دو الکترون در اوربیتال p حداکثر شش الکترون در اوربیتال d حداکثر ده الکترون و در اوربیتال f حداکثر چهارده الکترون قرار می گیرد.
اصل طرد پاولی چیست ؟
اصل طرد پاولی (Pauli exclusion principle) بیان می کند که هیچ دو الكترونی در اتم نمی توانند حالت کوانتومی (اعداد کوانتومی) یکسانی داشته باشند. اما چهار عدد کوانتومی (Quantum number) الکترون ها عبارتند از :
- عدد کوانتومی اصلی (n) که فاصله نسبی الکترون از هسته را نشان می دهد. به عبارت دیگر، این عدد نشان دهنده تراز های انرژی (الکترون ها در این تراز ها در اطراف هسته گردش می کنند) می باشد. n عددی صحیح است که می تواند کلیه مقادیر اعداد صحیح مثبت (بجز صفر) را داشته باشد.
- عدد کوانتومی مداری (L) که نشان دهنده لایه فرعی، تعداد اوربیتال ها و شکل اوربیتال می باشد.
- عدد کوانتومی مغناطیسی (m) که نشان دهنده جهت گیری اوربیتال در فضا می باشد.
- عدد کوانتومی اسپین (s) که نشان دهنده تکانه زاویه ای ذاتی یا تکانه زاویه ای اسپین یا اسپین می باشد.
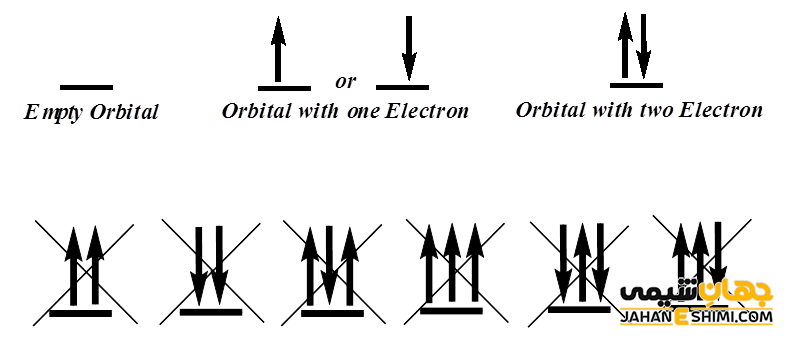
بنابراین بر طبق اصل طرد پاولی، بین هر دو الکترون، حداقل یکی از این چهار عدد کوانتمی بایستی متفاوت از دیگری باشد. به عبارت دیگر، در هر اوربیتال حداكثر دو الكترون با اسپین مخالف می تواند قرار گیرد.
اصل هوند چیست ؟
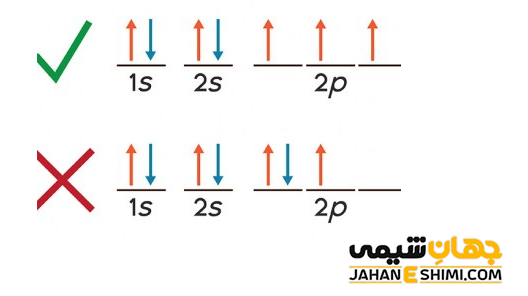
اصل هوند بیان می کند که اوربیتال های هم انرژی زمانی زوج می شوند که در هر کدام از آنها یک الکترون قرار گرفته باشد. به عبارت دیگر، وقتی الکترون ها چندین اوربیتال هم انرژی از یک تراز فرعی را در دسترس دارند، به شکلی پخش می شوند که بیشترین تعداد اوربیتال اشغال شود. در حقیقت تا زمانیکه هر یک از اوربیتال ها مورد نظر نیمه پر نشده باشند، هیچ یک پر نخواهند شد.
اصل آفبا شیمی دهم
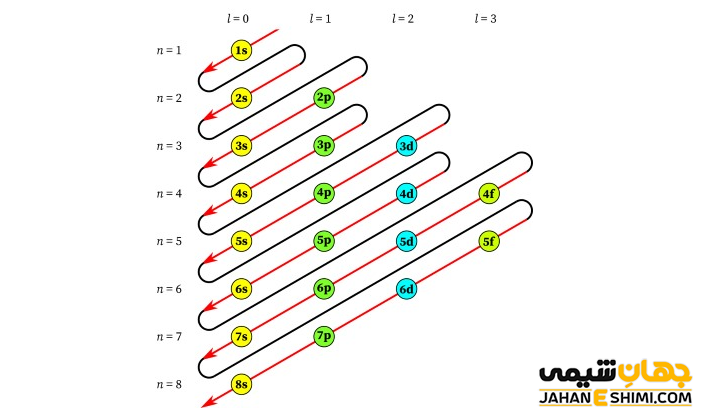
آفبا از کلمه آلمانی Aufbau به معنی بنا کردن گرفته شده است. به همین دلیل به آن اصل بناگذاری آفبا نیز گفته می شود. این اصل برای اولین بار توسط ولفگانگ پاولی در اوایل دهه ۱۹۲۰ مطرح شده است. همانطور که بیان شد از این اصل، می توان برای تعیین مکان الکترون ها و همچنین انرژی متناظر با آنها در یک اتم بهره برد. تصویر زیر طریقه پر شدن اوربیتال ها بر اساس اصل آفبا را نشان می دهد. توجه داشته باشید که در این شکل، n نشان دهنده عدد کوانتومی اصلی و l، نشان دهنده عدد کوانتومی فرعی می باشد.
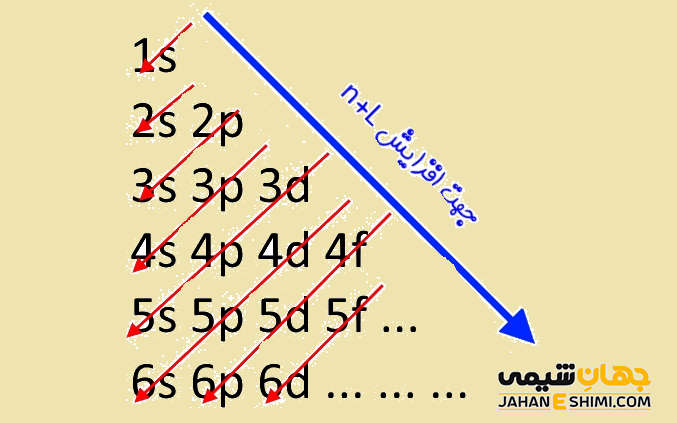
اصل آفبا در حقیقت بیان می کند که نخست اوربیتال هایی با سطح انرژی کمتر و پایین تر پر می شوند، در نهایت و بعد از پر شدن آنها، پرشدن اوربیتال هایی با سطح انرژی بالاتر آغاز می گردد. به عبارت دیگر، در هنگام پر شدن تراز های اوربیتالی، در ابتدا الکترون در تراز های پایدار تر پایین جا می گیرند و سپس تراز های انرژی بالاتر پر می شوند. این اصل در واقع اتم های جدول تناوبی را با تک تک اضافه کردن الکترون ها به شکلی که پایدار ترین حالت ممکن بوجود آید، نشان می دهد. از این رو، الكترونی كه سبب تفاوت آرایش الكترونی دو اتم متوالی می گردد را الكترون متمایز كننده می نامند.
جالب است بدانید
به طور کلی می توان گفت که اساس پر شدن اوربیتال ها به n+l وابسته خواهد بود. در واقع، الکترون ها در ابتدا در اوربیتال هایی قرار می گیرند که مجموع شماره تراز اصلی و تراز فرعی کوچکتری داشته باشند. به بیان دیگر، مجموع اعداد کوانتومی اصلی و فرعی، ترتیب انرژی اوربیتال ها را مشخص می کنند. حال اگر مجموع این دو عدد کوانتومی در دو اوربیتال یکسان باشد، اوربیتالی ابتدا از الکترون پر می شود که شماره تراز اصلی انرژی در آن (یعنی n) کوچک تر باشد و در نتیجه سطح انرژی آن کمتر و پایداری بیشتری خواهد داشت. به عنوان مثال ترتیب پر شدن اوربیتال ها به شکل زیر است :
۱s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p, …
به عنوان مثال، آرایش الكترونی عناصر با اعداد اتمی ۱۱ تا ۳۶ در ورده شده است.

موارد استثنا در اصل آفبا
بر خلاف انتظار، بسیاری از عناصر از اصل آفبا پیروی نمی کنند. این موارد استثنا را می توان در فلزات واسطه، لانتانید ها و اکتینید ها دید. اگر اختلاف سطح انرژی میان اوربیتال ها زیاد باشد، پایدارترین آرایش الكترونی قطعا از طریق پر شدن اوربیتال پایدارتر بدست خواهد آمد. در حالیکه اگر سطح انرژی اوربیتال ها زیاد نباشد و آنها به هم نزدیك باشند، اثرات دیگری نیز می تواند اهمیت داشته باشد. بدین صورت هم بر روی ترتیب سطح انرژی اوربیتال ها و هم آرایش الكترونی حالت پایه آنها تاثیر می گذارد. در این حالت، ممكن است که پایدار ترین آرایش الكترونی الزاما آرایشی كه از پرشدن به ترتیب اوربیتال بدست می آید، نباشد.
لازم به ذکر است که سطح انرژی اوربیتال های ns، (n-1) d و (n-2) f به یکدیگر نزدیك می باشد. بنابراین موقع پر شدن این اوربیتال ها می تواند اثرات دیگری علاوه بر ترتیب سطح انرژی اوربیتال ها و غیره بر روی مطلوب ترین آرایش الكترونی برای اتم تاثیر بگذارد. در ادامه مقاله به بررسی عناصری که از اصل آفبا پیروی نمی کنند می پردازیم.
فلزات واسطه
مثلا آرایش الکترونی عناصر كروم و مس به ترتیب به جای آرایش مورد انتظار ۳d۴ ۴s۲ و ۳d۹ ۴s۲ به صورت ۳d۵ ۴s۱ و ۳d۱۰ ۴s۱ می باشد. دو دلیل اصلی را برای انتخاب این نوع آرایش الکترونی ذکر می کنند که عبارتند از :
- پایداری بیشتر اوربیتال های نیمه پر ۳d۵ و ۳d۱۰ نسبت به اوربیتال های ۳d۴ و ۳d۹.
- اختلاف کمتر انرژی بین زیرلایه های ۳d و ۴s.
در واقع، زیرلایه های نیمه پر و زیر لایه هایی که کاملا پر شده اند، دافعه الکترونی کمتری را نشان می دهند. در نتیجه، پایداری را افزایش داده و آرایش الکترونی نهایی خواهند بود. مثلا آرایش های الکترونی p۳، p۶، d۵، d۱۰، f۷ و f۱۴ پایداری نیمه پر و یا پر دارند. در جدول زیر، آرایش الکترونی مورد انتظار بر اساس اصل بناگذاری آفبا و آرایش الکترونی اصلی که بر اساس مشاهدات آزمایشگاهی بدست آمده است، آورده شده است. در تمام عناصر جدول، اوربیتال d یک الکترون از اوربیتال s گرفته است (به جز پالادیوم، که هر دو الکترون به اوربیتال d منتقل شده اند).
عدد اتمی | عنصر | پیشبینی اصل آفبا | آرایش الکترونی اصلی |
| ۲۴ | کروم (Cr) | [Ar] 4s۲ ۳d۴ | [Ar] 4s۱ ۳d۵ |
| ۲۹ | (Cu) مس | [Ar] 4s۲ ۳d۹ | [Ar] 4s۱ ۳d۱۰ |
| ۴۱ | (Nb) نیوبیم | [Kr] 5s۲ ۴d۳ | [Kr] 5s۱ ۴d۴ |
| ۴۲ | (Mo) مولیبدن | [Kr] 5s۲ ۴d۴ | [Kr] 5s۱ ۴d۵ |
| ۴۴ | (Ru) روتنیم | [Kr] 5s۲ ۴d۶ | [Kr] 5s۱ ۴d۷ |
| ۴۵ | (Rh) رودیم | [Kr] 5s۲ ۴d۷ | [Kr] 5s۱ ۴d۸ |
| ۴۶ | (Pd) پالادیوم | [Kr] 5s۲ ۴d۸ | [Kr] 4d۱۰ |
| ۴۷ | (Ag) نقره | [Kr] 5s۲ ۴d۹ | [Kr] 5s۱ ۴d۱۰ |
| ۷۸ | (Pt) پلاتین | [Xe] 6s۲ ۴f۱۴ ۵d۸ | [Xe] 6s۱ ۴f۱۴ ۵d۹ |
| ۷۹ | (Au) طلا | [Xe] 6s۲ ۴f۱۴ ۵d۹ | [Xe] 6s۱ ۴f۱۴ ۵d۱۰ |
نکته
با توجه به جدول بالا مشخص می شود که در فلزات واسطه خارجی، اوربیتال های ns پایدارتر از اوربیتال های d (n-1) می باشند. پس الویت پرشدن با اوربیتال های ns خواهد بود. توجه داشته باشید که برای نوشتن آرایش الکترونی در کاتیون های فلزات واسطه خارجی، اوربیتال های (n-1) d نسبت به اوربیتال های ns پایدارتر هستند. بنابراین الویت پرشدن با اوربیتال های (n-1) d خواهد بود. دلیل این امر اینست که در کاتیون های فلزات واسطه خارجی، كاتيون با كندن الكترون های ns و سپس الكترون های d(n-1) بدست مي آيد.
لانتانید ها و اکتینید ها
در لانتانید ها و اکتینید ها نیز ده اتم از اصل آفبا پیروی نمی کنند. این عناصر در در جدول زیر آورده شده اند. لازم به ذکر است که در اینجا، اوربیتال d، یک الکترون از اوربیتال f گرفته است (به استثنای توریم و لارنسیوم). در اتم توریم، تمامی الکترون ها به زیر لایه الکترونی ۶d منتقل شده اند و در اتم لارنسیوم، ۶d با ۷p جایگزین شده است.
| عدد اتمی | عنصر | پیشبینی اصل آفبا | آرایش الکترونی اصلی |
| ۵۷ | لانتان (La) | [Xe] 6s۲۴f۱ | [Xe] 6s۲ ۵d۱ |
| ۵۸ | سریم (Ce) | [Xe] 6s۲ ۴f۲ | [Xe] 6s۲ ۴f۱ ۵d۱ |
| ۶۴ | گادولینیوم (Gd) | [Xe] 6s۲ ۴f۸ | [Xe] 6s۲ ۴f۷ ۵d۱ |
| ۸۹ | اکتینیوم (Ac) | [Rn] 7s۲ ۵f۱ | [Rn] 7s۲ ۶d۱ |
| ۹۰ | توریم (Th) | [Rn] 7s۲ ۵f۲ | [Rn] 7s۲ ۶d۲ |
| ۹۱ | پروتکتینیوم (Pa) | [Rn] 7s۲ ۵f۳ | [Rn] 7s۲ ۵f۲ ۶d۱ |
| ۹۲ | اورانیوم (U) | [Rn] 7s۲ ۵f۴ | [Rn] 7s۲ f۳ ۶d۱ |
| ۹۳ | نپتونیم (Np) | [Rn] 7s۲ ۵f۵ | [Rn] 7s۲ ۵f۴ ۶d۱ |
| ۹۶ | کوریم (Cm) | [Rn] 7s۲ ۵f۸ | [Rn] 7s۲ ۵f۷ ۶d۱ |
جدول تناوبی و اصل آفبا
فهم دقیق اصل طرد پائولی، قاعده هوند و اصل آفبا به درک صحیح از آرایش الکترونی عناصر در جدول تناوبی کمک شایانی می کند. در واقع، طریقه تشکیل جدول تناوبی به طور مستقیم به آرایش الکترونی اتم ها وابسته می باشد. بعد از مطالعات زیادی که بر روی رابطه میان آرایش الکترونی و جدول تناوبی عناصر انجام شد، نیلز بور مشخص کرد که آرایش الکترونی عناصر در یک گروه در جدول تناوبی با یکدیگر مشابه می باشند. اما با توجه به استثنا های بیان شده، می توان گفت که اصل آفبا تنها برای حالت پایه هجده عنصر اول در جدول تناوبی عناصر به خوبی عمل می کند و در ادامه، کارایی آن کاهش پیدا کرده است. در ادامه مقاله به بررسی دسته ها یا بلوک ها در جدول تناوبی عناصر و ارتباطشان با اصل آفبا خواهیم پرداخت.
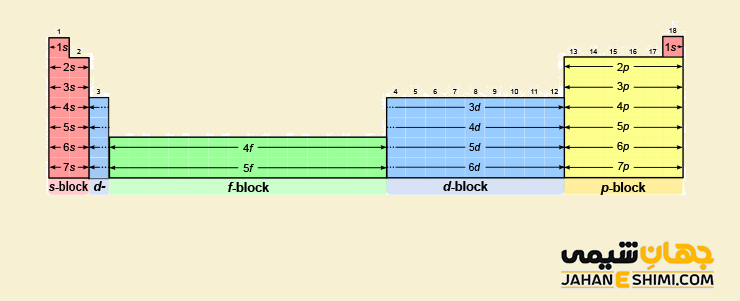
بلوک های جدول تناوبی
- عناصر دسته s: عناصری که زیر لایه s در آنها در حال پر شدن است. این بلوک شامل فلزات قلیایی و قلیایی خاکی می باشد که به ترتیب به نام گروه های ۱ و ۲ جدول تناوبی شناخته می شوند. توجه داشته باشید که هلیوم نیز در این دسته قرار می گیرد. در هر اوربیتال s حداکثر تعداد ۲ الکترون جای می گیرند.
- عناصر دسته p: عناصری که زیر لایه p در آنها در حال پر شدن است. این بلوک شامل گروه های ۱۳، ۱۴، ۱۵، ۱۶، ۱۷ و ۱۸ به غیر از اتم هلیوم می باشد. در هر اوربیتال p حداکثر تعداد ۶ الکترون جای می گیرند.
- عناصر دسته d: عناصری که زیر لایه d در آنها در حال پر شدن است. این بلوک شامل گروه های ۳، ۴، ۵، ۶، ۷، ۸، ۹، ۱۰، ۱۱ و ۱۲ می باشد. عناصر این دسته به نام عناصر واسطه نیز مشهورند. در هر اوربیتال d حداکثر تعداد ۱۰ الکترون جای می گیرند.
- عناصر دسته f: عناصری که زیر لایه f در آنها در حال پر شدن است. این بلوک شامل لانتانید ها و اکتینید ها می باشد. در هر اوربیتال f حداکثر تعداد ۱۴ الکترون جای می گیرند.