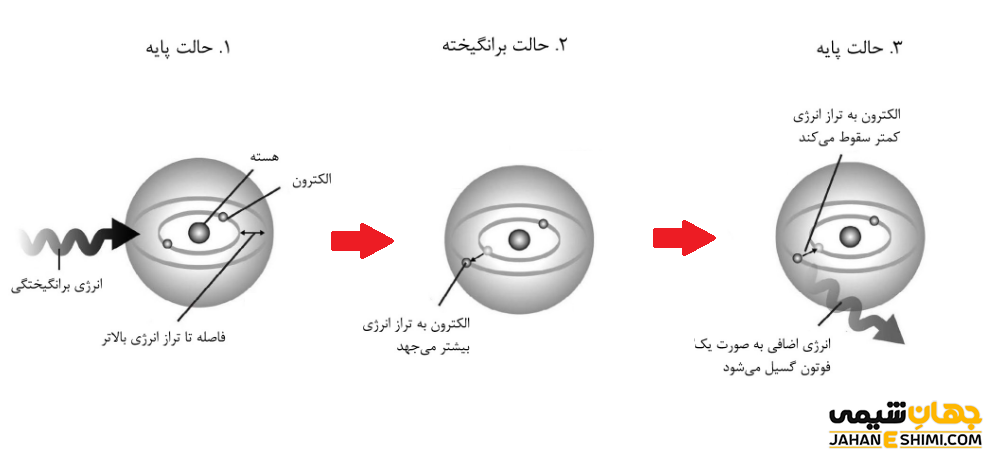
حالت برانگیخته اتم (Excited state) به حالتی گفته می شود که در آن، سیستم مورد نظر انرژی بیشتری از حالت پایه داشته باشد. در حقیقت، برانگیختگی به معنای افزایش انرژی یک سیستم نسبت به حالتی است که کمترین انرژی ممکن (حالت پایه) را دارد. در ادامه این مقاله در نشریه جهان شیمی فیزیک به بررسی حالت پایه و حالت برانگیخته اتم پرداخته می شود. لطفا با ما همراه باشید.
فهرست مطالب این مقاله
۱- مقدمه
۲- حالت پایه
۳- حالت برانگیخته
۴- مثال برای حالت برانگیخته
۴-۱- خطوط طیفی هیدروژن
مقدمه
لایه الکترونی، تراز الکترونی یا مدار الکترونی (Electron Shell) به لایه های اطراف هسته یک اتم گفته می شود. الکترون ها در این لایه ها به دور هسته اتم می چرخند. توجه داشته باشید که لایه های الکترونی در فاصله معین و مشخصی از هسته قرار گرفته اند. در هر لایه، تعداد ثابتی الکترون جای می گیرد. حال هر چه یک لایه از هسته فاصله بیشتری داشته باشد، یعنی دورتر باشد، می تواند الکترون های بیشتری را در خود بپذیرد. این لایه ها را می توان با شماره های ۱، ۲، تا ۷ نامگذاری کرد.
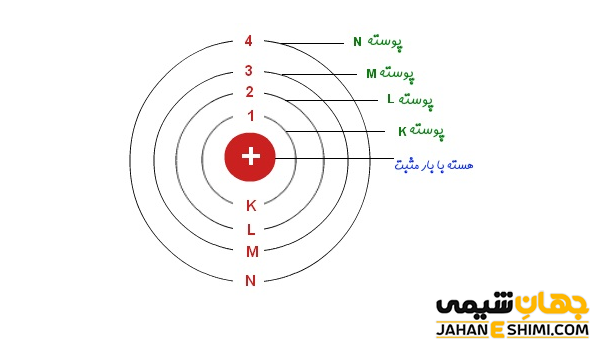
لایه اول که با عنوان لایه K نیز شناخته می شود، نزدیک ترین لایه به هسته اتم است. در این لایه حداکثر دو الکترون قرار می گیرد. لایه دوم، که لایه L نیز نامیده می شود، می تواند تا هشت الکترون را در خود جای دهد. لایه سوم و لایه چهارم به ترتیب به اسامی لایه M و لایه N مشهورند. توجه داشته باشید که لایه سوم تعداد حداکثر تا ۱۸ الکترون و لایه چهارم تا ۳۲ الکترون گنجایش دارند. به طور کلی تعداد الکترون های هر تراز الکترونی را می توان از طریق فرمول ۲n۲ بدست آورد. در این رابطه، n شماره تراز الکترونی است. همانطور که بیان شد، برای تمام اتم های شناخته شده در طبیعت بیش ترین مقدار n برابر ۷ خواهد بود.
جالب است بدانید که
انرژی الکترون ها کوانتیزه است، پس آنها به یک مدار انرژی مشخص وابسته اند. از این جهت یک الکترون نمی تواند بین دو مدار انرژی قرار بگیرد. حال هر چه الکترون در لایه پایین تر و در نتیجه نزدیک تر به هسته اتم جای بگیرد، انرژی بیش تری خواهد داشت. بنابراین الکترون های لایه آخر (لایه ظرفیت یا والانس)، کمترین انرژی را نسبت به سایر الکترون های اتم نشان می دهند. پس جدا کردن الکترون های لایه ظرفیت به انرژی کمتری نیاز دارد. لایه ظرفیت، آخرین لایه اصلی الكترونی یا در واقع آخرین سطح انرژی اتم است. ذکر این نکته مهم است که معمولا الکترون ها، مدار انرژی که به آن تراز پایه گفته می شود را اشغال می کنند. زمانیکه الکترون به لایه بالاتر برود، به آن لایه، تراز برانگیخته گفته می شود.
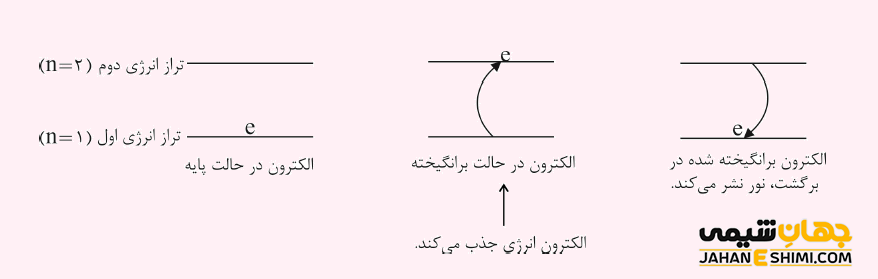
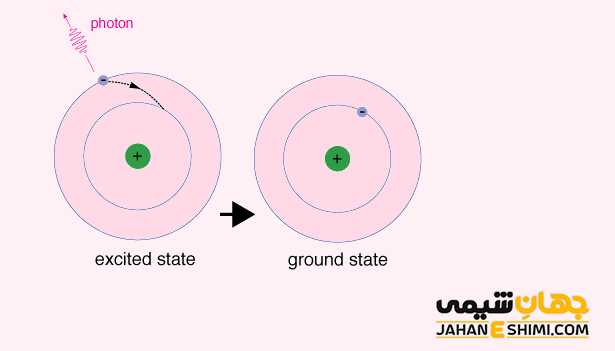
تفاوت میان الکترون های حالت پایه و حالت برانگیخته، کلید حل بسیاری از پدیده های فیزیک کوانتومی می باشد. زمانیکه یک الکترون از طریق جذب یک فوتون، انرژی می گیرد، برانگیخته شده و به سطح انرژی بالاتر جهش می کند. در حالیکه، اگر الکترونی انرژی از دست بدهد، انرژی به صورت فوتون گسیل کرده و به حالت انرژی پایینتر سقوط می کند. سوالی که اینجا مطرح می شود اینست که چرا یک الکترون سقوط می کند؟ تمامی ذرات تمایل دارند که به حالت پایه نزدیک تر باشند و پایدار شوند. از این رو، الکترون های برانگیخته، ذاتا ذراتی ناپایدار اند، پس انرژی اضافی خود را از دست می دهند تا لایه الکترونی پایین تر را اشغال کنند.
حالت پایه
در علم کوانتوم، حالت پایه (Ground state) یا حالت خلاء به حالتی گفته می شود که سیستم کمترین انرژی خود را دارد. در واقع در این حالت، الکترون های یک اتم در پایین ترین میزان انرژی ممکن قرار دارند. حال اگر سیستمی بیش از یک حالت پایه داشته باشد، آن سیستم را چندگانه می گویند. بر طبق قانون سوم ترمودینامیک، در دمای صفر مطلق، هر سیستمی در حالت پایه خود می باشد. بنابراین آنتروپی آنها در دمای صفر مطلق صفر خواهد بود. لازم به ذکر است که گذر از حالت پایه به حالت برانگیخته، درصورتی امکان پذیر است که الکترون ها به طریقی انرژی کسب نمایند. مقدار این انرژی باید بیشتر از اختلاف انرژی بین دو تراز باشد. چند نکته درباره حالت پایه وجود دارد که در ادامه به آنها می پردازیم.
- الکترون ها در حالت طبیعی و به خودی خود تمایلی به کسب انرژی ندارند. بنابراین می توان گفت که به یک لایه خاص تعلق دارند.
- طول عمر سیستم در حالت پایه بلندتر می باشد.
- تراز پایه انرژی پایینی دارد، پس یک حالت پایدار می باشد.
- در این تراز، الکترون ها کوانتوم انرژی یا همان فوتون جذب می کنند.
- تراز پایه هیج دسته بندی ای ندارد، به عبارت دیگر تنها یک تراز پایه وجود دارد.
- فاصله هسته ها در حالت پایه کمترین مقدار ممکن از یکدیگر است. یعنی در فازی که اکنون ماده قرار گرفته است، هسته ها تا جای ممکن به یکدیگر نزدیک و فشرده اند. حال اگر بیش از این به یکدیگر نزدیک شوند، ماده به فاز دیگری منتقل خواهد شد (مثلا از مایع به جامد).
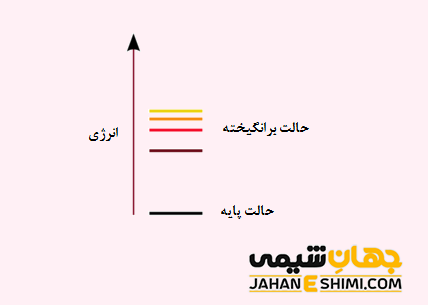
حالت برانگیخته
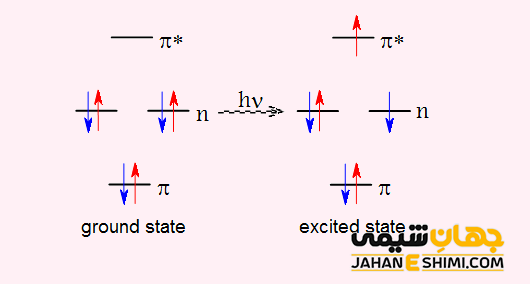
در علم کوانتوم، حالت برانگیخته یک سیستم (هسته، اتم یا مولکول) به هر حالت کوانتومی گفته می شود که انرژی آن بیشتر از انرژی حالت پایه باشد. در حالت برانگیخته، الکترون ها در لایه های انرژی بالاتر از لایه انرژی پایه قرار دارند. به عبارت دیگر می توان گفت که تمام الکترون ها در پایین ترین مدار انرژی خود به دور هسته نمی چرخند.
توجه داشته باشید که طول عمر سیستم در حالت برانگیخته بسیار کوتاه می باشد. از این رو، الکترون هایی که در تراز برانگیخته اند تمایل دارند که با آزاد کردن انرژی (فوتون) به تراز های انرژی برانگیخته پایین تر و یا به حالت پایه منتقل شوند. به عبارت دیگر، الکترون با ساطع کردن یک فوتون، انرژی اضافی خود را آزاد می کند. در این صورت به حالتی با انرژی پایین تر و یا حالت پایه خود بر میگردد که نتیجه آن تولید یک موج الکترومغناطیس خواهد بود. حال سیستمی را در نظر بگیرید که طول عمر این حالت های برانگیخته در آن زیاد باشد، به اینچنین سیستم هایی، شبه پایدار گفته می شود. حالت اکسیژن یگانه و ایزومر های هسته ای با طول عمر زیاد نموه هایی از این حالت های شبه پایدار می باشند.
توجه
چند نکته درباره حالت برانگیخته وجود دارد که در ادامه به آنها می پردازیم.
- همانطور که بیان شد، طول عمر تراز برانگیخته بسیار کوتاه می باشد. پس الکترون ها تمایل دارند هرچه سریعتر انرژی دریافتی را از دست بدهند تا اینکه انرژی جذب کنند.
- انرژی گرفته شده به صورت یک فوتون آزاد می گردد.
- تراز برانگیخته نسبت به تراز پایه از انرژی بیشتر و بالاتری برخوردار است، بنابراین از پایداری کمتری دارد.
- فاصله متوسط بین هسته ها در حالت برانگیخته نسبت به حالت پایه بزرگتر می باشد.
- الکترون ها به مدار هایی تعلق دارند که انرژی آن لایه ها برابر با انرژی الکترون ها باشد.
- بر خلاف حالت پایه، برای یک اتم چندین تراز برانگیخته وجود دارد. نزدیکترین تراز به هسته اتم را اولین تراز برانگیخته می نامند که نسبت به سایر تراز های برانگیخته انرژی پایین تری دارد. تراز برانگیخته بعدی را دومین تراز برانگیخته نام گذاری می کنند و به همین ترتیب ادامه می دهند.
مثال برای حالت برانگیخته
اتم هیدروژن را در نظر بگیرید. اتم هيدروژن تنها يك الكترون دارد و اين تک الكترون در پايين ترين تراز آن يعني تراز اول جای گرفته است که به اين حالت، حالت پايه هیدروژن مي گويند. زمانیکه اتم هيدروژن را گرم كنيد و یا به کمک جریان الکتریسیته الكترون آن تحريك شود، الکترون تحریک شده با جذب انرژي از تراز پايه به تراز هاي بالاتر مي رود که به اين حالت، حالت برانگيخته گفته می شود. توجه داشته باشید که حالت برانگیخته در واقع یعنی حالتی که عدد کوانتومی آن بالاتر از عدد کوانتومی حالت پایه (۱s) باشد. اما الكترون در لایه هاي بالاتر ناپايدار است، پس با آزاد كردن انرژي جذب شده، به لایه هاي پايين تر بر مي گردد. همانطور که قبلا بیان شد، اين بار انرژي كسب شده را به صورت تابش بر مي گرداند.
در صورتی که انرژی فوتون خیلی زیاد باشد، الکترون با دریافت این انرژی، از اتم جدا می شود و بدین شکل اتم به یون تبدیل می گردد. اگر الكترون از تراز اولیه i به تراز نهایی f جهش کند، به اندازه تفاوت انرژی بین اين دو تراز يعني به اندازه (Ef – Ei) انرژی می گیرد. در هنگام برگشت، اگر به همان تراز i برگردد، در نتیجه همان مقدار انرژی را نشر خواهد کرد. توجه داشته باشید که هرچه تفاوت انرژی میان دو لايه بيشتر باشد، انرژی نشر شده بيشتر و در نهایت طول موج آن كوتاه تر می باشد. طول موج تابش نشر شده در این گونه انتقالات را با استفاده از فرمول زير محاسبه می کنند.

خطوط طیفی هیدروژن
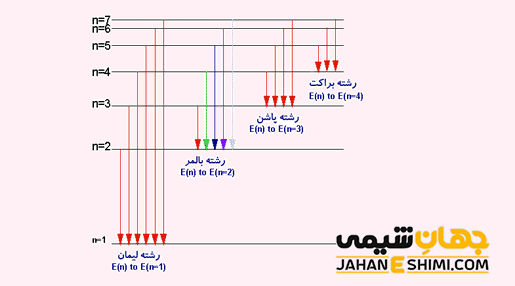
با توجه به اینكه الكترون به چه مداری قرار است برود، رشته های خاصی وجود دارد که عبارتند از :
- سری ليمان (nf → n۱)؛ از آنجاییکه در اين انتقال، برگشت به تراز اول انجام می شود، پس انرژی نور حاصله بسيار زیاد می باشد. در نتیجه طول موج آن اینقدر كوتاه است كه در منطقه نامرئی فرابنفش قرار می گيرد.
- سري بالمر (nf → n۲)؛ در اين سری، الكترون برانگيخته شده به تراز انرژی دوم بر می گردد. از این رو، انرژی و همچنین طول موج مربوط به اين انتقال در محدوده مرئی قرار گرفته و در نتیجه طيف آن قابل ديدن می باشد.
- سری پاشن (nf → n۳)؛ در اين سری، برگشت الكترون به تراز سوم انجام می شود. توجه داشته باشید که اختلاف انرژی در لایه های بالاتر كمتر می باشد. از این رو و با توجه به اختلاف انرژی پایین و طول موج بزرگ، اين انتقال در محدوده فرو سرخ قرار گرفته و در نتیجه طيف آن قابل رويت نمی باشد.
- سری براكت (nf → n۴)؛ در اين سری، برگشت الكترون به تراز چهارم انجام می شود. این سری نیز همانند سری ليمان در محدوده فرو سرخ قرار گرفته و در نتیجه طيف آن قابل رويت نمی باشد.
- سری پفوند (nf → n۵)؛ در اين سری، برگشت الكترون به تراز پنجم انجام می شود. این سری نیز همانند سری های قبل در محدوده فرو سرخ قرار گرفته و در نتیجه طيف آن قابل رويت نمی باشد.
جالب است بدانید که
همانطور که بیان شد، تنها طول موج امواج نشر شده حاصل از انتقال الكترون ها از تراز های ۳، ۴، ۵ و ۶ به لایه ۲ در ناحیه مرئی قرار می گيرند و قابل بررسی اند. اولین بار فيزيكدان سوئدی آنگستروم، توانست چهار طيف نشری خطی اتم هيدروژن را بررسی و مقدار دقيق طول موج هر خط را اندازه گيري کند. این چهار طیف مرئی را در جدول زیر مشاهده می کنید.
| نحوه تشكيل | طول موج (nm) | رنگ خط |
| ناشی از انتقال الكترون از تراز ۳ به تراز ۲ | ۶۵۶ | خط قرمز |
| ناشی از انتقال الكترون از تراز ۴ به تراز ۲ | ۴۸۶ | خط سبز |
| ناشی از انتقال الكترون از تراز ۵ به تراز ۲ | ۴۳۴ | خط آبی |
| ناشی از انتقال الكترون از تراز ۶ به تراز ۲ | ۴۱۱ | خط بنفش |



















