عنصر سزیم (Caesium) با نماد شیمیایی Cs، یکی از عناصر شیمیایی جدول مندلیف است که عدد اتمی آن ۵۵ می باشد. این عنصر در حقیقت پنجاه و پنجمین عنصر از جدول تناوبی بوده که در گروه IA و دوره ششم جدول قرار گرفته است. در واقع عنصر سزیم یک فلز نرم، براق و به رنگ طلایی- نقره ای است که از عناصر گروه فلزات قلیایی می باشد. این فلز با عناصر هیدروژن (H)، لیتیم (Li)، سدیم (Na)، پتاسیم (K)، روبیدیم (Rb)، و فرانسیم (Fr)، در گروه یک اصلی (خانواده لیتیوم) و بلوک s جدول تناوبی عناصر قرار گرفته است. در ادامه این مقاله در نشریه جهان شیمی فیزیک به بررسی عنصر سزیوم پرداخته می شود. لطفا با ما همراه باشید.
تاریخچه کشف عنصر سزیم
عنصر سزیم برای نخستین بار در سال ۱۸۶۰ میلادی، توسط شیمیدانان آلمانی به نام های گوستاو رابرت کیرشهف (Gustav Robert Kirchhoff) و رابرت بانسن (Robert Bunsen) کشف شد. سزیم اولین عنصری است که به وسیله تجزیه طیفی کشف شده است. هویت سزیم در حقیقت بر اساس خط آبی درخشانی که در طیف آن وجود داشت شناخته شد. از این جهت، واژه سزیم از کلمه یونانی سزیوس (caesius) به معنای آبی آسمانی گرفته شده است. بانسن با تبخیر کردن مقدار زیادی آب معدنی که دارای نا خالصی بود، توانست سزیم را استخراج کند. توجه داشته باشید که وی موفق به تهیه سزیم به صورت خالص نشد. در نهایت سزیم خالص در سال ۱۸۸۲ میلادی توسط شیمیدان آلمانی یعنی کارل ستربرگ (Carl Setterberg) و با روش الکترولیز کردن مذاب سزیم- باریم- سیانید بدست آمد.

پیدایش و منابع عنصر شماره ۵۵ جدول تناوبی
عنصر سزیم به دلیل واکنش پذیری شیمیایی بالایی که دارد، هرگز در طبیعت به صورت آزاد یافت نمی شود. این عنصر در سنگ معدنی پولوکس (پولوسیت) و لپدولیت یافت می شود. کانی پلوسیت در حقیقت هیدرات سیلیکات آلومینیوم و سزیم است. یکی از بهترین و غنی ترین منابع سزیم در دریاچه برنیک واقع در مونتیوبا می باشد. این عنصر را می توان با کمک الکترولیز سیانید گداخته و یا چندین روش دیگر جدا کرد. به عنوان مثال، به وسیله تجزیه حرارتی آزید سزیم، می توان سزیوم خالص و بدون گاز تهیه کرد.

ویژگی های فیزیکی و شیمیایی عنصر سزیم
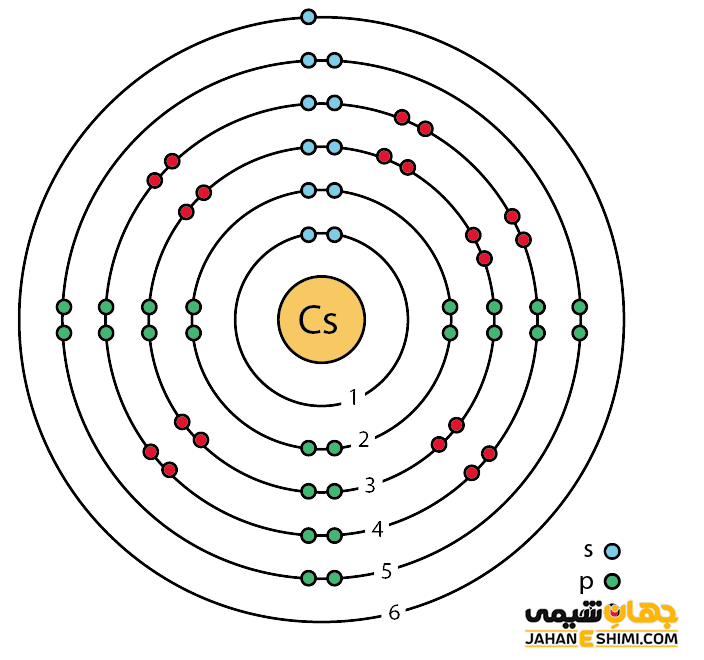
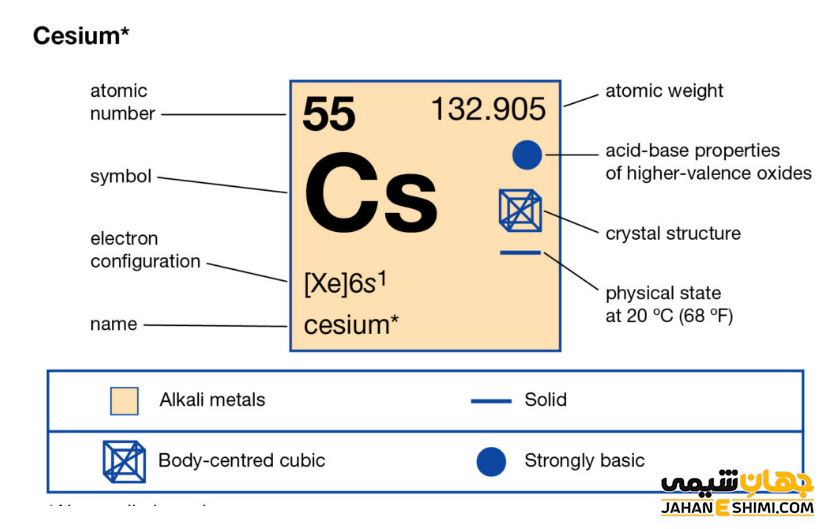
سزیم یک فلز شیمیایی بسیار فعال است. در واقع فعال ترین فلز جدول تناوبی محسوب می شود. خصوصیات قابل توجه سزیم از ساختار اتمی ([۵۴Xe] 6s۱) آن ناشی می شود. همانند دیگر فلزات قلیایی، تنها یک الکترون در دورترین لایه الکترونی سزیم وجود دارد. فاصله این تک الکترون تا هسته، نسبت به فاصله الکترون های نظیر در سایر فلزات قلیایی بیش تر است. بنابراین این الکترون لایه ظرفیت به آسانی جذب سایر اتم ها می شود. در نتیجه با توجه به ساختار الکترونی سزیوم انتظار داریم که این عنصر تک الکترون از دست داده تا به حالت اکتت یا پایدار خود برسد. در این صورت، به کاتیون با بار +۱ تبدیل می شود. پس عنصر شماره ۵۵ جدول تناوبی یک فلز یک ظرفیتی است. آزاد شدن تک الکترون باعث رنگ شعله در این عنصر است.
دقت داشته باشید که سزیم، فلزی نرم، موم مانند، چکش خوار با نقطه جوش، نقطه ذوب و چگالی پایین است. همچنین آنتالپی ذوب، تبخیر و تصعید نیز در این فلز پایین می باشد. این عنصر زمانیکه در زیر نقطه ذوب قرار دارد، جامد و نرم است. در حالیکه در دمای جزیی بالاتر از دمای اتاق تبدیل به مایع می شود. دقت داشته باشید که کمترین نقطه ذوب را در میان فلزات قلیایی دارد. از لحاظ شیمیایی شبیه به عناصر روبیدیم و پتاسیم می باشد. سزیم اگر در معرض هوای مرطوب قرار گیرد، خود به خود آتش می گیرد. علاوه بر آن، با اکسیژن، و هالوژن ها، گوگرد و فسفر به شدت واکنش می دهد. این واکنش ها با احتراق خود به خود و احتمال انفجار همراه است. با هالوژن ها هالید های فلزی سفید رنگ تشکیل می شود.
جالب است بدانید که
سزیم آب را تجزیه می کند. در این صورت هیدروژن آزاد می شود که بلافاصله نیز آتش می گیرد. به بیان دیگر، واکنش سزیم در آب سرد به صورت انفجاری است. این عنصر همچنین می تواند در دما های بالای ۱۱۶- درجه سلسیوس، نیز با یخ واکنش دهد. به علاوه، در واکنش با آب، هیدروکسید قلیایی تشکیل می شود، که باید مسایل ایمنی را در حمل و نقل آن در نظر گرفت. زیرا هیدروکسید سیزیم در حقیقت قوی ترین قلیای شناخته شده می باشد. به شکلی که می تواند شیشه را مورد حمله قرار دهد.
هنگامی که سزیم در آب انداخته شود، در واقع واکنشی دو مرحله ای انجام می گیرد. نتیجه این واکنش یک فرآیند انفجاری می باشد. در مرحله اول، فلز سزیوم با آب واکنش می دهد. با شکستن پیوند های هیدروژنی باعث تولید گاز هیدروژن می شود. حال در مرحله دوم، گرمای آزاد شده از مرحله قبل، گاز هیدروژن آزاد شده را شعله ور می کند. در واقع شعله دیده شده در بالای ظرف آب، نتیجه واکنش در مرحله دوم است. لازم به ذکر است که شدت آزاد شدن گاز هیدروژن به قدری است که می تواند باعث خرد شدن شیشه های آزمایش نیز گردد.

نکته جالب توجه
عنصر سزیم الکتروپوزتیو ترین و همچنین قلیایی ترین عنصر شیمیایی جدول تناوبی است. در عین حال، کمترین پتانسیل یونیزاسیون را در بین عناصر شیمیایی دارد. این عنصر به همراه عناصر گالیم و جیوه، فلزاتی محسوب می شوند که می توانند در دمای اطاق به حالت مایع باشند. این عنصر قابل مفتول شدن است. لازم به ذکر است که طیف الکترو مغناطیس آن، دارای دو خط روشن در ناحیه آبی و همچنین چندین خط دیگر در نواحی زرد، سبز و قرمز است. از لحاظ نیروی محرکه برقی، سزیم در بالاترین وضعیت قرار دارد. این عنصر دارای شعله ای بنفش رنگ است. سزیوم با مواد اکسید کننده نیز به شدت واکنش می دهد. همچنین این عنصر در اسید ها و الکل ها محلول است. از دیگر ویژگی های عنصر سزیوم می توان به موارد زیر اشاره کرد.
- حالت فیزیکی آن در دمای ۲۵ درجه سلسیوس و فشار ۱ اتمسفر به صورت جامد است.
- دمای ذوب و دمای جوش این عنصر به ترتیب ۲۸.۴۴ و ۶۷۱ درجه سانتی گراد است.
- عنصر سزیم پارا مغناطیس است.
- ساختار بلوری آن به شکل مکعبی مرکز پر (bcc) است.
- این عنصر آلوتروپ ندارد.
- جرم اتمی سزیم برابر با ۱۳۲.۹۰۵۴۵ g/mol است.
- چگالی آن نیز برابر با ۱.۹۳ g/cm۳ می باشد.
- شعاع اتمی آن نیز برابر با ۲۹۸ pm می باشد.
- یون های سزیم معمولا عدد اکسایش برابر با اعداد،۰ ، +۱ و -۱ را دارند. از این جهت به عنوان اکسید بازی بسیار قوی محسوب می شود. اعداد اکسایش ۰، و +۱ متداول تر می باشند.
- انرژی یونیزاسیون آن برابر با ۳۷۵.۷ kJ/mol است.
ایزوتوپ های عنصر سزیم
همانطور که در مقالات پیشین نشریه بیان شده است، ایزوتوپ های یک عنصر، تنها در تعداد نوترون ها با یکدیگر متفاوت اند. سزیمی که در طبیعت وجود دارد تنها دارای ایزوتوپ پایدار ۱۳۳Cs (100 %) می باشد. علاوه بر آن، تعداد زیادی ایزوتوپ پرتوزای سزیوم نیز شناخته شده است. به بیان دیگر، سزیوم دارای ۴۰ ایزوتوپ شناخته شده است. لازم به ذکر است که این تعداد ایزوتوپ، از تمامی عناصر دیگر بیشتر است. جرم اتمی این ایزوتوپ ها بین ۱۱۲ تا ۱۵۱ می باشد.
مهم ترین ایزوتوپ رادیواکتیو آن، ایزوتوپ پرتوزای ۱۳۷Cs است که نیمه عمر آن برابر با ۳۰/۱۷ سال می باشد. این رادیو ایزوتوپ، از انفجار سلاح های هسته ای و برون پاشی های نیروگاه های اتمی و راکتور های هسته ای تولید می گردد. این رادیوسزیم یکی از مشکل ساز ترین محصولات شکافت هسته ای محسوب می شود. زیرا به آسانی حرکت می کند. در طبیعت به خاطر حلالیت زیاد در آب یعنی نمک ها، گسترش می یابد. این رادیوایزوتوپ در اثر حادثه چرنوبیل در محیط پراکنده شده است. در واقع اروپای شرقی، کشور های مشترک المنافع و حتی قسمت هایی از استان اردبیل ایران را نیز تحت تاثیر قرار داده است.
کاربرد های عنصر سزیم
چشم گیر ترین کاربرد سزیم در تولید ساعت های بسیار دقیق اتمی است. این عنصر بیشتر در واکنش های ترمو شیمی، سوخت موشک ها و در لوله های خلا به عنوان گاز ربا مورد استفاده قرار می گیرد. همچنین در پیل های فتو الکتریک، به عنوان کاتالیزور برای هیدروژنه کردن ترکیبات آلی بکار می رود. سزیوم نیز همانند سایر عناصر گروه فلزات قلیایی، میل ترکیبی زیادی با اکسیژن دارد. بنابراین به عنوان گیرنده در لامپ های الکترونی استفاده می شود. این عنصر همچنین در باطری های نوری بکار گرفته می شود. علاوه بر آن، در چشمه های الکترونی به عنوان یک ماده شیمیایی الکترون دهنده کاربرد دارد.
در شیمی صنعتی نیز به عنوان کاتالیست از آن بهره می برند. از ایزوتوپ پرتوزای ۱۳۴Cs، به عنوان معیار سنجش خروجی سیزیوم به وسیله صنعت در آب شناسی استفاده می کنند. سزیم هیدروکسید (CsOH) برای اچ کردن سیلیکون استفاده شده است. به علاوه، از عنصر سزیم در سیستم رانش یونی استفاده می شود.

ترکیبات عنصر سزیم
عمده ترین ترکیبات سزیم کلرید و نیترات آن می باشند. این فلز در حقیقت یک عامل کاهنده فعال محسوب می شود. بنابراین می تواند به راحتی با هالوژن ها، اکسیژن و گوگرد واکنش دهد و هالید ها، اکسید و سولفید تولید نماید. علاوه بر آن، این عنصر می تواند آلکالید (alkalide) تشکیل دهد. آلکالید در واقع به یک ترکیب شیمیایی گفته می شود که در آن، اتم یک فلز قلیایی، بتواند یک آنیون با بار یا عدد اکسایش منفی یک (۱-) تشکیل دهد. آلکالید سزیم با نام سزید (Cs−) شناخته می شود. دیگر ترکیبات مهم سزیم عبارتند از :
- هیدروکسید سزیوم (CsOH)
- اکسید سزیوم (Cs۲O)
- کلرید سزیوم (CsCl)
- فلورید سزیم (CsF)
- یدید سزیم (CsI)
- برمید سزیم (CsBr)
- سزیم استات (C۲H۳CsO۲)
- سزیم کرومات (Cs۲CrO۴)
- نیترات سزیوم (CsNO۳)
- سزیم کربنات (Cs۲CO۳)
- سزیم بیکربنات (CsHCO۳)
- سزیم فرمات (Cs(HCOO))
- سزیم آئورید (AuCs)
- سزیم سیانید (CsCN)
- سزیم سولفات (Cs۲SO۴۳)
- سزیم سولفید (Cs۲S)
- تیتانات سزیم (Cs۲TiO۳)

خطرات سزیوم بر روی سلامتی انسان
ترکیبات سزیم در طبیعت به ندرت پیدا می شوند. این عنصر را می توان به شدت سمی در نظر گرفت. حتی تعدادی از رادیوایزوتوپ های آن بیشتر سمی هستند. به دلیل بمباران اتمی چرنوبیل، مقادیر کمی از سزیوم، در هوا، نوشیدنی ها و اکثر غذا ها وجود دارد. لازم به ذکر است که میزان سزیم موجود در هوا بسیار ناچیز است. اما به علت جذب تشعشعات رادیواکتیو به وسیله گیاهان، این عنصر در آب های سطحی و بسیاری از غذا ها وجود دارد.
اگر انسان در تماس با سزیوم رادیواکتیو قرار گیرد، این شخص نابودی سلولی را تجربه خواهد کرد. از علائم آن می توان به تهوع، اسهال، استفراغ و خونریزی اشاره کرد. حال اگر تماس در مدت زمان طولانی ادامه پیدا کند، فرد هوشیاری خود را کم کم از دست داده و در نهایت به کما می رود. این تماس طولانی می تواند منجر به مرگ گردد. میزان اثرات سو سزیوم، بستگی به مقاومت بدنی فرد، مدت زمان تماس و شدت تماس دارد.
طریقه نگهداری فلز سزیوم
از آنجاییکه فلز سزیم خالص با آب به شدت واکنش می دهد، پس می تواند به سرعت آتش بگیرد و به راحتی خطرات آتش سوزی را به همراه داشته باشد. به بیان دیگر، واکنش سزیوم در آب سرد، بسیار انفجاری خواهد بود. بنابراین برای جلوگیری از خطرات آن، باید حتما در سیالی با پایه نفت و پارافین نگهداری شود.