کاربرد عنصر یوروپیم چیست؟ خواص یوروپیوم را می شناسید؟

عنصر یوروپیم از عناصر شیمیایی جدول تناوبی بوده و با نماد شیمیایی Eu شناخته میشود. عدد اتمی عنصر یوروپیم ۶۳ و عدد جرمی آن ۱۵۱.۹۶۴ است. ویژگی و خواص عنصر یوروپیم منجر شده است تا این عنصر در گروه ۳ و تناوب ۶ جدول تناوبی عناصر جای بگیرد. عنصر یوروپیم از فلزات واسطه داخلی بوده و در دسته لانتانید ها قرار دارد. کاربرد عنصر یوروپیم نیز مانند سایر عناصر این دسته بوده و از عناصر کمیاب بشمار میآید. از خواص عنصر یوروپیم میتوان به رنگ سفید نقره ای آن اشاره کرد. ترکیبات عنصر یوروپیم نیز کاربرد هایی در موارد مختلف دارند. علاوه بر این ایزوتوپ عنصر یوروپیم نیز شناخته شده و در ادامه بررسی می گردد. برای شناخت بیشتر خواص عنصر یوروپیم می توان به بررسی مدل اتمی بور برای عنصر یوروپیم پرداخت. در ادامه با معرفی کاربرد عنصر یوروپیم با ما همراه باشید.
نشریه علمی جهان شیمی فیزیک به بررسی عناصر شیمیایی جدول تناوبی مندلیف پرداخته است. مانند: پرومتیم، ساماریم، و… . در ادامه برای شناخت بیشتر این عنصر واسطه داخلی از دسته لانتانید ها با ما همراه باشید.
پیشینه عنصر یوروپیم (یوروپیوم)
در سال ۱۹۰۱ در کشور فرانسه دانشمندی به نام یوگن دیمارکی موفق به کشف عنصر یوروپیوم شد. جالب است بدانید نام این عنصر از کلمه یوروپ به معنی اروپا گرفته شده است. یوگن توانست عنصر یوروپیم را از ماده ای که شامل مقادیر زیادی ساماریم بود جدا کند. این اکتشاف اعتبار زیادی برای این دانشمند به همراه داشت. توجه شود که از تولید عنصر یوروپیم به صورت خالص مدت زمان زیادی نمی گذرد. عنصر یوروپیم توسط دستگاه اسپکترومتر شناسایی شد.
منابع عنصر یوروپیم
این عنصر همراه با کانی های کمیاب غیر از لانتانیم یافت می شود. منابع عنصر یوروپیوم در کشور هایی مانند چین و ایالات متحده آمریکا یافت می شود. باستانزیت و مونازیت از منابع اصلی عنصر یوروپیوم هستند. این عنصر درخورشید و ستاره ها وجود دارد.
تولید
امروزه تولید عنصر یوروپیوم توسط مخلوط Eu۲O۳ با ۱۰ درصد فلز لانتانیم و گرمایش تانتالیم در خلا تولید می گردد. این عنصر با روش های تبادل یونی و فرایند های خاص تولید می شود.
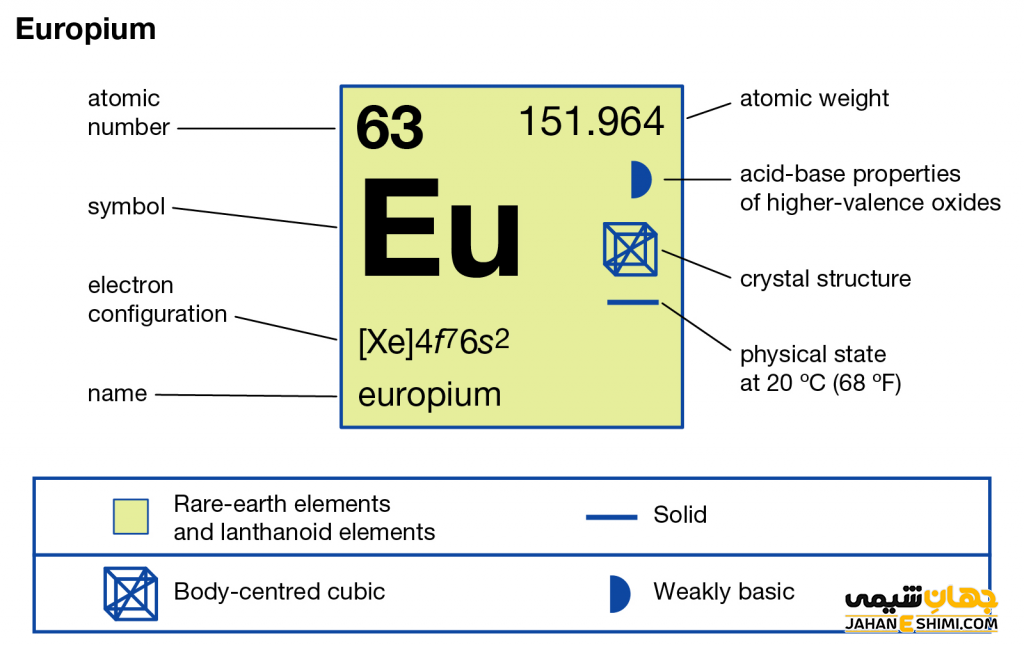
ویژگی عنصر یوروپیم عنصر شماره ۶۳ جدول تناوبی
- عدد اتمی: ۶۳
- جرم اتمی: ۹۶/۱۵۱
- گروه: ۳
- دوره (تناوب): ۶
- بلوک: بلوک-f
- نقطه ذوب: ۸۲۶ درجه سانتی گراد
- نقطه جوش: ۱۵۲۹ درجه سانتی گراد
- شعاع اتمی: ۱۸۰ pm
- رنگ: سفید نقره ای
- حالت استاندارد: در دمای ۲۹۸ درجه کلوین جامد
- نام گروه: لانتانیدها
- چگالی: ۵.۲۶۴ گرم بر سانتی متر مکعب
- آنتالپی تبخیر: ۱۷۶ KJ/mol
- الکترونگاتیویته: ۱.۲ مقیاس پائولینگ
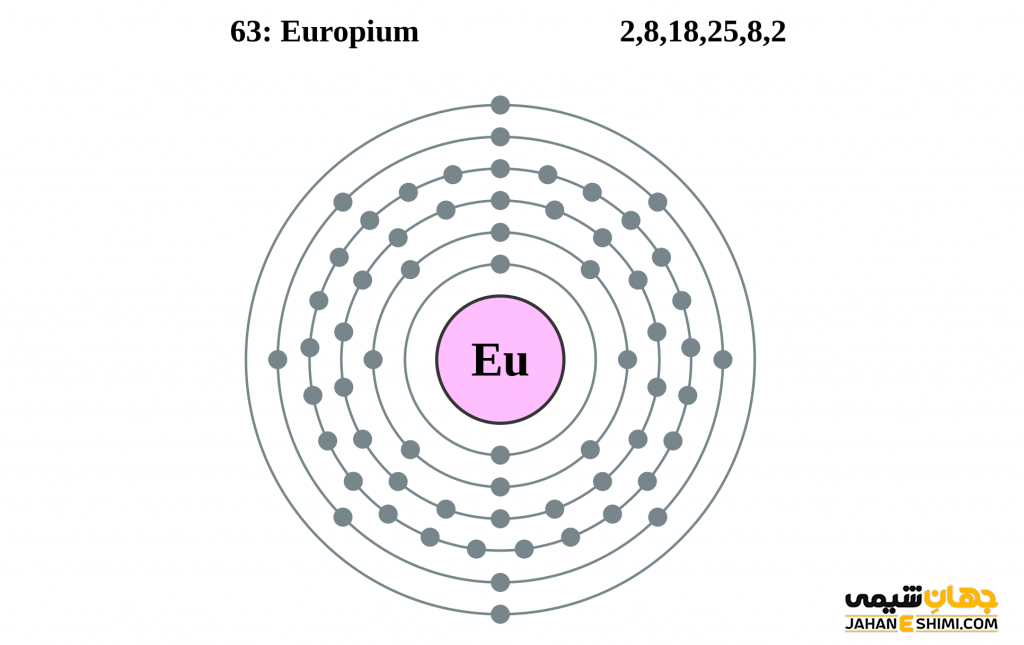
- آرایش الکترونی: [Xe] 4f۷ ۶s۲
خواص عنصر یوروپیم (یوروپیوم)
عنصر یوروپیوم (Europium) با نشان (نماد) شیمیایی Eu و عدد اتمی ۶۳، عنصری از جدول تناوبی در دسته فلزات واسطه داخلی است. عنصر یوروپیم (یوروپیوم) عنصر شماره ۶۳ جدول تناوبی مندلیف بوده و خواصی مشابه سایر لانتانید ها دارد. یکی از کمترین عناصر نادر زمین عنصر یوروپیم است. مقدار این ماده تقریبا به اندازه عنصر قلع است. این ماده در طبیعت هرگز به عنوان عنصر آزاد یافت نشده است. از خواص عنصر یوروپیوم می توان به رنگ سفید نقره ای آن اشاره نمود. این عنصر در هوا با درجه حرارت حدود ۱۵۰ تا ۱۸۰ درجه سانتی گراد قابل اشتعال بوده و شبیه کلسیم با آب واکنش می دهد. لازم به ذکر است که از خواص عنصر یوروپیوم می توان به خواص رادیواکتیوی بالای این ماده اشاره نمود.
فلزات واسطه داخلی (لانتانید ها)
لانتانید ها عناصری شیمیایی در جدول تناوبی مندلیف هستند. عناصر این دسته از فلزات داخلی از عدد اتمی ۵۷ تا عدد اتمی ۷۱ است. این عناصر فلزاتی براق با واکنش پذیری بالا هستند. این عناصر خواصی مشابه لانتان ۵۷ دارند. عناصر این گروه نمک های سه ظرفیتی محلول در آب با خواص شیمیایی یکسانی ایجاد می کنند. این عناصر قابل احیا شدن نیز هستند. با استفاده از اثر کلسیم و لیتیم بر هالید بدون آب این کار صورت می پذیرد. در مرحله بعد آن را در خلأ ذوب مجدد نموده و باقیمانده مواد احیا کننده تبخیر می شود. همچنین آن ها را می توان از حمام های نمک ذوب شده به صورت الکترولیتی نیز احیا کرد. همچنین لانتانید ها می توانند با بعضی ترکیبات آلی املاح آلی تشکیل دهند.
اولین اعضای لانتانید ها که به صورت اکسید جمع آوری شد شبیه به اکسید های کلسیم و منیزیم (بعد ها در گروه فلزات قلیایی خاکی قرار گرفتند) بود. علت این نامگذاری همین شباهت بود. لانتانید ها خاک های کمیاب نیز نام گرفته اند. لانتانید ها به صورت کانی هایی چون مونازیت، زنوتیم و گادولینیت در طبیعت یافت می شوند.
ایزوتوپ عنصر یوروپیم
عنصر یوروپیوم دارای ۲ ایزوتوپ پایدار ۱۵۱Eu و ۱۵۳Eu است. در این میان ایزوتوپ یوروپیم ۱۵۳Eu با فراوانی طبیعی ۵۲٫۲٪ فراوان ترین ایزوتوپ این عنصر بشمار می آید. هفده ایزوتوپ از این ماده شناسایی شده است. ایزوتوپ عنصر یوروپیم جذب کننده خوب نوترونی است و برای مطالعه کنترل هسته ای استفاده می شود.
ترکیبات عنصر یوروپیم
Eu(II): سولفید یوروپیم (II)، EuBr۲
Eu(III): EuBr۳، کلرید یوروپیم (III)، اکسید یوروپیم (III) Eu(NO3)۳، یوروپیم باریم تیتانات.
ترکیبات آلی: Eu(C۵H۷O۲)۳
اکسید یوروپیم (III) (Europium(III) oxide) با فرمول شیمیایی Eu۲O۳ یکی از ترکیبات شیمیایی این ماده است. جرم مولی این ترکیب ۳۵۱٫۹۲۶ گرم بر مول میباشد. شکل ظاهری این ترکیب به صورت پودر سفید رنگ است.
یوروپیوم تری کلراید یک ترکیب غیر آلی است. این ماده در حالت خشک به صورت پودری کرم رنگ وجود دارد. این ترکیب شیمیایی در حضور رطوبت به سرعت آن را جذب کرده و یک هگزا هیدرات کریستالی سفید ایجاد می کند که بی رنگ است. تری کلراید یوروپیوم در تحقیقات صنعتی و دانشگاهی کاربرد فراوانی دارد. این ماده، واکنش پذیری بالایی داشته و اغلب به عنوان پیش ماده سایر ترکیبات عنصر یوروپیم کاربرد دارد.
همان طور که گفته شد کلرید یوروپیوم (III) پیش ماده دیگر ترکیبات یوروپیوم است. بنابراین اهمیت بالایی دارد. این ماده را می توان از طریق متاتز نمک با لیتیم بیس (تری متیل سیلیل) آمید به فلز بیس (تری متیل سیلیل) آمید تبدیل کرد. واکنش در THF انجام گرفته و نیاز به رفلاکس دارد.
کاربرد عنصر یوروپیم
از نوار برجسته درخشان با کاربرد عنصر یوروپیم به عنوان علامت ضد جعل بر روی یورو و سایر پول ها استفاده می شود.
کاربرد عنصر یوروپیم به علاوه فسفر در صفحه های نمایشگر خلبانی، تلویزیون (قرمز-نارنجی) و نورهای فلورسنس سه رنگ(قرمز، نارنجی، آبی).
کاربرد عنصر یوروپیوم به شکل EuB۶ نوترون ها را در راکتور های هسته ای زاینده جذب کرده و عملیات شکافت هسته را کنترل می نماید.
اکسید یوروپیوم کاربرد گسترده ای در فعال سازی فسفر و وانادات ایتریم داراست.
کاربرد عنصر یوروپیوم برای تولید کاتالیزور ها و صیقل دادن شیشه نیز مناسب است. درواقع کاربرد های این ماده در حال افزایش است.
اثرات خواص عنصر یوروپیم در سلامتی
وجود در محیط های کار خطرناک است. ممکن است گاز آن با هوا استنشاق شده و باعث انسداد ریه شود. اگر استنشاق برای مدتی طولانی صورت گیرد، اثرات مخرب بر سلامتی بیشتر خواهد بود. عنصر یوروپیوم می تواند باعث ایجاد سرطان در انسان شده و استنشاق این ماده احتمال بروز سرطان را افزایش می دهد.
این ماده در صورتی که در بدن انسان تجمع یابد می تواند برای کبد هم خطرناک باشد. اثرات زیست محیطی یوروپیوم به طرق مختلف و عمدتا توسط صنایع در محیط پراکنده می شود. با دور ریختن لوازم منزل نیز مقداری یوروپیم وارد محیط زیست می شود. یوروپیم در خاک تجمع یافته و در نهایت غلظت آن در بدن انسان، جانوران و ذرات خاک افزایش خواهد یافت.
این ماده در جانوران آبزی باعث آسیب غشای سلولی می شود. این ماده می تواند روی تولید مثل و عملکرد سیستم عصبی اثرات منفی داشته باشد.
عنصر یوروپیم نقش بیولوژیکی خاصی ندارد. ترکیبات عنصر یوروپیم مانند نمک های یوروپیم به صورت خوراکی به سادگی می توانند سمی باشند. توجه شود که مسمومیت این ترکیبات به طور کامل بررسی نشده است.

اثرات زیست محیطی یوروپیم
عنصر یوروپیوم تهدید خاص زیست محیطی برای گیاهان یا حیوانات ایجاد نمی کند. اما گرد و غبار فلزی آن باعث ایجاد آتش و خطر انفجار می شود.
سخن آخر
عناصر شیمیایی مختلفی در جدول تناوبی مندلیف قرار گرفته اند که هر یک از آن ها کاربرد های ویژه ای دارند. عناصر شیمیایی از لحاظ خواص فیزیکی و شیمیایی با یکدیگر متفاوتد. معمولا عناصری که در یک گروه از جدول تناوبی قرار گرفته اند خواص مشابهی نیز دارند. برای شناخت بیشتر عناصر می توان به جدول تناوبی مندلیف مراجعه نمود و گروه ها و دوره های جدول تناوبی عناصر را بررسی نمود. در این جدول تمام عناصر جایگاه مخصوص به خود را دارا هستند. با شناخت بهتر خواص عناصر جدول تناوبی می توان بهتر به کاربرد و ویژگی مختلف عناصر پی برد. درواقع کاربرد صنعتی و سلامت و پزشکی و کشاورزی و… عناصر جدول تناوبی، تنها با شناخت دقیق آن ها امکان پذیر است.
دانشمندان تلاش های بسیاری در شناخت هرچه بیشتر این عناصر داشته اند. عناصری که در جدول تناوبی قرار گرفته اند، حالت های مختلفی را دارا هستند. برخی از این عناصر فلز و برخی نافلز و برخی هم شبیه فلزند. برخی از عناصر شیمیایی حالت گازی و برخی دیگر حالت جامد دارند. بنابراین بررسی و شناسایی دقیق این عناصر امری ضروری بشمار می آید.
به دلیل اهمیت بالای شناخت این عناصر در زندگی روزمره نشریه جهان شیمی فیزیک به توضیح و بررسی آن ها پرداخته است. برای آشنایی با خواص و کاربرد و تاریخچه عناصر شیمیایی جدول تناوبی می توانید به سایت نشریه علمی جهان شیمی فیزیک مراجعه کرده و اطلاعات خود را در این زمینه افزایش دهید.