هر آنچه باید در مورد اجزای تشکیل دهنده محلول بدانید
محلول ها مخلوطی همگن از دو یا چند ماده به صورت هموژن هستند. معمولا محلول ها را مایعی در نظر می گیرند که جامد یا مایع یا گاز در آن حل شده است. این تعریف خیلی درست نیست زیرا ما می توانیم محلول های جامد مانند آلیاژها را داشته باشیم.
مثلا هوا مخلوطی همگن از تعدادی گاز است. دو ماده اصلی تشکیل دهنده گازها اکسیژن (۲۱%) و نیتروژن (۷۸%) هستند. آلیاژها مخلوطی همگن از فلزات هستند که آنها را نمی توان با روش های فیزیکی به اجزای جداگانه خود تفکیک کرد. صرف نظر از آن، آلیاژ به عنوان یک مخلوط در نظر گرفته می شود زیرا می تواند ویژگی های اجزای تشکیل دهنده خود را نشان دهد و می تواند ترکیب متغیری داشته باشد. در ادامه مقاله در نشریه جهان شیمی فیزیک توضیحات بیشتری در این رابطه ارائه می گردد لطفا همراه ما باشید.
اجزای تشکیل دهنده محلول را نام ببرید
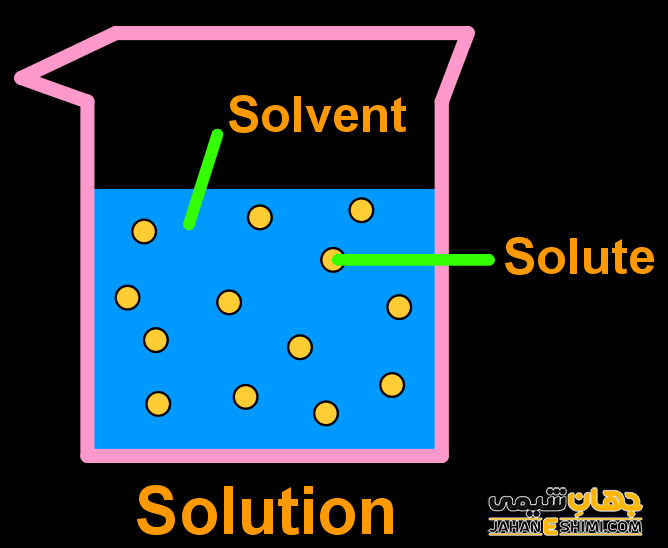
موادی که محلول همگن را تشکیل می دهند اجزای محلول نامیده می شوند. اجزای تشکیل دهنده محلول اساسا محلول دارای دو جزء است یعنی یک حلال و یک حل شونده.
حلال
به جزئی از محلول که جزء دیگر را در خود حل کند حلال می گویند. یک حلال جزء بزرگتر محلول را تشکیل می دهد. به عنوان مثال، محلول شکر در آب، شکر محلول و آب حلال است.
املاح
املاح یکی از اجزای تشکیل دهنده محلول هستند به عبارت دیگر به جزئی از محلول که در حلال حل می شود، املاح می گویند. املاح جزء کوچکتر محلول است. به عنوان مثال، محلولی از ید در الکل که به عنوان تنتور ید شناخته می شود، ید محلول حل شده است. به طور مشابه، در نوشیدنی های گازدار، گاز دی اکسید کربن محلول است.
ویژگی های محلول ها
- محلول یک مخلوط همگن است
- اندازه ذرات املاح در محلول ها بسیار کوچک است. قطر آن کمتر از ۱ نانومتر است.
- ذرات محلول را حتی با میکروسکوپ هم نمی توان دید.
- ذرات یک محلول از کاغذ صافی عبور می کنند. بنابراین فیلتراسیون نمی تواند محلول را جدا کند.
- بسیار پایدار است. ذرات املاح موجود در محلول در هنگام نگهداری از هم جدا نمی شوند.
- یک محلول واقعی نور را پراکنده نمی کند (زیرا ذرات آن بسیار کوچک هستند).
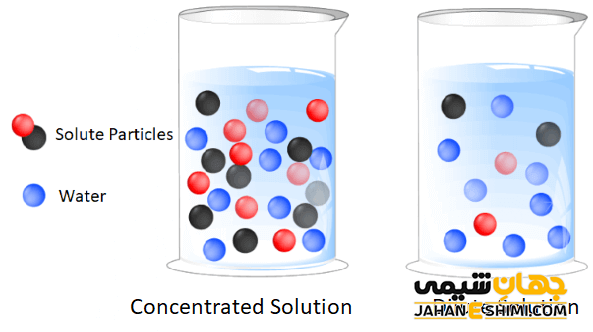
غلظت یک محلول
غلظت یک محلول مقدار املاح موجود در مقدار معینی از آن است. بسته به مقدار املاح موجود، آن را محلول رقیق، غلیظ یا اشباع می نامند. مواد مختلف در یک حلال معین حلالیت های متفاوتی در یک دما دارند. متداول ترین روش برای بیان غلظت محلول روش درصد است. غلظت محلول ها به درصد املاح موجود در محلول ها اشاره دارد. درصد املاح را می توان بر حسب دو کمیت زیر بیان کرد:
غلظت محلول ها بر حسب جرم املاح
اگر محلول ها دارای املاح جامد محلول در مایع باشند، در محاسبه غلظت محلول ها «درصد جرمی املاح» را در نظر می گیریم. بنابراین، در مورد یک املاح جامد حل شده در یک حلال مایع، درصد جرمی محلول ها با درصد جرم املاح در ۱۰۰ گرم حلال به دست می آید.
غلظت جرم بر حسب درصد حجم محلول
درصد جرم حجمی یک املاح، درصدی از جرم املاح موجود در حجم مخصوص حلال است. بسته به واحد جرم و حجم، درصد جرم بر حسب حجم املاح موجود در محلول ها می تواند واحدهایی مانند گرم در میلی لیتر یا گرم در لیتر داشته باشد.
حلالیت املاح
حلالیت مقدار ماده حل شده (بر حسب گرم) است که در ۱۰۰ گرم آب (حلال) در دمای معین حل می شود.
انواع محلول ها را نام ببرید
محلول های اشباع: محلول های اشباع محلول هایی هستند که به همان اندازه املاح را در یک دمای معین حل می کنند.
محلولهای غیراشباع: محلولهای غیراشباع محلولهایی هستند که مقدار املاح کمتری نسبت به مقدار مورد نیاز ما برای اشباع دارند. گاهی اوقات با اعمال نیروهای خارجی مانند انرژی گرمایی می توان حلالیت املاح را در محلول ها افزایش داد.
محلول های فوق اشباع: محلول های فوق اشباع دارای املاح بیشتری نسبت به محلول های اشباع هستند.
اجزای محلول الکل ۷۰ درصد
حلال ماده ای است که جز اصلی محلول را تشکیل می دهد و مقدار آن بطورکلی از حل شونده بیشتر است. در الکل ۷۰ درصد اجزای تشکیل دهنده محلول ۳۰ درصد آب و ۷۰ درصد الکل است.
اجزای محلول آب و شکر
اجزای محلول آب و شکر همانطور که از نام آن پیداست آب و شکر است که با مقادیر مختلفی مخلوط شده و محلول هایی با درصدهای مختلف تشکیل می دهند.
مثال برای محلول
می دانیم که محلول مخلوطی همگن از دو یا چند ماده است. در یک محلول به جزئی که به مقدار کمتر (از نظر وزنی) وجود دارد، املاح و جزئی که به مقدار بیشتر (از نظر وزنی) وجود دارد، حلال نامیده می شود. املاح به طور یکنواخت در سراسر حلال توزیع می شود و بنابراین مخلوط همگن می شود. بنابراین، حلال به عنوان یک محیط حل کننده در یک محلول عمل می کند. فرآیند توزیع یکنواخت املاح در حلال را انحلال می نامند.
یک محلول حداقل باید از دو جزء (یک املاح و یک حلال) تشکیل شده باشد. به محلول هایی که از یک املاح و یک حلال (دو جزء) تشکیل شده اند، محلول های دوتایی می گویند. به عنوان مثال، با افزودن کریستال های سولفات مس به آب، در آب حل می شود و محلولی از سولفات مس تشکیل می دهد. این محلول شامل دو جزء است یعنی یک املاح – سولفات مس و یک حلال – آب.
به طور مشابه، یک محلول ممکن است بیش از دو جزء داشته باشد. به عنوان مثال اگر نمک و شکر به آب اضافه شود، هر دو در آب حل می شوند و محلولی تشکیل می دهند. در اینجا دو محلول در یک حلال حل می شوند. این نوع محلول ها که دارای سه جزء هستند محلول های سه تایی نامیده می شوند.
محلول های آبی، محلول های غیر آبی، محلول های غلیظ و محلول های رقیق برخی از انواع محلول های اصلی هستند. نفت، تتراکلرید کربن، محلول گوگرد در کربن دی سولفید، آب نمک، محلول نفتالن در بنزن، محلول الکل ۶۰% یا محلول آب شکر مثال هایی از محلول ها هستند.
عوامل موثر بر حلالیت اجزای تشکیل دهنده محلول
حلالیت بیشتر مواد به شدت به دما و در مورد گازها به فشار بستگی دارد. حلالیت اکثر املاح جامد یا مایع با افزایش دما افزایش می یابد. اجزای یک مخلوط را اغلب می توان با استفاده از کریستالیزاسیون کسری که ترکیبات را بر اساس حلالیت آنها جدا می کند، جدا کرد. حلالیت گاز با افزایش دما کاهش می یابد.
خواص محلول ها
محلولها احتمالا خواصی شبیه به اجزای اصلی خود – معمولا حلال – دارند. با این حال، برخی از خواص محلول به طور قابل توجهی با خواص حلال متفاوت است. در اینجا، ما بر روی محلول های مایعی که دارای املاح جامد هستند، تمرکز خواهیم کرد، اما بسیاری از اثراتی که در این بخش به آنها خواهیم پرداخت، برای همه محلول ها قابل استفاده است.
خواص کولیگاتیو
املاح بر برخی از خواص محلول ها تاثیر می گذارد که فقط به غلظت ذرات محلول بستگی دارد. به این اثر ویژگی های جمعی یا کولیگاتیو می گویند. چهار ویژگی مهم جمعی که در اینجا بررسی خواهیم کرد عبارتند از کاهش فشار بخار، افزایش نقطه جوش، فرورفتگی نقطه انجماد و فشار اسمزی.
ترکیبات مولکولی وقتی حل می شوند به مولکول های مجزا تبدیل می شوند، بنابراین به ازای هر ۱ مول مولکول حل شده، ۱ مول ذره به دست می آید. در مقابل، ترکیبات یونی هنگام حل شدن به یون های تشکیل دهنده خود تجزیه می شوند، بنابراین ۱ مول از یک ترکیب یونی بیش از ۱ مول ذرات محلول تولید می کند. به عنوان مثال، هر مول NaCl که حل می شود، ۱ مول یون Na+ و ۱ مول یون کلر به دست می دهد که در مجموع ۲ مول ذره در محلول است. بنابراین، تاثیر روی خواص محلول با حل کردن NaCl ممکن است دو برابر تاثیر حل کردن همان مقدار مول گلوکز (C6H12O6) باشد.

کاهش فشار بخار
همه مایعات تبخیر می شوند. در واقع، با توجه به حجم کافی، یک مایع به طور کامل به بخار تبدیل می شود. اگر حجم کافی وجود نداشته باشد، یک مایع فقط تا جایی تبخیر میشود که سرعت تبخیر برابر با سرعت متراکم شدن بخار به مایع باشد. فشار بخار در این نقطه فشار بخار مایع نامیده می شود.
وجود یک جامد محلول، فشار بخار مشخصه یک مایع را کاهش میدهد به طوری که آهسته تر تبخیر می شود. (استثناء وقتی است که خود ماده حل شونده مایع یا گاز باشد، در این صورت املاح نیز به فرآیند تبخیر کمک می کند. این ویژگی کاهش فشار بخار نامیده می شود
اثرات نقطه جوش و نقطه انجماد
یکی از ویژگی های مربوط به محلول ها این است که نقطه جوش آنها بالاتر از نقطه جوش حلال خالص است. از آنجایی که وجود ذرات املاح باعث کاهش فشار بخار حلال مایع می شود، دمای بالاتری برای رسیدن به نقطه جوش مورد نیاز است. به ازای هر مول ذرات حل شده در یک لیتر آب، نقطه جوش آب حدود ۰.۵ درجه سانتی گراد افزایش می یابد.
وجود ذرات املاح بر نقطه انجماد محلول اثر معکوس دارد. هنگامی که یک محلول یخ می زند، فقط ذرات حلال به هم می رسند و یک فاز جامد را تشکیل می دهند و وجود ذرات املاح در این فرآیند اختلال ایجاد می کند. بنابراین برای یخ زدن حلال مایع باید انرژی بیشتری از محلول خارج شود که باعث کاهش دما می شود. بنابراین، محلولها نقطه انجماد کمتری نسبت به حلالهای خالص دارند. به ازای هر مول ذرات در یک لیتر آب، نقطه انجماد حدود ۱.۹ درجه سانتی گراد کاهش می یابد.
هر دو افزایش نقطه جوش و کاهش نقطه انجماد کاربرد عملی دارند. به عنوان مثال، محلول های آب و اتیلن گلیکول (C2H6O2) به عنوان خنک کننده در موتورهای خودرو استفاده می شود، زیرا نقطه جوش چنین محلولی بیشتر از ۱۰۰ درجه سانتی گراد، نقطه جوش معمولی آب است.
در زمستان، نمک هایی مانند NaCl و CaCl2 روی زمین می پاشند تا یخ را ذوب کنند یا از تشکیل یخ در جاده ها و پیاده روها جلوگیری کنند. زیرا محلول حاصل از حل کردن کلرید سدیم یا کلرید کلسیم در آب دارای نقطه انجماد کمتری نسبت به آب خالص است، بنابراین از تشکیل یخ جلوگیری می شود.



















