واکنش فریدل کرافتس چیست؟ – مکانیسم و محدودیت های آن
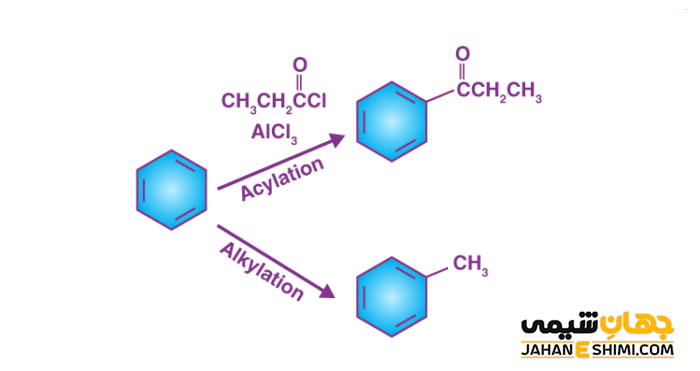
واکنش فریدل کرافتس نمونه ای از واکنش های جانشینی الکتروفیلی است که در آن یک گروه استخلافی، روی حلقه آروماتیک قرار می گیرد. واکنش فریدل کرافتس به دو نوع آلکیلاسیون و آسیلاسیون تقسیم می شود که در نوع اول، گروه آلکیل و در نوع دوم گروه آسیل به عنوان استخلاف به حلقه آروماتیکی افزوده می شود. در این واکنش با ایجاد پیوند کربن – کربن، گروه های استخلافی که گفته شده جانشین هیدروژن در حلقه آروماتیک می شوند. با مطالعه این مقاله نشریه جهان شیمی فیزیک با واکنش فریدل کرافتس به طور مختصر آشنا می شویم.
انواع واکنش های شیمیایی
واکنش های شیمیایی می تواند به صورت انواع مختلف جانشینی هسته دوستی، جانشینی الکتروفیلی، حذفی هسته دوستی و حذفی الکتروفیلی انجام شود. در جانشینی هسته دوستی یک اتم یا گروه اتم های هسته دوست جانشین اتم یا گروهی از اتم ها در ترکیب واکنش دهنده می شود. این نوع از واکنش ها با دو مکانیسم دو مولکولی و یا تک مولکولی انجام می شود. در نوع دو مولکولی گروه هسته دوست و گروه ترک کننده به طور همزمان به ترکیب، اضافه و حذف می شوند. به این واکنش ها که در یک مرحله انجام می شود، هسته دوستی درجه دوم نیز می گویند. اما در واکنش های هسته دوستی یک مولکولی، یک مولکول در مرحله تعیین کننده سرعت دخالت دارد. به این واکنش ها، هسته دوستی درجه یک نیز می گویند.
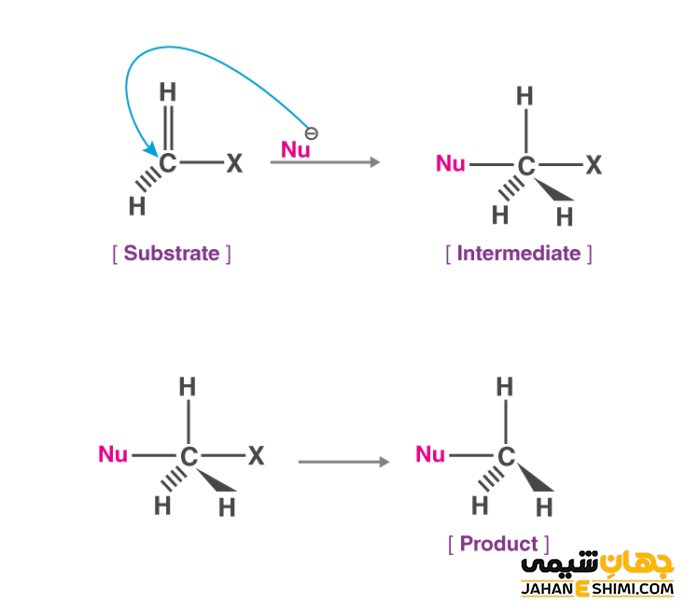
در واکنش های جانشینی الکتروفیلی، به جای نوکلئوفیل و هسته دوست، گروه الکتروفیل یا الکترون دوست جانشین گروه ترک کننده می شود. واکنش های حذفی نیز نوعی از واکنش ها هستند که یک گروه استخلافی از یک مولکول حذف می شود. این نوع از واکنش ها نیز به صورت یک یا دو مرحله ای انجام می شوند.
واکنش های جانشینی الکتروفیلی آروماتیک
در واکنش های جانشینی الکتروفیلی در حلقه بنزنی، اتم یا گروه های اتمی به عنوان استخلاف جایگزین اتم هیدروژن در ساختار حلقه بنزنی می شود. چون تمام ۶ اتم هیدروژن در ساختار حلقه بنزنی دارای موقعیت یکسانی هستند، استخلاف جایگزین هر کدام از این هیدروژن ها شود، محصول یکسانی به دست می آید. این نوع از واکنش ها که الکتروفیل جایگزین یک هیدروژن می شود، دارای مکانیسم دو مرحله ای هستند.
مکانیسم واکنش جانشینی الکتروفیلی در حلقه آروماتیک
در مرحله اول گروه الکتروفیل (اتم یا گروهی از اتم ها) به عنوان یک الکترون دوست با اتصال به حلقه آروماتیکی، پایداری ناشی از خاصیت آروماتیکی حلقه بنزن را از بین می برد. هیبریداسیون اتم کربن نیز از نوع sp۲ به نوع sp۳ تغییر می کند و کربوکاتیون ناپایدار و غیرمسطح به وجود می آید. در نتیجه این فرآیند، کربوکاتیون آروماتیکی تشکیل می شود. این کربوکاتیون دارای فرم های رزنانسی است و این مرحله به دلیل این که کندترین مرحله واکنش است، به عنوان مرحله تعیین کننده سرعت است. پایداری کربوکاتیون با رزنانس بار مثبت بین سه اتم کربن در حلقه آروماتیک به وجود می آید. در نتیجه فرم های رزنانسی، شکل هیبرید رزنانس به صورت پایدار می توان تصویر شود.
در مرحله بعد گروه بازی می تواند یک پروتون را حذف کند تا خاصیت آروماتیکی حلقه دوباره برقرار شود. بدین ترتیب کربوکاتیون آروماتیکی که تشکیل شده بود، با حذف پروتون پایدار می شود. هیبریداسیون اتم کربن دوباره به شکل پایدار sp۲ برگشته و شکل مولکول، مسطح می شود. این مرحله از واکنش، خیلی سریع انجام می شود و از نظر انرژی مطلوب است.
از جمله واکنش های جانشینی الکتروفیلی می توان آلکیل دار کردن فریدل کرافتس، آسیل دار کردن فریدل کرافتس، نیتروژن دار کردن، هالوژن دار کردن و سولفون دار کردن را نام برد. این مقاله ما را با انواع واکنش های فریدل کرافتس آشنا می کند.
انواع واکنش فریدل کرافتس
نوعی از واکنش های جانشینی الکتروفیلی، فریدل کرافتس است که در آن یک گروه آلکیل و یا آسیل جایگزین یکی از اتم های هیدروژن در حلقه آروماتیک بنزنی می شود. اگر گروه آلکیل جایگزین شود آلکیلاسیون و اگر گروه آسیل به جای هیدروژن بنشیند، آسیلاسیون فریدل کرافتس نامیده می شود. کاتالیزوری که در این واکنش به کار برده می شود، آلومینیوم کلرید است. اولین بار این واکنش در سال ۱۸۷۷ بود که به طور هم زمان، چارلز فریدل و جیمز کرافتس این واکنش را کشف کردند.
آلکیلاسیون فریدل کرافتس
در آلکیلاسیون فریدل کرافتس، با حمله الکتروفیلی به حلقه بنزنی و آروماتیکی، گروه آلکیل به جای یکی از اتم های هیدروژن حلقه بنزنی می نشیند. در این واکنش آلکیل هالید به عنوان ماده اولیه استفاده شده و آلکیل بنزن به عنوان محصول واکنش، تولید می شود.
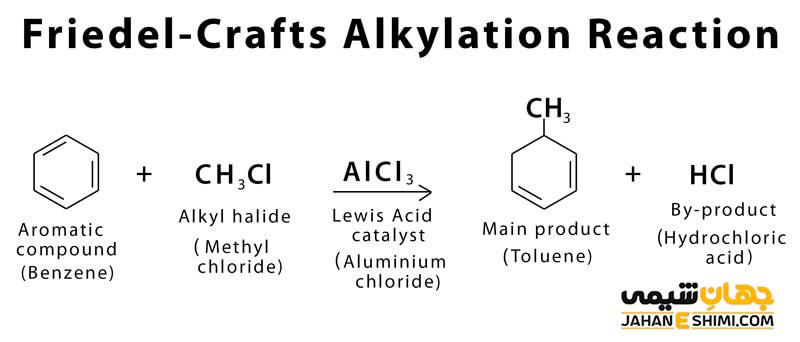
مکانیسم آلکیلاسیون فریدل کرافتس
در مکانیسم این واکنش ابتدا آلکیل هالید با کاتالیزور کلرید آلومینیوم (اسید لوئیس) واکنش داده و کربوکاتیون الکتروفیل را تشکیل می دهند. ترتیب واکنش پذیری کربوکاتیون تشکیل شده به ترتیب زیر است.
کربوکاتیون نوع اول < کربوکاتیون نوع دوم < کربوکایتون نوع سوم
در مرحله بعد، کربوکاتیون الکتروفیل با حمله به حلقه آروماتیکی، حد واسط سیکلوهگزادینیل را تشکیل می دهد. این ماده واسط به شکل آروماتیک مسطح نبوده و خاصیت آروماتیسیته آن به طور موقت از بین رفته است. تا این که بعد از حذف پروتون از این ماده واسط، با تشکیل پیوندهای دوگانه، خاصیت آروماتیکی ترکیب دوباره تشکیل می شود. در این واکنش، گروه آلکیل جایگزین هیدروژن می شود و هیدروژن حذف شده، اسید هیدروکلریک تشکیل داده و کلرید آلومینیوم در نهایت تشکیل می شود.
محدودیت ها در واکنش آلکیل دار کردن فریدل کرافتس
یکی از محدودیت های این واکنش در اضافه کردن گروه آلکیل با بیش از دو اتم کربن ظاهر می شود. چون بعد از تشکیل کربوکاتیون امکان نوآرایی آن به دلیل جابجا شدن هیدرید و یا گروه متیل، وجود دارد. برای جلوگیری از این نوآرایی و رسیدن به محصول مورد نظر، می توان از واکنش آسیلاسیون فریدل کرافتس استفاده کرد.
همچنین واکنش فریدل کرافتس در حلقه هایی اتفاق می افتد که فعال باشند و دارای گروه های غیرفعال کننده ای چون گروه نیترو نباشند. چون جفت الکترون های ناپیوندی موجود در گروه های آمین دار، باعث ایجاد بار مثبت در مجاور حلقه بنزنی در نتیجه واکنش با کلرید آلومینیوم می شود. همین بار مثبت اجازه انجام واکنش فریدل کرافتس را نمی دهد.
یکی دیگر از مشکلات و محدودیت هایی که در آلکیلاسیون فریدل کرافتس اتفاق می افتد، اضافه شدن چند گروه آلکیل به حلقه آروماتیکی است. چون ممکن است گروه آلکیل الکترون دهنده اضافه شده و پلی آلکیلاسیون اتفاق بیفتد. باید مقدار زیادی از ترکیبات آروماتیک در ظرف واکنش وارد شوند تا از پلی آلکیلاسیون جلوگیری شود.
مشکل دیگری که در این واکنش پیش می آید در هنگام استفاده از آلکیل هالیدهای بیشتر از یک هالوژن است که محصولاتی با چند حلقه آروماتیکی به وجود می آورد.
چون این محدودیت ها می تواند راندمان واکنش را کم کند، استفاده از این واکنش در صنعت کاهش می یابد.
آسیلاسیون فریدل کرافتس
در واکنش آسیل دار کردن فریدل کرافتس، می توان گروه آسیل را از طریق واکنش یک اسید کلرید به یک حلقه آروماتیک اضافه کرد. در این واکنش نیز کلرید آلومینیوم به عنوان یک کاتالیزور خواهد بود. با افزودن گروه آسیل، حلقه آروماتیک به یک کتون تبدیل می شود. یون کلرید یا هر هالوژن دیگری که در آسیل هالید وجود دارد، با کلرید آلومینیوم (اسید لوئیس) یک کمپلکس تشکیل می دهد. الکتروفیلی که در نتیجه این فرایند تشکیل می شود، یون آسیلیوم (RCO+) است. پایداری این یون با رزونانس است.
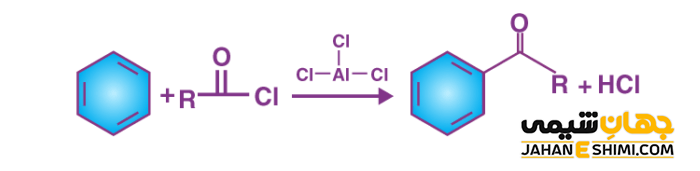
مکانیسم آسیل دار کردن فریدل کرافتس
در توضیح مکانیسم آسیل دار کردن فریدل کرافتس می توان گفت که ابتدا یون آسیلیوم تشکیل می شود که با حلقه بنزنی واکنش می دهد. سپس یون مذکور با حمله به حلقه بنزنی، به عنوان یک الکتروفیل می تواند کمپلکسی را ایجاد کند. سپس هیدروژن حذف و خاصیت آروماتیکی حلقه مجددا بر می گردد. در این مرحله هیدروژن حذف شده به تشکیل کلرید آلومینیوم همراه با اسید کلریدریک می پردازد. محصول واکنش یک کتون خواهد بود که با اضافه کردن آب، تشکیل می شود و آسیل بنزن نامیده می شود.
محدودیت های واکنش آسیل دار کردن فریدل کرافتس
در واکنش آسیلاسیون، کتون فقط تولید می شود چون در شرایط انجام واکنش، تجزیه فرمیل کلرید انجام شده و CO و HCl تولید می شود. از نکات دیگر در انجام این واکنش این است که ترکیب آروماتیکی باید واکنش پذیری بیشتری نسبت به مونو هالو بنزن داشته باشد. در این صورت است که می تواند این واکنش را انجام دهد. همچنین در صورت استفاده از آریل آمین ها، چون به تشکیل کمپلکس های با واکنش پذیری کم با کاتالیزور منجر می شود، نباید مورد استفاده قرار گیرند.
در واکنش آسیل دار کردن اگر از الکل یا آمین استفاده شود، اتم نیتروژن و اکسیژن محل انجام آسیلاسیون خواهد بود.



















