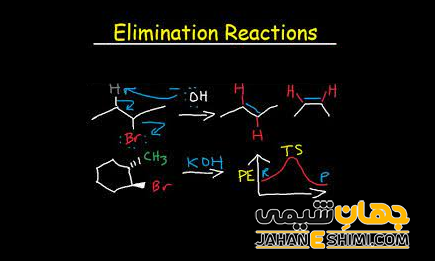
در شیمی آلی، واکنش حذفی (Elimination reaction) به واکنش شیمیایی گفته می شود که در آن، دو گروه جانشینی و یا استخلافی، در یک مکانیسم یک مرحله ای و یا دو مرحله ای از یک مولکول آلی حذف شوند. مکانیسم تک مرحله ای با عنوان واکنش E2 و مکانیسم دو مرحله ای با عنوان واکنش E1 شناخته می شود. لازم به ذکر است که اعداد ۱ و ۲، به تعداد مراحل در مکانیسم اشاره نمی کند، بلکه به سینتیک واکنش ها اشاره دارند. در واقع، واکنش E2 یک واکنش دو مولکولی یا درجه دوم، و واکنش E1 یک واکنش تک مولکولی یا درجه اول می باشد. در ادامه این مقاله در نشریه جهان شیمی فیزیک به بررسی واکنش حذفی و انواع مختلف آن پرداخته می شود. لطفا با ما همراه باشید.
واکنش حذفی
در اکثر واکنش های حذفی، حداقل یک پروتون (+H) برای تشکیل پیوند دوگانه (پیوند پای) از مولکول خارج می شود. در این صورت درجه غیر اشباع بودن مولکول افزایش پیدا می کند. علاوه بر آن، در بیشتر مواقع، دو اتم (یا دو گروه) از یک مولکول حذف می شوند. در این شرایط، اتم یا گروه دیگری نیز جانشین گروه های حذف شده، نمی گردد. این اتم یا گروه های حذفی اغلب از دو اتم مجاور یکدیگر در مولکول اصلی و به شکل آب، اسید هالوژنه، آمین ها، سولفور و … جدا می شوند.
جالب است بدانید که دسته مهمی از واکنش های حذفی، آنهایی هستند که شامل آلکیل هالید ها می باشند. در آلکید هالید ها، هالوژن ها گروه های ترک کننده خوبی محسوب می شوند. این ترکیبات با یک باز لوئیس واکنش داده و در نهایت یک آلکن تشکیل می شود. دقت داشته باشید که اگر مولکول اصلی نامتقارن باشد، جهت گزینی (Regioselectivity) به وسیله قانون زایتسف (Zaitsev’s Rule) یا از طریق حذف هافمن (Hoffman Eliminattion) تعیین می شود. لازم به ذکر است که که واکنش حذفی می تواند معکوس واکنش افزایشی در نظر گرفته شود.
قانون زایتسف
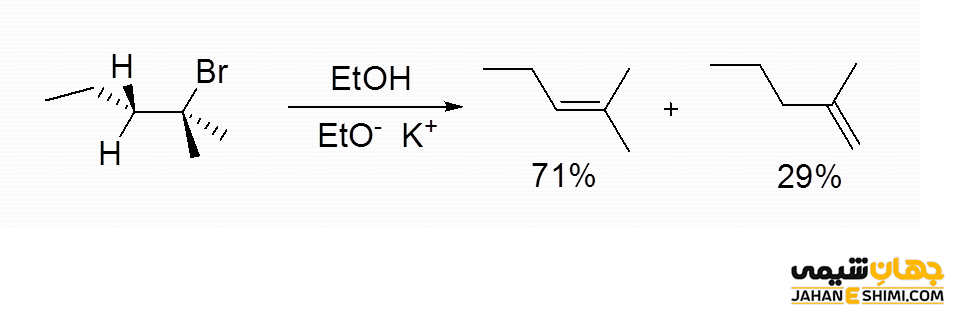
بر طبق قاعده زایتسف، محصول اصلی در طی واکنش هیدرو هالوژن زدایی، آلکنی خواهد بود که بیشترین تعداد گروه های آلکیل متصل به دو اتم کربن درگیر در پیوند دوگانه را داشته باشد. زیرا آلکن هایی که گروه های آلکیل بیشتری به کربن های دو طرف پیوند دوگانه متصل شده باشند، پایدار تر هستند. همانطور که مشخص است، این قانون در تشخیص محصول عمده آلکنی در طی یک واکنش حذفی استفاده می شود. لازم به ذکر است که در برخی موارد و به صورت استثنا از قاعده هافمن پیروی می کنند. به عبارت دیگر، قانون زایتسف تشکیل پایدار ترین آلکن را پیش بینی می کند. این قاعده برای اولین بار در سال ۱۸۷۵ میلادی، توسط شیمیدان روسی یعنی الکساندر میخایلوویچ زایتسف (Alexander Mikhaylovich Zaitsev) بیان شد.
حذف هافمن
قاعده هافمن کاملا بر عکس قانون سایتزف می باشد. در حقیقت محصول اصلی در طی واکنش هیدرو هالوژن زدایی، آلکنی با استخلاف کمتر خواهد بود. به عنوان مثال، واکنش حذف هالوآلکان ها را در نظر بگیرید. اگر هالوژن ترک کننده فلوئور باشد، محصول عمده از قاعده هافمن به جای قاعده سایتزف پیروی می کند. این قاعده برای اولین بار، توسط شیمیدان آلمانی یعنی آوگوست ویلهلم فون هفمان (August Wilhelm von Hofmann) کشف شد.
بر طبق قاعده حذف هافمن، ابتدا یک آمین با متیل یدید واکنش می دهد. سپس محصول بدست آمده در حضور اکسید نقره، آب و گرما، باعث تولید یک آمین نوع سوم و یک آلکن می شود. در واقع می توان گفت که گروه ترککننده در این فرآیند یک آمین نوع چهارم می باشد. آلکن تولید شده در طی این واکنش، از قاعده زایتسف پیروی نمی کند.
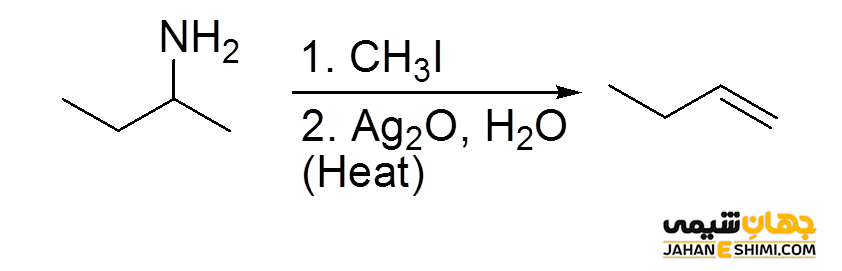
انواع واکنش حذفی
واکنش های حذفی می توانند در یک مرحله و به صورت همزمان انجام شوند و یا اینکه در طی دو مرحله صورت بگیرند. همان طور که بیان شد، این واکنش ها را با نام های E1 و E2 بیان می کنند. لازم به ذکر است که اگر در واکنش، یک گونه در مرحله تعیین کننده سرعت واکنش موثر باشد، واکنش E1 و اگر دو گونه بر سرعت واکنش موثر باشند، واکنش E2 خواهد بود.
به طور کلی اگر یک نوکلئوفیل به کاربو کاتیون واسطه نزدیک شود، یک واکنش جانشینی (SN) انجام می شود. حال اگر محیط قلیایی داشته باشید، آنیون OH می تواند یک اتم هیدروژن را به راحتی از اتم کربن مجاور به کاربوکاتیون جدا کند. در این صورت، یک پیوند دوگانه ایجاد می شود. بدین شکل، یک واکنش حذفی اتفاق افتاده است. جهت سوق دادن واکنش به جای واکنش جانشینی به سمت واکنش حذفی، می توان علاوه بر باز قوی از حرارت نیز بهره برد. از آنجاییکه واکنش های حذفی باعث افزایش تعداد مولکول ها می شوند، پس آنتروپی نیز افزایش می یابد. با افزایش آنتروپی، این مدل واکنش ها در دمای بالا انجام می شوند. در حالیکه واکنش های جانشینی تغییرات آنتروپی زیادی ندارند. بنابراین، در دمای پایین انجام می شوند.
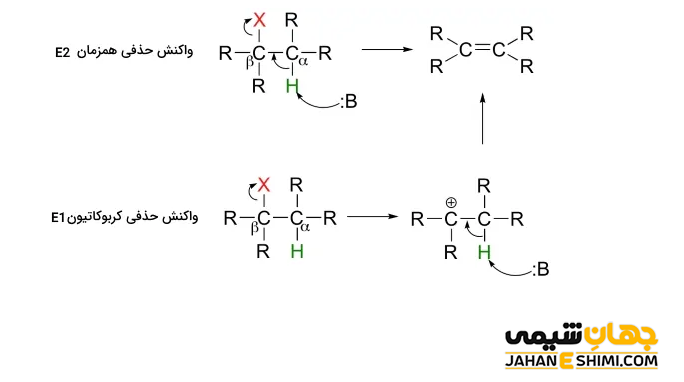
واکنش حذفی E2
سر کریستوفر کلک اینگولد (Sir Christopher Kelk Ingold) در سال ۱۹۲۰ میلادی، مدلی را برای توضیح نوع خاصی از واکنش شیمیایی پیشنهاد کرد. این مدل پیشنهادی، همان مکانیسم E2 بود. این واکنش شامل یک مکانیسم یک مرحله ای است که در آن، پیوند های کربن– هیدروژن و کربن- هالوژن شکسته می شوند. در نتیجه یک پیوند دوگانه تشکیل خواهد شد. در واقع، همزمان با تشکیل پیوند دوگانه، اتم های هیدروژن و هالوژن از مولکول جدا می شوند.
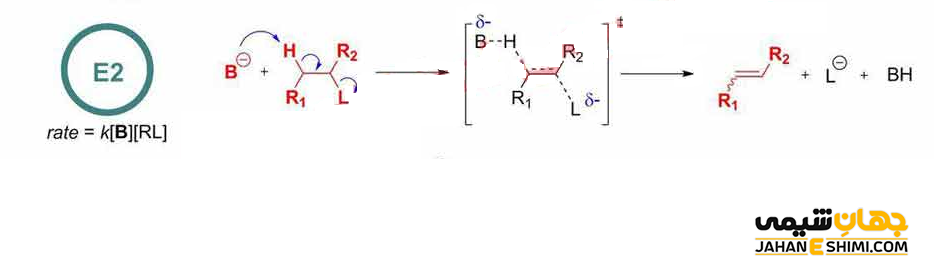
دقت داشته باشید که E2 مخفف حذف دو مولکولی است. زیرا در مرحله تعیین سرعت یا همان مرحله آهسته واکنش، علاوه بر غلظت هالوالکان، غلظت نوکلئوفیل نیز موثر است. به عبارت دیگر، در این نوع واکنش حذفی، سرعت واکنش از سینتیک مرتبه دوم پیروی می کند که به غلظت هر دو جزء واکنشگر (باز) و واکنش دهنده (آلکیل هالید) بستگی دارد. در آزمایشگاه معمولا از باز های نسبتا قوی مانند آلکوکسید ها (الکل های پروتون گیری شده) استفاده می کنند.
لازم به ذکر است که در این مکانیسم، یک گروه ترککننده خوب نیاز است. زیرا نقش مهمی را در مرحله تعیین کننده سرعت بازی می کند. گروه ترک کننده همچنین باید با بقیه مولکول به صورت هم صفحه باشد تا بتواند یک پیوند دوگانه تشکیل دهد. زیرا همانطور که می دانید با تبدیل پیوند سیگما به پای، هیبرید کربن های دو طرف پیوند، از sp۳ به sp۲ تغییر می کند. در حقیقت، باز به اتم هیدروژن حمله کرده و با آن پیوند تشکیل می دهد. همزمان پیوند پای ایجاد می گردد. در ادامه، پیوند کربن- هالوژن شروع به شکستن نموده و در نهایت هالوژن مولکول را ترک می کند.
رقابت بین واکنش حذفی E2 و جانشینی هسته دوستی
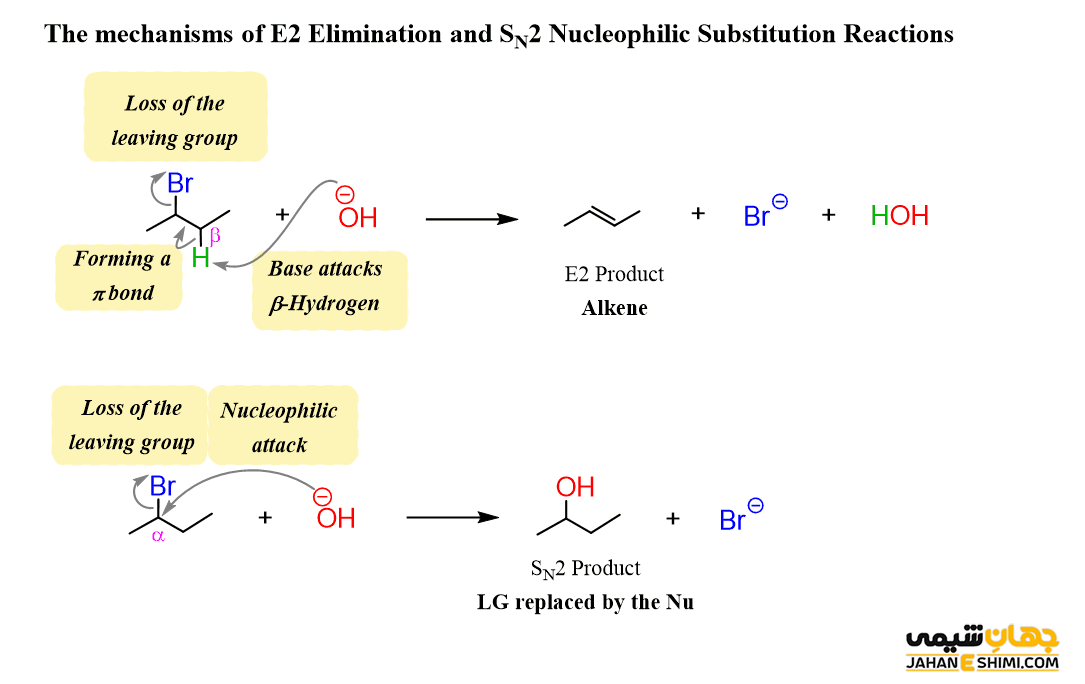
واکنش E2 بسیار مشابه واکنش جانشینی هسته دوست دو مولکولی (SN۲) است. به عبارت دیگر، این دو واکنش در رقابت با یکدیگر هستند. زیرا باز ها می توانند به عنوان نوکلئوفیل (و بر عکسش) عمل کنند. اما توجه داشته باشید که با انتخاب دقیق معرف، می توان جهت واکنش را به خوبی تعیین کرد.
به عنوان مثال، الکتروفیل های کربن نوع اول، مکانیسم SN۲ را به مکانیسم E2 ترجیح می دهد. زیرا در کربن الکتروفیل، هیچ ممانعتی فضایی وجود ندارد، پس هدف خوبی برای یک نوکلئوفیل محسوب می شود. حال اگر بخواهید واکنش را به سمت مکانیسم E2 ببرید، کافیست از حرارت یا یک باز قوی با ممانعت فضایی مانند ترت-بوتواکسید استفاده نمایید. در این باز، کار اتم اکسیژن برای رسیدن به کربن الکتروفیل و ایفای نقش نوکلئوفیلی سخت می شود. بنابراین ترجیح می دهد تنها یک پروتون را حذف کند (دسترسی به پروتون ساده تر است) و از مکانیسم E2 تبعیت نماید. بنابراین در واکنش حذفی E2 معمولا از یک باز قوی به همراه یک آلکیل هالید بهره می برند.
جالب است بدانید که هالوآلکان های نوع اول، دوم و سوم، هر سه واکنش دهنده های موثری برای مکانیسم E2 هستند. اما در اغلب موارد، هالو آلکان نوع سوم، راحت تر درگیر واکنش می شود. همچنین در هنگام کار با آلکیل هالید نوع اول، به منظور کاهش رقابت بین مکانیسم های E2 و SN۱ می توان یک باز استخلاف دار (ممانعت فضایی) را مورد استفاده قرار داد. لازم به ذکر است که تا زمانی یک باز با ممانعت فضایی در محیط واکنش نداشته باشید، قانون زایتسف برقرار است. بدین معنا که واکنش تحت کنترل ترمودینامیکی می باشد.
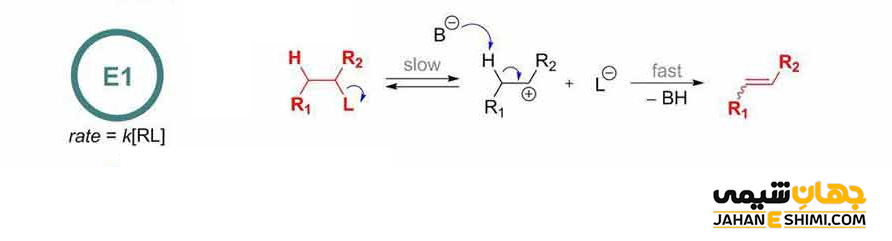
واکنش حذفی E1
این واکنش شامل یک مکانیسم دو مرحله ای (مرحله یونی کردن و مرحله حذف پروتون یا حذف یون هیدروژن) است. در این مکانیسم، ابتدا گروه ترک شونده (اغلب اتم های هالوژن) با الکترون های خود از مولکول اصلی جدا می شود. سپس، کربن دارای اتم هالوژن (با ترک هالوژن متصل به آن) یک الکترون از دست داده و کربوکاتیون ایجاد می گردد. در مرحله بعدی، مولکول یک پروتون از دست می دهد و در نتیجه یک پیوند دوگانه تشکیل خواهد شد. توجه داشته باشید که پروتون گیری از هیدروژن متصل به کربن نزدیک کربوکاتیون (بیشتر یک اتم کربن دورتر یا در موقعیت بتا) انجام می گیرد. بنابراین، برای انجام چنین واکنشی، به یک باز نیاز خواهد بود.
کلمه E1 مخفف حذف تک مولکولی است. زیرا در مرحله تعیین سرعت یا همان مرحله آهسته واکنش (مرحله تشکیل کربوکاتیون)، تنها غلظت هالوالکان، موثر است. به عبارت دیگر، در این نوع واکنش حذفی، سرعت واکنش از سینتیک مرتبه اول پیروی می کند که به غلظت تنها یک جزء (آلکیل هالید) بستگی دارد.
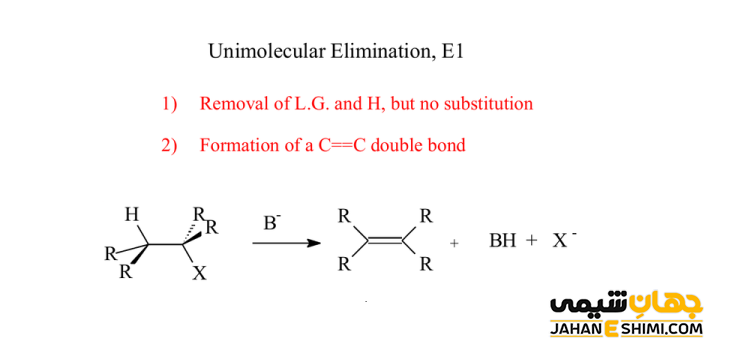
لازم است بدانید که بر خلاف مکانیسم E2، که پروتون نسبت به گروه ترک کننده باید در موقعیت آنتی (anti) قرار داشته باشد، در مکانیسم E1، فقط به یک هیدروژن در کربن مجاور نیاز دارید. زیرا در اینجا، گروه ترک کننده، قبلا مولکول را ترک کرده است. محصول نهایی، یک آلکن و همچنین فرآورده فرعی HB خواهد بود. حرف B نشان دهنده بازی است که در این واکنش استفاده شده است. جالب است بدانید که واکنش بیشتر در حضور یک باز ضعیف (ROH) انجام می شود. اگر باز ضعیف هم نبود، مکانیسم در شرایط اسیدی و دمای بالا رخ خواهد داد. همچنین می توان از یک الکل در حضور اسید سولفوریک (H۲SO۴) و اسید فسفریک (H۳PO۴) نیز بهره برد.
رقابت بین واکنش حذفی E1 و جانشینی هسته دوستی
واکنش حذفی E1، مشابه با واکنش جانشینی هسته دوستی تک مولکولی (SN۱) است. زیرا در هر دو واکنش ذکر شده، از دست دادن گروه ترک کننده و در نتیجه تشکیل کربوکاتیون واسط، مرحله تعیین کننده سرعت است. به عبارت دیگر، این دو واکنش در رقابت با یکدیگر هستند. در بسیاری از مواقع، این دو واکنش به صورت همزمان اتفاق می افتند. بنابراین، از یک واکنش، فرآورده های مختلفی (فرآورده های مخلوط از مکانیسم های جانشینی و حذفی) خواهید داشت.
اما توجه داشته باشید که با انتخاب دقیق شرایط آزمایش به صورت گرم یا سرد، می توان جهت واکنش را به خوبی تعیین کرد. به عبارت دیگر، در صورتی که به واکنش حذفی نیاز باشد، از حرارت کمک گرفته می شود. جالب است بدانید که کربوکاتیون نوع سوم نسبت به کربوکاتیون های دیگر و همچنین گروه متیل، واکنش پذیری بیشتری دارد. از این جهت، برای انجام مکانیسم E1 مناسب تر است.
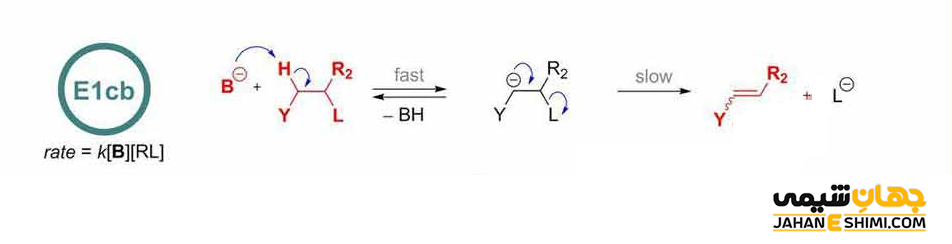
مکانیسم E1cB
در مواقعی که مولکول بتواند یک آنیون را تثبیت کند، در حالیکه گروه ترک شونده ضعیفی نیز دارد، نوع سوم واکنش وجود دارد. واکنش E1cB، (Elimination Unimolecular conjugate Base) نوعی واکنش حذفی است که در شرایط پایه اتفاق می افتد. در اینجا هیدروژنی که باید از مولکول حذف شود نسبتا اسیدی است. از طرف دیگر، گروه ترک شونده نیز نسبتا ضعیف می باشد (مانند گروه های عاملی OH یا OR). مکانیسم E1cB یک فرآیند دو مرحله ای است که اولین مرحله آن می تواند برگشت پذیر باشد یا نباشد. در ابتدا، باز پروتون نسبتا اسیدی را جدا می کند. در این صورت، یک آنیون تثبیت شده تولید می گردد. جفت الکترون آنیون، به سمت اتم همسایه (حامل گروه ترک شونده) حرکت می کند. بنابراین گروه ترک شونده را بیرون نموده و در نهایت پیوند دو یا سه گانه تشکیل می شود.
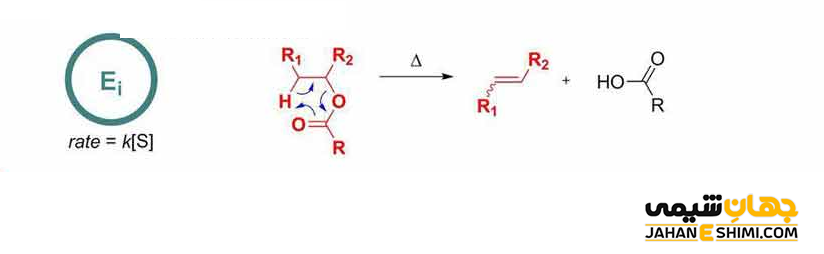
مکانیسم Ei
مکانیسم Ei (حذف داخلی (Elimination Internal) یا حذف درون مولکولی (Elimination Intramolecular))، نوع خاصی از واکنش های حذفی در شیمی آلی است. در این واکنش، دو جانشین مجاور بر روی یک مولکول آلکان به طور همزمان از طریق یک حالت گذار حلقوی مولکول را ترک می کنند. در این صورت یک آلکن در حذف به صورت سین (Syn Elimination) تشکیل می شود. این مکانیسم با نام های حذف حرارتی سین (thermal syn elimination) یا حذف سیکلی دور حلقه ای سین (pericyclic syn elimination) نیز شناخته می شود. این نوع حذف منحصر به فرد است. زیرا از نظر حرارتی فعال می شود. بنابراین بر خلاف حذف های معمولی که نیاز به اسید یا باز دارند. یا اینکه در بسیاری از موارد شامل واسطه های باردار می شوند، به معرف های اضافی نیاز ندارد. این مکانیسم اغلب در پیرولیز یافت می شود.




















یک دیدگاه