در شیمی، گاز حقیقی (Real gas) به گاز هایی گفته می شود که از قانون گاز ایده آل (ideal gas law) تبعیت نمی کنند. این دسته از گازها از حالت ایده آل، انحراف زیادی را نشان می دهند. میزان این انحراف را می توان با ضریب تراکم پذیری (Z) بیان کرد. به بیان دیگر، گاز حقیقی به گاز هایی می گویند که رفتار آنها با توجه به نظریه جنبش مولکولی گاز ها، قابل پیش بینی نباشد. گاز های حقیقی، گاز های واقعی یا گاز های غیر ایده آل نیز نامیده می شوند. در ادامه این مقاله در نشریه جهان شیمی فیزیک به بررسی گاز حقیقی و معادلات مربوط به آن پرداخته می شود. لطفا با ما همراه باشید.
گاز ایده آل چیست؟
به طور کلی به دو دسته گاز های ایده آل (یا کامل) و گاز های غیر ایده آل (حقیقی یا واقعی) تقسیم می شوند. گاز ایده آل (Ideal gas) به گازی گفته می شود که نیرو های بین مولکولی (نیرو های دافعه و یا جاذبه) در آنها قابل چشم پوشی باشند. به طور کلی می توان گفت که گاز ایده آل بسیار رقیق بوده و فاصله مولكول های آن از همدیگر آنقدر زیاد است که در نتیجه می توان گفت که بر روی یکدیگر اثر نمی گذارند. علاوه بر آن، معادله گاز ایده آل (PV = nRT) بین کمیت های فشار (P)، حجم (V)، دمای کلوین (T) و مقدار مول (n)، برقرار است. دقت داشته باشید که گاز های ایده آل همچنین از قوانین گاز ها (قانون بویل، قانون شارل، قانون آووگادرو و قانون دالتون) تبعیت می كنند.
لازم به ذکر است که گاز کامل (Perfect gas) نیز نوعی گاز فرضی در علوم شیمی و فیزیک در نظر گرفته می شود که تنها مبنای نظری دارد. در حقیقت جهت ساده سازی محاسبات بکار می رود. دقت داشته باشید که خواص گاز کامل نسبت به گاز ایده آل متفاوت است. به بیان ساده تر، تفاوت اساسی گاز کامل با گاز ایده آل در حذف برهمکنش های بین مولکولی خواهد بود. بنابراین گاز های کامل از قانون وان دروالس تبعیت نمی کنند. به طور کلی می توان گفت که گاز کامل به گازی می گویند که نخست ایده آل باشد. در ثانی، نیرو های بین مولکولی در گاز کامل قابل چشم پوشی اند. پس گاز کامل را می توان نوعی گاز ایده آل در نظر گرفت، اما تمام گاز های ایده آل، گاز کامل محسوب نمی شوند.
گاز حقیقی چیست؟
گاز های حقیقی در واقع همان گاز های غیر ایده آلی محسوب می شوند که مولکول های آنها فضا را اشغال نموده و با یکدیگر برهمکنش دارند. در نتیجه، گاز های حقیقی به قانون گاز ایده آل پایبند نمی باشند. مولکول های گاز واقعی هر چند ذرات کوچکی محسوب می شوند، اما سرعت، حجم و جرم دارند. به علاوه، زمانیکه سرد می شوند به مایع تبدیل می شوند، پس نیروهای جاذبه بین مولکولی وجود دارند. حجم اشغال شده توسط گاز حقیقی نسبت به حجم کل گاز، قابل اغماض نیست. لازم به ذکر است که گاز های حقیقی را می توان در فشار های پایین و دما های بالا، ایده آل فرض کرد. برای درک رفتار گاز های واقعی، باید موارد زیر را در نظر گرفت:
- اثرات تراکم پذیری
- ظرفیت گرمای ویژه متغیر
- نیرو های واندروالس
- اثرات ترمودینامیکی غیر تعادلی
- مسائل مربوط به تفکیک مولکولی و واکنش های ابتدایی با ترکیب متغیر
معادله واندروالس
همانگونه که بیان شد، گاز های غیر ایده آل، از قانون های گاز ایده آل تبعیت نمی کنند. از این جهت، معادلات حالت فراوانی برای گاز های واقعی وجود دارد. در این معادلات، تعداد پارامتر ها بسیار زیاد است. حال هرچه تعداد پارامتر های یک معادله بیشتر باشد، معادله دقیق تر خواهد بود. از جمله این معادلات می توان به معادله واندروالس (equation Van der Waals)، معادله ویریال (Virial Mode)، معادله ردلیش- کوانگ (Redlich-Kwong Model)، رابطه بارتلت (Berthelot Equation) و مدل تصحیح شده برتولت (modified Berthelot model)، مدل دیترسی (Dieterici model)، معادله کلازیوس (Clausius model)، مدل پنگ- رابینسون (Peng–Robinson model)، مدل وهل (Wohl model)، مدل بتی- بریجمن (Beattie–Bridgeman model) و مدل بندیکت- وب- روبین (Benedict–Webb–Rubin model) اشاره کرد.
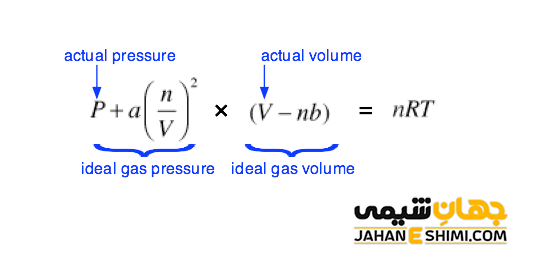
لازم به ذکر است که از میان معادلات گفته شده، ساده ترین معادله، رابطه واندروالس می باشد که در ادامه مقاله به آن پرداخته می شود. یوهان واندروالسی (Johannes Diderik van der Waals) در سال ۱۸۷۳ میلادی، به منظور محاسبه دو اثر حجم اشغال شده به وسیله مولکول های گاز و نیرو های بین مولکولی، معادله حالت گاز ایده آل را اصلاح کرد. این معادله به معادله واندروالس مشهور است و به صورت زیر می باشد.

در این معادله، P بیانگر فشار بر حسب اتمسفر، V بیانگر حجم بر حسب لیتر، n بیانگر تعداد مول، R بیانگر ثابت گاز ها (۰.۰۸۲۰۶ L atm mol-۱ K-۱)، T بیانگر دما بر حسب کلوین، a و b ثابت های واندروالس هستند که به نوع گاز بستگی دارند. ثابت a معیاری جهت جاذبه بین مولکول ها و ثابت b حجم میانگین اشغال شده از حجم کل (V) به وسیله مولکول ها هستند.
تصحیحات معادله واندروالس
اگر به معادلات گاز ایده آل و واندروالس دقت کنید، مشاهده می کنید که سمت راست معادله واندروالس (nRT)، دقیقا مشابه معادله گاز ایدهآل است. تنها تصحیحاتی که در معادله وجود دارد، درباره فشار و حجم است تا نیرو های بین مولکولی و حجم مولکول های گاز را بتوانند توصیف کند. عبارت an۲/V۲، به فشار اضافه می شود تا نیرو های جاذبه بین مولکولی تصحیح شوند (زیرا فشار اندازه گیری شده از مقدار مورد انتظار ما کمتر است). در این عبارت، a بیانگر میزان جاذبه بین هر ذره و n۲ بیانگر مقدار کلی نیرو های جاذبه می باشند. دقت داشته باشید که n۲ به مقدار گاز موجود وابسته است. جالب است بدانید که عبارت a/V۲ در حقیقت فشار ناشی از نیرو های جاذبه بین مولکولی در نظر گرفته می شود که کمتر از مقدار ایدهآل آن است.
ثابت b، نیز حجم حذف شده در هر مول است و به این دلیل اضافه می شود که مولکول های گاز، حجم دارند. در نتیجه، حجم کل اندازه گیری شده، حجم مولکول ها را نیز شامل می شود. پس حجم هر مول (nb) را از حجم اندازه گیری شده کل کم می کنند تا حجم در دسترس گاز را در محاسبات وارد کنند. لازم به ذکر است که به b حجم مستثنی شده هم گفته می شود.
تفاوت بین گاز ایده آل و گاز حقیقی
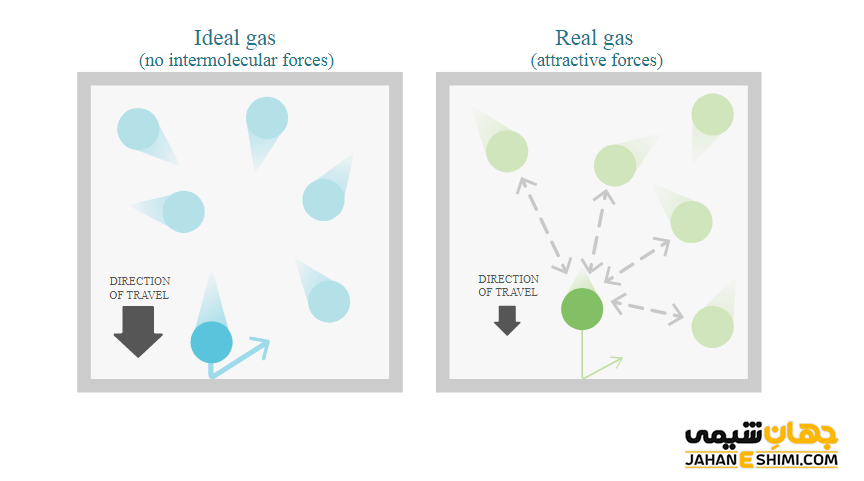
گاز ایده آل از تعداد زیادی مولکول های کوچک گاز تشکیل شده است. در حالیکه، گاز های حقیقی در واقع ترکیبی از مولکول هایی بزرگتر در مقایسه با گاز های ایده آل اند. حجم مولکول های گاز ایده آل، ناچیز و قابل چشم پوشی است. اما مولکول های گاز واقعی، حجم معینی دارند که قابل اغماض نیست. هیچ جاذبه ای میان مولکول های گاز ایده آل وجود ندارد. در حالیکه، نیرو های ضعیف واندروالسی میان مولکول های گاز حقیقی وجود دارند. برخورد مولکول های گاز ایده آل با هم کاملا کشسان یا استاتیک است. در حالیکه، برخورد مولکول های گاز واقعی، کشسان یا استاتیک نیست. گاز های ایده آل متراکم نمی شوند و همچنین نقطه سه گانه نیز ندارد. در حالیکه، گاز های حقیقی سرعت، حجم و جرم دارند. به علاوه، زمانیکه تا نقطه انجماد سرد شوند، مایع خواهند شد.
همانطور که بیان شد، یک گاز ایده آل در حقیقت یک گاز فرضی محسوب می شود که خواص آن نسبت به گاز واقعی بسیار متفاوت است. در جدول زیر، تفوت اصلی میان گاز های ایده آل و غیر ایده آل آورده شده است.
| گاز واقعی | گاز ایده آل |
| حجم معینی دارد. | حجم معین و مشخصی ندارد. |
| برخورد غیر کشسان بین ذرات وجود دارد. | برخورد الاستیک میان ذرات وجود دارد. |
| نیرو های جاذبه بین مولکولی مشاهده می شود. | نیروی جاذبه بین مولکولی وجود ندارد. |
| واقعا در محیط اطراف وجود دارد. | در محیط اطراف وجود ندارد و یک گاز فرضی است. |
| نسبت به گاز ایده آل، فشار کمتر است. | فشار بالا است. |
| با دیگران تعامل دارد. | مستقل رفتار می کند. |
| قانون PV = nRT پیروی نمی کند. | از قانون PV = nRT پیروی می کند. |
ثابت جهانی گاز ها و ثابت ویژه گاز
ثابت جهانی گاز ها، ثابتی است که برای یک گاز ایده آل در معادله حالت ایده آل استفاده می شود. در حالیکه، ثابت ویژه گاز (Rspecific)، ثابتی است که برای یک گاز حقیقی و یا مخلوطی از گاز ها کاربرد دارد. زمانیکه معادله گاز ایده آل برای گاز های معمولی مورد استفاده قرار می گیرد، معادله نیاز به اصلاح دارد. زیرا هیچ گاز غیر ایده آلی، مانند گاز ایده آل رفتار نمی کند.
بنابراین، قانون گاز ایده آل نمی تواند به طور مستقیم برای گاز های حقیقی مورد استفاده قرار گیرد. پس به یک اصلاح ساده نیاز است. برای این کار، ثابت جهانی گاز ها را بر جرم مولکولی گاز مورد نظر تقسیم می کنند. لازم به ذکر است که این رابطه برای مخلوط گازها نیز کاربرد دارد. در اینصورت، ثابت R را بر جرم مولکولی مخلوط گاز ها تقسیم می کنند. بنابراین می توان گفت که ثابت ویژه گاز، در عوض ثابت گاز ایده آل کاربرد دارد.

انحراف گاز حقیقی از رفتار ایده آل
زمانیکه یک گاز عظیم و حجیم شود از رفتار ایدهآل خود خارج خواهد شد. در واقع در غلظت بالا، گاز ها از خود، رفتار غیر ایده آل نشان می دهند. در حالیکه در فشار های پایین و دما های بالا كه برهمكنش میان مولكول ها یا اتم های یک گاز با همدیگر اندك است، رفتار گاز ها به حالت ایده آل نزدیك می شود. علاوه بر آن، عواملی مانند افزایش حجم، کاهش چگالی، کاهش تراکم مولکول ها یا کاهش غلظت نیز باعث نزدیک شدن گاز به حالت ایدهآل می گردند.
پس می توان نتیجه گرفت که یک گاز در دمای پایین و فشار بالا، رفتاری غیر ایدهآل دارد. در دمای پایین، مولکول ها و یا ذرات گاز با سرعت بسیار پایینی از کنار هم عبور می کنند، بنابراین، نیرو های جاذبه و دافعه میان مولکول ها و یا ذرات گاز رخ داده و سبب انحراف از رفتار ایده آل می شود. از طرفی دیگر، حجم مولکول های گاز در فشار زیاد، قابل صرف نظر کردن نیست. پس در این حالت گاز غیر ایده آل رفتار می کند. می توان گفت که هر نوع گازی در فشار زیاد و یا دمای پایین، غیر ایده آل می شود. دقت داشته باشید که هرچه فشار زیادتر و دما کمتر شود، میزان عدم ایده آلی گاز نیز بیشتر می شود. یعنی میزان انحراف گاز مورد نظر از معادله حالت گاز ایدهآل (PV = nRT) بیشتر می شود.
به طور کلی، گاز های واقعی دو نوع انحراف از گاز ایده آل نشان می دهند.
- زمانیکه جاذبه بین مولکول ها مهم و غیر قابل چشم پوشی باشد (یعنی در فشار های زیاد)
- وقتیکه دافعه بین ذرات مهم و غیر قابل چشم پوشی باشد (یعنی در فشار های بسیار بسیار زیاد همچون چند صد اتمسفر)
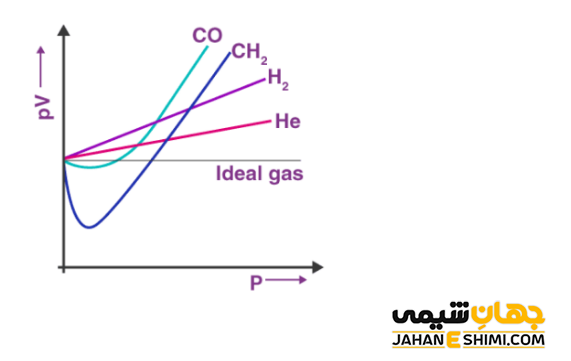
ضریب تراکم پذیری
به منظور تعیین ایده آل بودن یا نبودن یک گاز، معیاری به نام ضریب تراکم پذیری (Compressibility Factor) وجود دارد. ضریب تراکم پذیری (Z) اگر مساوی با ۱ باشد، گاز ایده آل یا کامل است. حال اگر بزرگتر و یا کوچکتر از ۱ باشد، گاز واقعی خواهد بود. هرچه از عدد ۱ فاصله بیشتری داشته باشد، انحراف از گاز ایده آل نیز بیشتر خواهد بود. همانطور که بیان شد، برای یک گاز ایدهآل، رابطه (PV = nRT) برقرار است. در حالیکه، دو طرف معادله فوق برای یک گاز واقعی، با یکدیگر برابر نیستند. پس، ضریب تراکم پذیری طبق معادله زیر تعریف می شود:
در یک گاز حقیقی، وقتیکه فشار گاز افزایش یابد، صورت کسر زیاد شده و مقدار عددی Z بزرگتر از ۱ خواهد شد. این حالت بیانگر انحراف از رفتار ایده آل است. علاوه بر آن، با کاهش دما نیز همین روند مشاهده می شود. به عبارت دیگر، زمانیکه چگالی یا فشار گاز مورد نظر بالا باشد، فاصله میان مولکول ها و یا ذرات گاز کم بوده، پس نیروی دافعه میان آنها عامل موثر محسوب می شود. در حالیکه، اگر فشار و یا چگالی گاز پایین باشد، فاصله میان مولکول ها و یا ذرات بیشتر بوده و نیروی جاذبه عامل موثر است. در دمای پایین، نیروی جاذبه بین مولکول های گاز نسبت به دمای بالا بیشتر است. پس، در دمای کم میزان انحراف از حالت ایده آل در مقایسه با دمای بالا بسیار بیشتر است.
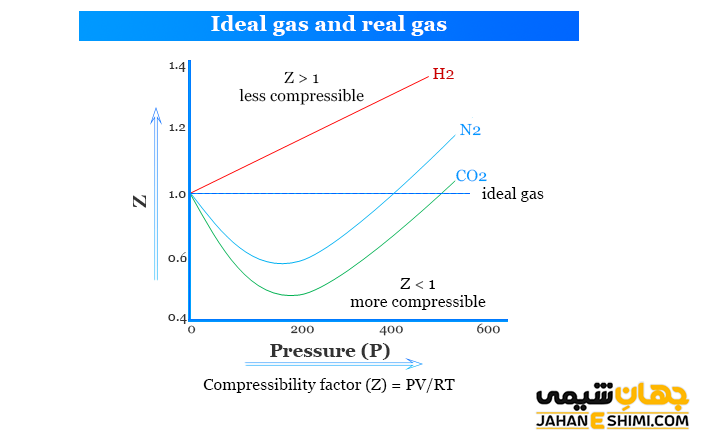
عامل موثر بر ضریب تراکم پذیری
ضریب تراکم پذیری به دو عامل فشار و دما بستگی دارد. فاکتور Z در فشار های پایین و دما های بالا کوچکتر از یک است (۱ ˂ Z)، در حالیکه در فشار های بالا و دماهای پایین فاکتور Z بزرگتر از یک خواهد بود. در چگالی یا فشار بالا که نیروی دافعه بر نیروی جاذبه غالب است، فشار گاز واقعی از فشار گاز ایده آل بیشتر می باشد. در اینصورت ۱ > Z بوده و متراکم کردن گاز واقعی نسبت به گاز کامل سخت تر است. عکس حالت فوق در فشار و چگالی های پایین رخ می دهد. در این حالت، فاکتور Z بزرگتر از یک بوده و متراکم کردن گاز واقعی نسبت به گاز کامل آسان تر است.



















