راهنمای کامل جدول تناوبی عناصر یا جدول مندلیف به همراه دانلود PDF
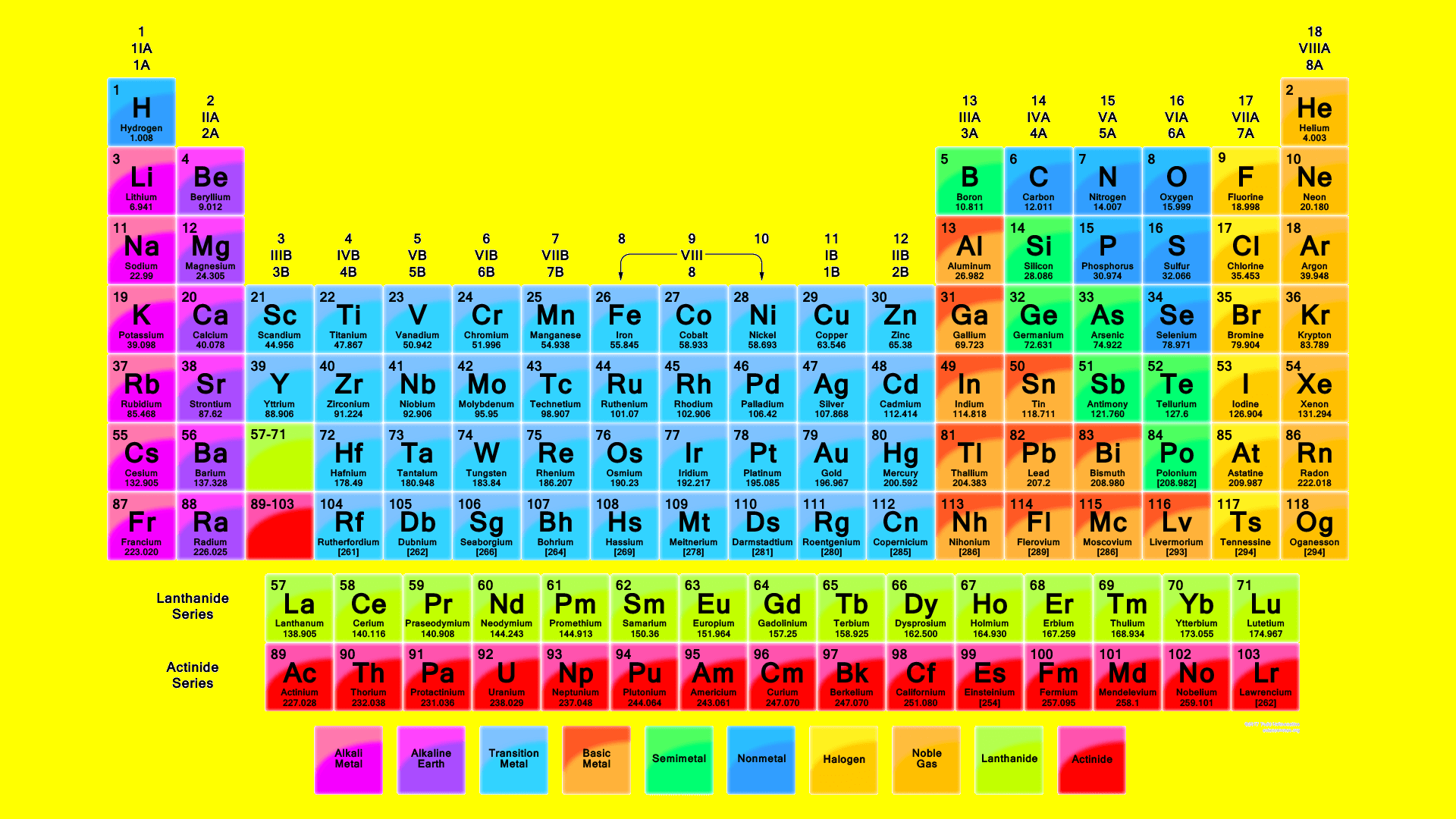
جدول تناوبی یا همان جدول مندلیف پایه و اساس علم شیمی به حساب می آید. عناصر پایه و اساس جدول تناوبی می باشند. این جدول به نام ابداع کننده روسی اولیه آن جدول مندلیف نیز خیلی از اوقات شناخته می شود.

جدول امروز شامل حدود یکصد و هیجده عنصر است که با توجه به افزایش عدد اتمی منظم مرتب در جدول تناوبی بر اساس خواص شیمیایی قرار گرفته اند که به همین دلیل نیز به آن جدول تناوبی اطلاق می شود.
در این مقاله علاوه بر ارایه یک نسخه باکیفت جدول تناوبی PDF مطابق با کتاب درسی شیمی ۱ پایه دهم، دوره دوم متوسطه، به بررسی تاریخچه کشف و ویژگی های شیمیایی گروه های مختلف این جدول، ساختار جدول تناوبی عناصر، چگونگی طبقه بندی عناصر و روندهای تناوبی نیز پرداخته می شود.

تاریخچه جدول تناوبی
زمانی که ارسطو فیلسوف بزرگ یونانی در ۳۰۰۰ سال پیش از میلاد مسیح، نظریه خود (نظریه چهار عنصری) مبنی بر اینکه همه مواد از چهار عنصر آب، باد، خاک و آتش درست شده اند را مطرح کرد، زمان شکوفه زدن تئوری عناصر بود. به بیان دیگر، جرقه شروع مطالعه بر روی خواص مواد از همین زمان آغاز شد. کیمیاگری به اسم برند هیننگ در سال ۱۶۴۸ در میان تحقیقات خود برای یافتن سنگ کیمیا، اولین عنصر را کشف کرد که سنگی سفید و درخشان بود. او نام این عنصر را فسفر گذاشت.
آنتوان لاووازیه
لاوازیه نهستین فردی بود که ده ها عنصر را بر اساس خواص و ویژگی های آن ها طبقه بندی کرد. در طبقه بندی لاوازیه، عناصر در چهار گروه گازها، فلزات، غیرفلزات و عناصر زمین قرار گرفتند. دسته بندی لاوازیه را می توان به عنوان موثرترین گام در فعالیت مرتبط با عناصر توسط دانشمندان دیگر دانست.
در سال ۱۸۲۹ یوهان دوبرینر به کشف جالبی رسید. او وقتی سه عنصر لیتیم، سدیم و پتاسیم را بر اساس خصوصیات مشابه در یک گروه جای داد متوجه شد می تواند با مقایسه عنصرهای کناری به خواص عنصر میانی برسد.
در ادامه جان نیوزلندی کسی بود که عناصر را بر طبق شباهت در جرم اتمی به هفت گروه با نام قانون اکتاها دسته بندی کرد.

شاهکار مندلیف
دیمیتری مندلیف (Dmitri Mendeleev) کسی است که در تنظیم جدول تناوبی و به طور کلی در علم شیمی منحصر به فرد است. او هر عنصر و خواص مربوط به آن را بر روی کارت هایی نوشت و همه ی این کارت ها را به دفعات مختلف با توجه به خصوصیات مختلفشان به حالت های گوناگونی در کنار یکدیگر قرار داد.
مندلیف، سرانجام به این قانون مهم رسید، عناصر بر اساس افزایش جرم اتمی به گروه های مشخصی تقسیم می شوند. در این گروه بندی در هر ستون خصوصیات شیمیایی عنصرها یکسان است و هر سطر عنصرها بر اساس افزایش جرم اتمی مرتب شده اند.
مندلیف قانون تناوب خود را اولین بار در سال ۱۸۶۹ به انجمن شیمی- فیزیک پترزبورگ ارایه کرد. این دانشمند بزرگ در ادامه بیست سال بر روی شاهکار خود کار کرد.
دلیل شهرت جدول مندلیف
علت اصلی شهرت جدول مندلیف این بود که این جدول همه عناصر حتی عناصری که تا آن زمان کشف نشده بودند را نیز در خود جای می داد. گالیم اولین عنصری بود که در جدول مندلیف جای خالی داشت و او نام این عنصر را اکا آلومینیم یعنی شبیه آلومینیم گذاشته بود. پس از کشف عنصر گالیوم، این عنصر در جایگاه خود قرار گرفت و با « اکا آلومینیم» جایگزین شد. عناصر دیگری نیز مثل اسکاندیم و ژرمانیوم پس از کشف شدن در سال های بعد، در خانه های خالی در نظر گرفته شده در جدول مندلیف قرار گرفتند. تنها گازهای نجیب بودند که مندلیف حتی وجود آن ها را پیش بینی نکرده بود اما این گازها خیلی منطقی بعد از کشفشان در سال های ۱۸۹۸-۱۸۹۲ جای خود را در جدول او پیدا کردند.
نکته دیگر اینکه برای مندلیف چیدن عناصر در یک گروه بر اساس خصوصیات شیمیایی یکسان به طبقه بندی آن ها بر طبق افزایش جرم اتمی ارجحیت داشت. این نظر مندلیف در قرار دادن تلوریم و ید بر خلاف جرم اتمیشان در جدول او کاملا مشهود است.
جدول تناوبی عناصر شیمیایی
۴۰ سال پس از کشف مندلیف، جدول تناوبی یکبار دیگر دچار شوک جدیدی شد و این بار هنری موزلی بود که با انجام آزمایشات روی طیف پرتو ایکس عناصر توانست عدد اتمی آن ها را بدست آورد. موزلی با کشف این موضوع که هر عنصر عدد اتمی خاص خود را دارد جدول مندلیف را به جای افزایش عدد جرمی بر حسب افزایش عدد اتمی برای تمامی عناصر کشف شده تا آن زمان مرتب کرد. در جدول موزلی نیز جای خالی برای عناصر کشف نشده وجود داشت و عدد اتمی، وزن اتمی و خصوصیات دیگر آن ها با توجه به هم گروه های خودشان مشخص می شد. ساختار جدول موزلی به شکل امروزی جدول تناوبی بسیار نزدیک است.
گروه جدول تناوبی
جدول مندلیف از ۱۸ ستون یا گروه تشکیل شده است. در هر گروه از جدول، چند عنصر قرار گرفته که خواص مشابهی دارند. این طبقه بندی در گذشته صورت گرفت اما امروزه تنظیم گروه های جدول تناوبی بر طبق آرایش الکترونی انجام می شود که در لایه ظرفیت آن ها وجود دارد. نام گذاری گروه های جدول بر اساس سه روش استفاده از اعداد هندی عربی و یا اعداد رومی است. روشی که امروزه استفاده می شود، استفاده از اعداد رومی است. همچنین حروف انگلیسی A و B نیز برای عناصر گروه های اصلی و واسطه به کار برده می شود.
ردیف جدول تناوبی
در جدول تناوبی عناصر ردیف هایی به نام دوره یا تناوب وجود دارد. دوره کمک می کند تا عناصری که دارای خواص شیمیایی یکسانی هستند در ستون هایی زیر هم قرار بگیرند. یک عنصر در یک تناوب نسبت به عنصر قبلی خود دارای یک پروتون و یک الکترون بیشتر است. زیرا جدول مندلیف بر اساس افزایش عدد اتمی تنظیم شده است. همچنین یک عنصر در این جدول در مقایسه با عنصر قبلی خود خاصیت فلزی کمتر و مقدار الکترونگاتیوی بیشتری دارد. جدول تناوبی از ۷ ردیف یا تناوب تشکیل شده است.
گروه شیمیایی در جدول تناوبی
گروه شیمیایی در جدول تناوبی نیز نشان دهنده همان گروه های اصلی و واسطه در جدول است. هر کدام از گروه های شیمیایی در جدول نشان دهنده عناصری با تعداد الکترون یکسان در لایه ظرفیت خود هستند. به عنوان مثال عناصر گروه اول دارای یک الکترون، عناصر گروه دوم دارای دو عنصر در لایه ظرفیت خود هستند. به همین ترتیب گروه های بعدی تنظیم می شوند.
قانون تناوبی چیست؟
مندلیف به این نتیجه مهم رسید که در جدول تناوبی با توجه به روند افزایشی جرم اتمی خصوصیات قابل اندازه گیری عناصر تحت تاثیر این روند نخواهد بود و این خواص به صورت متناوب گاهی افزایش و گاهی کاهش می یابد. قانون تناوبی یعنی خواص شیمیایی عناصر در جدول مندلیفی که براساس افزایش عدد اتمی مرتب شده است به طور تناوبی تکرار می شود.
کشف عناصر شیمیایی جدول تناوبی مندلیف
آیوپاک روش اصولی نامگذاری عناصر جدول مندلیف
اتحادیه بین المللی شیمی محض و کاربردی آیوپاک به عنوان نظامی تعریف می شود که در آن تمام پیشنهادات شیمی که در دنیا بیان می شود، بررسی شده و تایید و یا رد آن اعلام می شود. این سازمان در سال ۱۹۱۹ توسط شیمیدان ها تشکیل شده و اندازه گیری ها، استاندارد سازی ها، نمادها و نام هایی که برای عناصر در نظر گرفته می شود، توسط آن تایید می شود. علاوه بر نام گذاری عناصر، نام تمام ترکیبات شیمیایی نیز طبق قواعد تعیین شده در این انجمن، نوشته می شود. قواعد زیادی در آیوپاک برای نام گذاری ترکیبات تعیین شده است. به عنوان مثال اولین قاعده آن، انتخاب طولانی ترین زنجیر کربنی به عنوان زنجیر اصلی است.
بررسی ساختار جدول تناوبی عناصر مندلیف
جدول تناوبی شامل ۷ ردیف (تناوب) و ۱۸ گروه (ستون) است. عناصر تشکیل دهنده هر گروه دارای خواص مشابه هستند. برای مثال: هالوژن ها که عناصر گروه هفتم هستند تقریبا دارای یک رفتار شیمیایی هستند و همچنین عناصری که در یک ردیف قرار داند تعداد الکترون های ظرفیت (لایه آخر) یکسان دارند. اولین عنصر هر دوره یک فلز قلیایی و آخرین عنصر آن یک گاز نجیب است.
تعداد پروتون های هر عنصر عدد اتمی آن است. هیدروژن به عنوان اولین عنصر جدول تناوبی عدد اتمی یک را دارد. سنگینی عناصر با عدد اتمی آن ها تعریف می شود. عنصر سنگین تر به معنای بالا بودن تعداد پروتون های هسته آن عنصر است. پلوتونیم با عدد اتمی ۹۴ یکی از این عناصر است که در طبیعت وجود دارد اما اورانیم که از عناصر سنگین دیگر است باید در محیط آزمایشگاه و از برخورد هسته عناصر باهم بدست آید.
سطرهای جدول تناوبی
جدولی که مندلیف تنظیم کرد بر اساس افزایش عدد اتمی در سطرها و ستون هایی بود. به سطرهای جدول تناوبی، دوره یا تناوب می گویند. وقتی در هر دوره یکی از لایه های الکترونی، از الکترون پر شده و ظرفیت آن تکمیل می شود، سطر یا دوره بعدی شروع شده و الکترون های جدید به در این لایه قرار می گیرند. به همین ترتیب با پر شدن هر لایه، لایه بعدی شروع به پر شدن می کند که ردیف بعدی را تشکیل می دهد.
ستون های جدول تناوبی
اولین طبقه بندی که از جدول مندلیف شد، بر اساس خواص مشابه در عناصر بود. به این ترتیب که عناصر با خواص یکسان در یک ستون عمودی زیر یکدیگر قرار گرفتند. این گروه ها در ابتدا به صورت عناصر سه تایی بود. خواص عنصر وسطی میانگینی از خواص دو عنصر بالایی و پایینی بود. به عنوان مثال میانگین نقطه جوش عنصر دو عنصر بالایی و پایینی، نقطه جوش عنصر وسطی را تعیین می کرد.
طبقه بندی عناصر جدول تناوبی
عناصر در جدول مندلیف را به دو گروه فلز و نافلز، بدون مشخص کردن مرز دقیق و درست بین آن ها، تقسیم می کنند. فلزات گرما و الکتریسیته را به خوبی از خود عبور داده و نافلزات رسانای خوبی برای جریان الکتریسیته نیستند.
گروه های جدول تناوبی
در جدول مندلیف ۸ گروه اصلی به نام های ۱، ۲، ۱۳ تا ۱۸ و ۱۰ گروه فرعی به نام های گروه ۳ تا ۱۲ وجود دارد.
عناصر نماینده
عناصر نماینده یا گروه A عناصری هستند که در آخرین لایه الکترونی خود اوربیتال s یا p آن ها در حال پر شدن از الکترون است. برخی از این عناصر فلز و برخی نافلز هستند و خصوصیات دیامغناطیسی و پارامغناطیسی در آن ها متفاوت است اما ترکیباتشان بی رنگ و دیامغناطیس هستند. خواص شیمیایی این عناصر تحت تاثیر الکترون های ظرفیت آن ها (همان ویژگی های متشابه در یک گروه) است. در کل خصوصیات شیمیایی این گروه بسیار متفاوت و استثنائات زیادی وجود دارد که از قوانین پیروی نمی کند.
گروه ۱: فلزات قلیایی جدول تناوبی
به عناصر گروه اول جدول تناوبی فلزات قلیایی می گویند که هیروژن اولین عنصر این گروه است که به علت داشتن خواص متفاوت جز دسته این فلزات قرار نمی گیرد. این فلزات نرم بوده و چگالی پایینی دارند. نقطه ذوب و نقطه جوش این گروه پایین بوده و فقط یک الکترون در لایه ظرفیت خود دارند، پس به راحتی این الکترون برای رساندن عنصر خود به حالت پایدار در واکنش های شیمیایی شرکت می کند و شدت واکنش پذیری آن ها با حرکت از بالا به پایین گروه افزایش می یابد چون بر تعداد لایه های الکترونی افزوده شده و بار موثر هسته کاهش می یابد. فلزات قلیایی آنتالپی استاندارد ذوب و تبخیر کمی دارند. این فلزات شامل لیتیم، سدیم، پتاسیم، روبیدیوم، سزیم و فرانسیم می باشد.
گروه ۲: فلزات قلیایی خاکی جدول تناوبی
به عناصر گروه دوم از جدول تناوبی فلزات قلیایی خاکی می گویند. شدت واکنش پذیری آن ها از فلزات قلیایی کمتر است اما مانند آن ها از بالا به پایین جدول به دلیل افزایش تعداد لایه های الکترونی افزایش می یابد. شش عنصر این گروه شامل بریلیوم، منیزیم، کلسیم، استرانسیوم، باریم و رادیوم است. عنصر رادیوم در این گروه رادیواکتیو است.
گروه ۳ تا ۱۲: فلزات واسطه جدول تناوبی
به عناصر واسطه عناصر گروه B گفته می شود که اوربیتال d لایه ماقبل آخر در این گروه در حال پر شدن می باشد. ده گروه از جدول مندلیف که از گروه ۳ تا ۱۲ از آن را اشغال می کنند عناصر واسطه هستند که همگی فلز هستند و خاصیت انعطاف پذیری دارند. دربین آن ها جیوه تنها فلز مایع است. به جز روی، کادمیم و جیوه بقیه ای فلزات نقاط ذوب و جوش چگالی بالایی دارند.
لانتانیدها جدول تناوبی
دو ردیف از عناصر که در قسمت پایین جدول تناوبی هستند عناصر واسطه داخلی اند. جایگاه اصلی این عناصر در واقع در دوره های ششم و هفتم در خانه لانتان و اکتنیم است. اما بدلیل کمی جا در این دو خانه بصورت جداگانه در پایین جدول اما با ارجاع به این دو خانه قرار می گیرند. ۱۴عنصری که بعد از لانتان قرار می گیرد سری لانتانیدها بوده و در این عناصر اوربیتال ۴f در حال پر شدن است. لانتانیدها شامل عناصر با عدد اتمی ۵۷ تا ۷۱ هستند. تمام عناصر واسطه داخلی فلز و خاصیت پارا مغناطیسی دارند. اما ترکیبات این دسته پارا مغناطیس و رنگین هستند.
اکتینیدها جدول تناوبی
عناصری که به دنبال اکتنیم قرار می گیرد سری اکتنیدها نامیده می شود. این عناصر اعداد اتمی بین ۸۹ تا ۱۰۳ را دارند. از خصوصیات بارز این عناصر داشتن خاصیت رادیواکتیوی است. در اکتنیدها لایه ۵f در حال پرشدن می باشد.
گروه ۱۳: خانواده بور جدول تناوبی
عناصر گروه ۱۳ جدول مندلیف که شامل ۳ الکترون در لایه ظرفیت خود هستند شامل بور، آلومینیوم، گالیم، ایندیم و تالیم است. آرایش لایه ظرفیت آن ها به صورت ns۲ np۱ بوده و از خواص مهم آن ها تمایل به تشکیل کمپلکس چهاروجهی با یون های هالید است. آلومینیوم الکتروپوزیتیوترین عناصر در این گروه است که می تواند ترکیبات آلی فراوانی را تشکیل دهد. ترکیب اکسید و هیدروکسید عناصر این گروه، خواص متفاوتی از خود نشان می دهند. به عنوان مثال، اکسید و هیدروکسید آلومینیوم یک آمفوتر است در حالی که اکسید و هیدروکسید بور یک اسید محسوب می شود.
گروه ۱۴: خانواده کربن جدول تناوبی
عناصر گروه ۱۴ جدول تناوبی، ۴ الکترون در لایه ظرفیت خود داشته و شامل کربن، سیلیسیم، ژرمانیوم، قلع و سرب است. آرایش الکترونی لایه ظرفیت این عناصر به صورت ns۲ np۲ بوده و آن ها بین فلزات در سمت چپ و نافلزات در سمت راست جدول جای گرفتند. کربن مهمترین عنصر این گروه است که دارای خاصیت ویژه ی تشکیل زنجیرهای بلند کربنی است. ترکیبات آلی که از کربن تشکیل می شوند آلکان ها، آلکین ها، آلکن ها و … هستند. همچنین در بین این عناصر، کربن و سیلیسیم نافلز، ژرمانیوم نیم فلز و قلع و سرب فلز هستند.
گروه ۱۵: گروه نیتروژن جدول تناوبی
عناصر گروه ۱۵ جدول تناوبی با داشتن ۵ الکترون در لایه ظرفیت خود، دارای آرایش الکترونی لایه ظرفیتی به صورت ns۲ np۳ هستند. این عناصر شامل نیتروژن، فسفر، ارسنیک، آنتیموان و بیسموت هستند که فلز، شبه فلز و یا نافلز هستند. به طوری که در بین این عناصر، آرسنیک و آنتیموان یک شبه فلز هستند. نیتروژن در عناصر گروه ۱۵ مهمترین بوده و به عنوان عنصری مهم در زندگی گیاهان و جانوران محسوب می شود.
گروه ۱۶: گروه اکسیژن (کالکوژنها) جدول تناوبی
عناصر گروه ۱۶ جدول تناوبی دارای آرایش الکترونی لایه ظرفیت به صورت ns۲ np۴ بوده و شامل اکسیژن، گوگرد، سلنیوم، تلور و پولونیوم هستند. اکسیژن و گوگرد از مهمترین عناصر این گروه هستند و عناصر دیگر سمی هستند. پولونیوم در این گروه دارای خاصیت رادیواکتیوی است. اکسیژن گازی بی رنگ بدون مزه است که وجود آن برای حیات جانداران بسیار ضروری است.
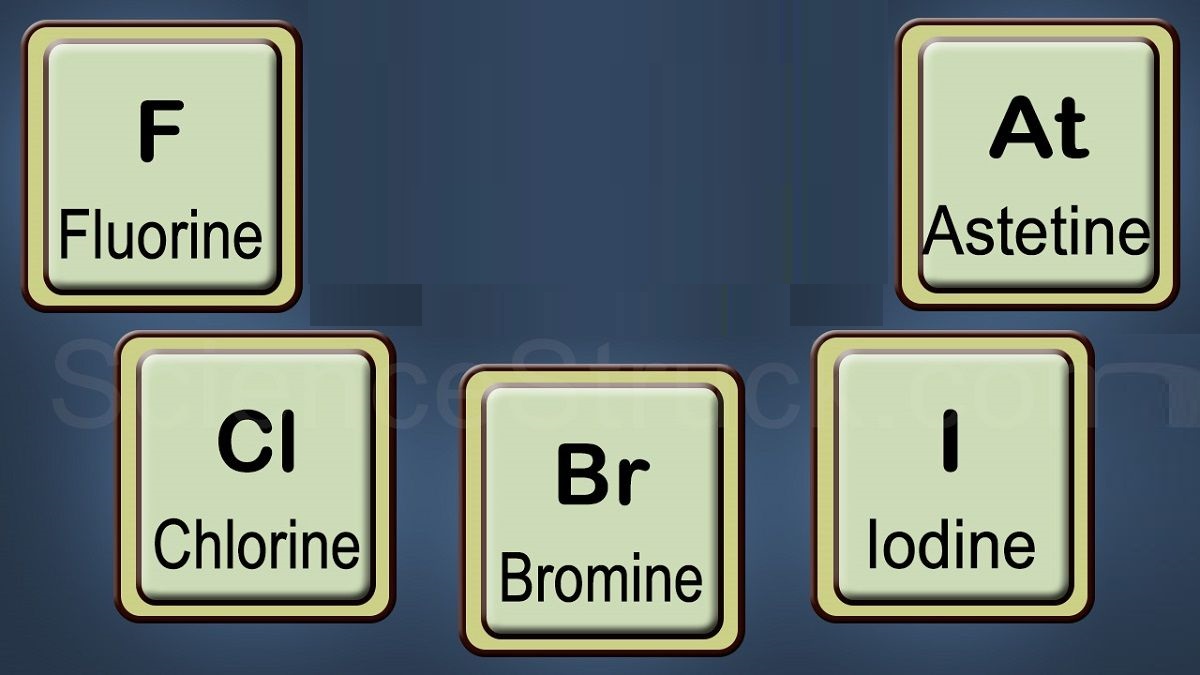
گروه ۱۷: هالوژنها جدول تناوبی
هالوژن ها گروه ۱۷ از جدول تناوبی را به خود اختصاص دادند. هالوژن ها هیچ وقت به حالت آزاد در طبیعت یافت نمی شوند آن ها به صورت مولکول های دو اتمی وجود دارند. البته برخی از این عناصر هنوز ناشناخته هستند. چون هالوژن ها فقط به یک الکترون احتیاج دارند تا به آرایش پایدار (اوکتت) برسند به همین دلیل واکنش پذیری بسیار بالایی دارند و می توانند با عناصر دیگر ترکیب شوند و ترکیبات خورنده ایجاد کنند. اما قدرت واکنش پذیری آن ها از بالا به پایین کاهش می یابد. این عناصر شامل فلوئور، کلر، برم، ید و استاتین هستند. فلوئور و کلر به صورت گازند اما برم مایع و ید به حالت جامد هست.
گروه ۱۸: گازهای نجیب جدول تناوبی
جایگاه گازهای نجیب در جدول تناوبی آخرین گروه (گروه صفر) است. چون این گروه از نظر آرایش الکترونی در حالت پایدار هشتایی هستند بنابراین از نظر شیمیایی غیر فعال هستند و هیچ میل ترکیبی با عناصر دیگر ندارند و به آن ها گازهای بی اثر هم گفته می شود. گازهای بی اثر بصورت تک اتمی یافت می شوند. از نظر الکترونگاتیوی قدرت کمی دارند اما بیشترین انرژی یونش را در هر دوره به خود اختصاص می دهند. همگی به شکل گاز هستند و نقاط ذوب کمی دارند. از بین این عناصر رادون و اوگانسون رادیواکتیو هستند. به جز هلیم که دو الکترون دارد بقیه این عناصر در لایه ظرفیت خود ۸ الکترون دارند.
سایر طبقه بندی ها در جدول تناوبی
دسته بندی های دیگری برای جدول مندلیف وجود دارد که در آن دیگر عناصر در دسته بندی گروه و یا ستون قرار نمی گیرند. با این دسته بندی ها می توان به اطلاعات زیاد و فهم درستی درباره عناصر و خواص مشترکی که دارند، رسید. در زیر به برخی از این دسته بندی ها به اختصار می پردازیم.
فلزات پس واسطه در جدول تناوبی
به عناصری از جدول مندلیف که شامل آلومینیوم، گالیم، ایندیم، تالیم، قلع، سرب و بیسموت هستند، عناصر پس واسطه می گویند. این عناصر همانطور که مشخص است در بین گروه های ۱۳ تا ۱۷ قرار گرفته و از نظر خواص، مشابه با فلزات واسطه هستند. اما این فلزات در مقایسه با فلزات واسطه نرم تر بوده و دارای میزان رسانایی کمتری هستند.
شبه فلزات در جدول تناوبی
به عناصری از جدول که شامل بور، سیلیسیم، ژرمانیوم، آرسنیک، آنتیموان، تلوریم و پلوریم هستند، شبه فلزات می گویند. رفتار شبه فلزات در برخی از آن ها به صورت یک نیمه هادی است. از عناصری که این گونه از خود رفتار نشان می دهند می توان به بور، سیلیسیم و ژرمانیوم اشاره کرد.
نافلزات در جدول تناوبی
عناصری از جدول تناوبی در دسته ی نافلزات قرار می گیرند. گازهایی چون هیدروژن، هلیم، اکسیژن، نیتروژن، فلوئور، نئون، کلر، آرگون، کریپتون، زنون و رادون نافلز هستند. علاوه بر گازها، برم به عنوان یک مایع و کربن، فسفر، گوگرد، سلنیوم و ید به عنوان جامد، در دسته ی نافلزات طبقه بندی می شوند.
روندهای تناوبی در جدول تناوبی یا مندلیف
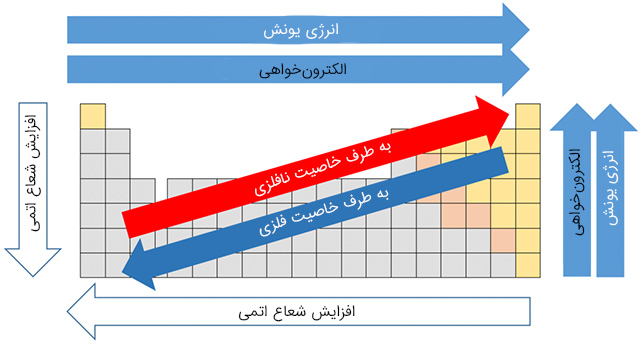
چگونگی تغییر شعاع اتمی
دریک گروه از جدول تناوبی با افزایش عدد اتمی، وقتی از یک ردیف به ردیف دیگر وارد می شویم، یک لایه به لایه های الکترونی هر عنصر اضافه می شود، یعنی شعاع اتمی افزایش می یابد.
اما در یک دوره از جدول شعاع اتمی از چپ به راست با کاهش مواجه است زیرا تعداد لایه های الکترونی که ثابت هستند اما بار موثر هسته بر الکترون های لایه ظرفیت زیاد شده، همین موضوع باعث کاهش شعاع اتمی می شود.
چگونگی تغییر انرژی یونش
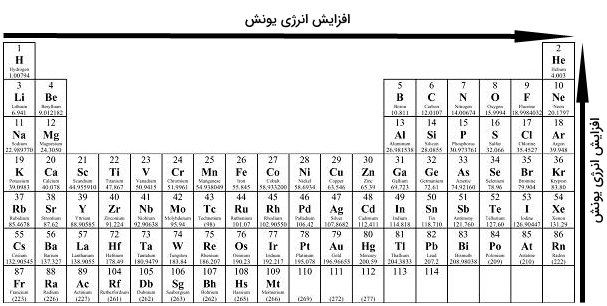
تغيير انرژی يونش در يک گروه از جدول تناوبی
انرژی یونش به معنای میزان انرژی لازم برای جدا کردن یک الکترون از یک اتم و تبدیل آن به کاتیون است. در هرگروه از جدول تناوبی با حرکت از بالا به پایین جدول بر تعداد لایه های الکترونی یعنی شعاع اتمی افزوده می شود. بعبارتی فاصله الکترون لایه ظرفیت از مرکز هسته زیاد شده، اثر پوششی الکترون های درونی افزایش می یابد، پس جا کردن الکترون از لایه آخر راخت تر انجام می شود و انرژی کمتری صرف می شود. پس نتیجه می گیریم انرژی یونش در یک ستون از جدول از بالا به پایین کاهش می یابد.
تغيير انرژی يونش در يک دوره از جدول تناوبی
همان طور که گفته شد در یک دوره از جدول تناوبی تعداد لایه های الکترونی است ولی چون عدد اتمی افزایش پیدا می کند، نیروی جاذبه هسته و به نسبت آن بار موثر هسته افزایش می یابد و الکترون های ظرفیت را بیشتر به سمت خود می کشد، ولی فاصله لایه ظرفیت از مرکز هسته کاهش می یابد، برای جدا کردن الکترون از لایه آخر به انرژی بیشتری مورد نیاز است. پس از چپ به راست در جدول تناوبی انرژی یونش افزایش می یابد.
چگونگی تغییر الکترونگاتیوی
میزان تمایل اتم به جذب الکترون ظرفیت به سمت هسته خود را الکترونگاتیوی می گویند. هر چه شعاع اتمی کاهش یابد الکترونگاتیوی افزایش می یابد، همچنین هرچه بر تعداد الکترون های ظرفیت افزوده شود الکترونگاتیویته زیاد می شود. بر این روال در جدول تناوبی در یک دوره از چپ به راست الکترونگاتیوی افزایش و در یک گروه از بالا به پایین الکترونگاتیوی کاهش می یابد. در جدول فلزات کمترین الکترونگاتیوی و نافلزات الکترونگاتیوی بیشتری دارند. پس الکترونگاتیوترین عنصر در گوشه بالای سمت راست جدول و برعکس عنصر با کمترین الکترونگاتیوی در گوشه پایین جدول است.
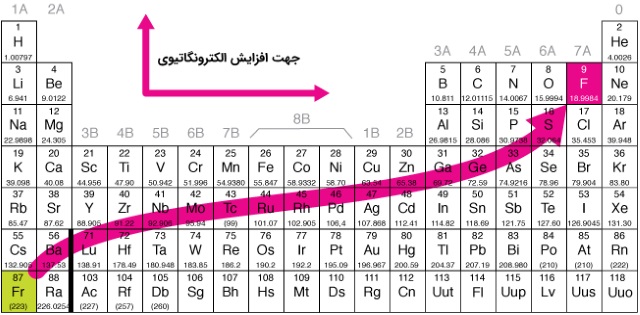
چگونگی تغییر انرژی الکترونخواهی
انرژی الکترون خواهی مقدار انرژی آزاد شده افزودن یک الکترون از اتم خنثی در فاز گازی و تبدیل آن به یک یون منفی است. با توجه به تعریف انرژی آزاد شده در حین انجام واکنش های شیمیایی می توان گفت علامت انرژی الکترون خواهی همیشه منفی است. چون در نافلزات تعداد الکترون های لایه ظرفیت نزدیک به آرایش هشتایی است الکترون خواهی بیشتری نسبت به فلزات که الکترون های والانس کمتری دارند. به عنوان مثال هالوژن ها بیشترین انرژی الکترون خواهی (با مقدار منفی) را در جدول دارند. در این گروه فلوئور رفتار غیر عادی از خود نشان می دهد.
بنابراین در جدول تناوبی تناوبی در یک دوره از چپ به راست الکترون خواهی افزایش و در یک گروه از بالا به پایین کاهش می یابد.
چگونگی تغییر خاصیت فلزی در جدول تناوبی
به میزان میل اتم به از دست دادن الکترون و تشکیل یک کاتیون، خاصیت فلزی می گویند. همانطور که قبلا نیز گفته شد شعاع اتمی در یک گروه از بالا به پایین زیاد می شود همان دلیل بر افزایش خاصیت فلزی است و اما در یک تناوب خاصیت فلزی از چپ به راست کاهش می یابد.
چگونگی تغییر نقطه ذوب در جدول تناوبی
نقطه ذوب یعنی دمایی که در آن دما یک ماده از حالت جامد به حالت مایع در میآید. هر چه پیوند بین اتمها قویتر باشد، انرژی لازم برای شکستن پیوند بیشتر و نقطه ذوب بالاتر می رود. در جدول تناوبی قانون تناوبی منظمی برای نقطه ذوب وجود ندارد ولی در کل فلزات نقاط ذوب بالایی دارند و نقطه ذوب نافلزات پایین است.
تعریف برخی اصطلاحات مهم در جدول تناوبی
در این قسمت به بررسی برخی از اصلاحات مهم در جدول مندلیف مثل عدد اتمی (A)، نماد شیمیایی، عدد جرمی (Z) می پردازیم.
عدد اتمی ( A )
به تعداد پروتون های هسته هر اتم عدد اتمی آن می گویند. مثلا عدد اتمی هلیم دو است چون دو پروتون دارد، سدیم با عدد اتمی سه، دارای سه پروتون است. به همین نسبت عدد اتمی هر عنصر با تعداد پروتون های آن برابر است. در علامت اختصاری هر عنصر عدد اتمی در قسمت پایین، در سمت چپ نشان شیمیایی نوشته می شود. در یک اتم خنثی تعداد پروتون های یک اتم (عدد اتمی) با تعداد الکترون های آن برابر است.
نماد شیمیایی
هر عنصر با یک نماد شیمیایی مشخص می شود. اکثر نمادهای شیمیایی از نام انگلیسی آنها گرفته شده است. این نمادها شامل یک، دو و یا سه حرف هستند. به عنوان مثال نماد شیمیایی هیدروژن H و نماد شیمیایی هلیم He می باشد.
عدد جرمی ( Z )
مجموع تعداد پروتون ها و نوترون های هسته یک اتم را عدد جرمی آن اتم می گویند. عددی صحیح می باشد که مجموع تعداد پروتون ها و نوترون های هسته یک اتم را مشخص می کند. از اختلاف عدد جرمی و عدد اتمی یک عنصر تعداد نوترون های آن به دست می آید.
عدد جرمی وقتی اهمیت پیدا می کند که ایزوتوپ تعریف می شود. چون برخی عناصر ایزوتوپ های مختلف دارند به عبارتی دیگر ایزوتوپ های مختلف یک عنصر عدد جرمی متفاوتی دارند. مثلا هیدروژن دارای سه ایزوتوپ با اعداد جرمی یک، دو و سه است. دو ایزوتوپ پریتیم (ایزوتوپ یک) و دوتریم (ایزوتوپ دو) هسته های پایداری دارند اما ایزوتوپ سه هیدروژن (تریتیم) دارای هسته رادیواکتیو می باشد.
شکل دیگر جدول تناوبی
همان طور که بیان شد عناصر در جدول مندلیف بر اساس خاصیت تناوبی قرار دارند. بر این اساس گروهی از دانشمندان جدول مندلیف را به صورت یک دایره تنظیم کردند. ترسیم جدول به این صورت می تواند در تفهیم انداره نسبی اتم ها بسیار مناسب باشد. به صورتی که اتم های نزدیکتر به مرکز دایره، کوچکتر و اتم های دورتر، بزرگتر بوده و شعاع بزرگتری دارند. در این شکل از جدول، هلیم و هیدروژن که به صورت تکی جدول تناوبی قرار داشتند، در مرکز این دایره قرار می گیرند. تنها با چرخاندن این شکل از جدول است که می توان آن را خواند و این یکی از نقاط ضعف آن محسوب می شود. چون این طریق خواندن در کامپیوتر و همچنین کتاب های مرجع ممکن نیست.
جدول تناوبی کتاب درسی
شکلی از جدول مندلیف که در کتاب های درسی ترسیم می شود با جدولی که در ابتدای این مقاله گذاشته شده است، کمی متفاوت است. ولی در هر حال سعی بر آن است که شکل امروزی تر این جدول مورد بررسی قرار گرفته و در کتاب های درسی وارد شود.
نام عناصر جدول تناوبی به فارسی
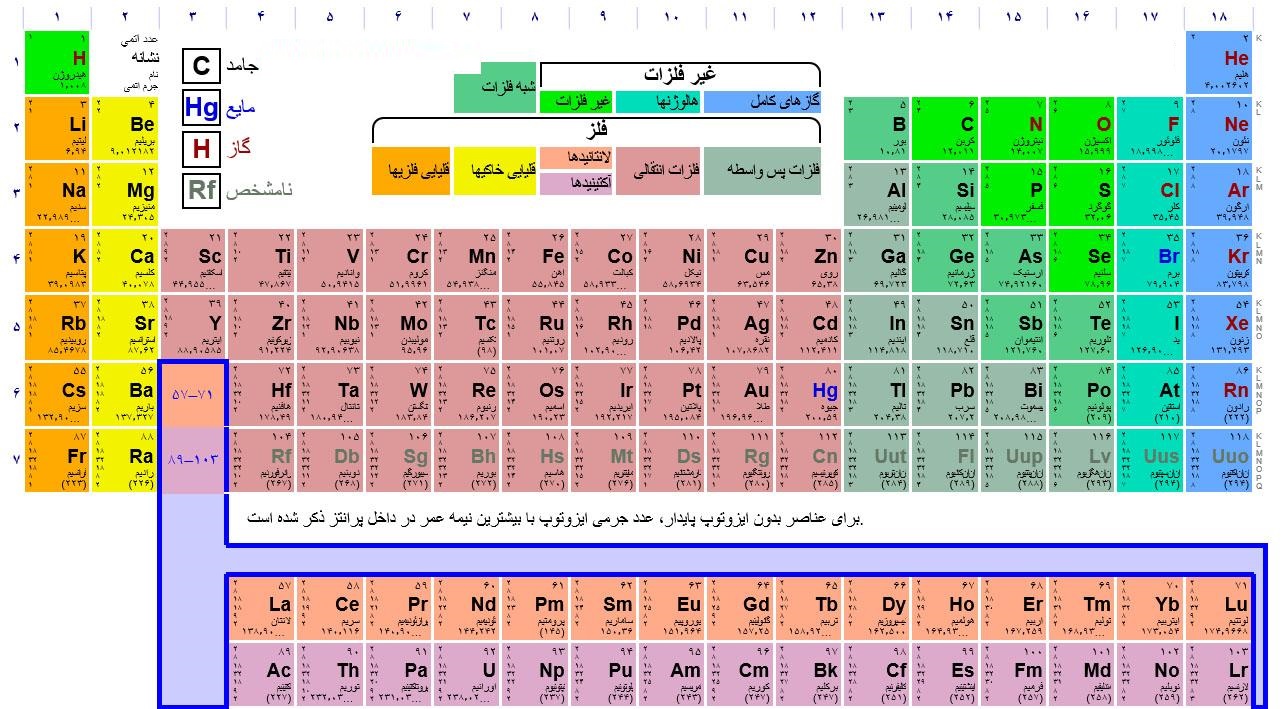
در جدول تناوبی فارسی نام عناصر به فارسی نوشته شده است. اگرچه نماد عناصر به انگلیسی کاملا مشخص است و باید آنها را به خاطر سپرد اما ممکن است جدول تناوبی فارسی به یادگیری نام عناصر کمک کند.
عناصر اصلی جدول تناوبی
عناصر اصلی جدول تناوبی شامل فلزات، نافلزات و شبه فلزات هستند. این عناصر در قالب گروه های مختلف در جدول تناوبی دسته بندی می شوند. از نظر فراوانی فلزات بخش بزرگی از جدول تناوبی را به خود اختصاص داده اند و بعد از آنها نافلزات و شبه فلزات قرار دارند.
بار عناصر جدول تناوبی
برای تعیین بار عناصر جدول تناوبی باید ساختار الکترون های موجود در اوربیتال ها را مورد نظر قرار دهید. فلزات برای تکمیل لایه الکترونی خود مایل به از دست دادن الکترون هستند بنابراین بار مثبت دارند. برعکس نافلزات الکترون جذب کرده و دارای بار منفی هستند. گازهای نجیب جدول تناوبی هم به دلیل ساختار الکترونی کامل تمایلی به جذب یا از دست دادن الکترون ندارند بنابراین هیچ باری ندارند.
عناصر گروه سوم جدول تناوبی
عناصر گروه سوم جدول تناوبی خانواده بور هستند که شامل شبه فلز بور و فلزات آلومینیم، گالیم، ایندیم و تالیم است. بور و آلومینیم در این گروه به دلیل کاربرد گسترده از اهمیت ویژه ای برخوردار هستند.
تعداد عناصر جدول تناوبی
تعداد عناصر جدول تناوبی ۱۱۸ است که ۱۱۴ عنصر آن نامگذاری و تایید شده اند. از بین عناصر مذکور ۹۸ عنصر در طبیعت وجود دارند. سایر عناصر نیز در آزمایشگاه ساخته شده اند که برخی از آنها هنوز توسط آیوپاک تایید نشده است.
جدول عناصر
جدول عناصر شیمیایی یا جدول تناوبی به عنوان یکی از قابل تشخیص ترین تصاویر در علم، در فرهنگ ما ریشه دوانده است. جدول عناصر اولین بار در سال ۱۸۶۹ توسط دیمیتری مندلیف ترسیم شد. ۱۱۸ عنصر آن نه تنها همه چیز در سیاره ما، بلکه همه چیز در کل جهان را تشکیل می دهند.
عناصر کوچکترین واحدهای ماده هستند که توسط فرآیندهای شیمیایی بیشتر تجزیه نمی شوند. ۱۱۸ عنصر شناخته شده وجود دارد، اما همه آنها به طور طبیعی وجود ندارند و تعداد کمتری از آنها برای زندگی ضروری هستند. ماده زنده عمدتاً از کربن، نیتروژن، هیدروژن و اکسیژن و مقادیر کمتری از عناصر دیگر مانند کلسیم، فسفر، پتاسیم و گوگرد تشکیل شده است. عناصر دیگر نیز برای زندگی ضروری هستند اما فقط به مقدار کمی.
جدول تناوبی به داستان جذاب و کاربردهای شگفت انگیز هر یک از این عناصر اعم از جامد، مایع یا گاز نگاه می کند. از کاربردهای کمتر شناخته شده طلا در پزشکی گرفته تا ساخت بمب هیدروژنی، هر عنصری با داده های فنی (دسته، عدد اتمی، وزن، نقطه جوش) ارائه شده و با سیستم کدگذاری همراه است که به خواننده کمک می کند تا در میان گروه های مختلف عناصر حرکت کند. این راهنما که نمایش قابل توجهی از علم تفکر برانگیز و عکاسی زیبا است، به خواننده این امکان را می دهد که جهان را از نو کشف کند.
این مرجع علمی مفید، “بلوک های سازنده” همه مواد را در یک چیدمان مناسب و با مصور غنی نشان می دهد. علاوه بر این حاوی تمام اطلاعات لازم برای دستیابی به درک کاملی از دنیای شیمی است. جدول عناصر در قالبی ارائه شده است که توصیف شفافی از هر عنصر را به نمایش می گذارد. جدول تناوبی یک منبع برجسته برای دانش آموزان شیمی دبیرستان و کالج و هر کسی است که کنجکاوی علمی دارد.
جدول مندلیف فارسی
در جدول مندلیف فارسی نماد شیمیایی، عدد اتمی، جرم اتمی و گروه بندی دقیقا مانند جدول مندلیف قدیمی است اما به فارسی نوشته شده است تا برای دانش آموزان قابل فهم تر باشد. این جدول به صورت استاندارد توسط مندلیف، دانشمند روسی، طراحی شده و در نسخه فارسی فقط اطلاعات علمی آن به زبان فارسی نوشته شده است که خصوصا برای دانش آموزانی که تازه با شیمی آشنا می شوند بسیار مفید است. جدول مندلیف فارسی را می توانید از اینترنت دانلود کرده و برای خودتان چاپ کنید یا اینکه در زمینه گوشی یا لپ تاپ خود قرار دهید. این جدول بسیار ساده است و شما به راحتی می توانید آن را یاد بگیرید. به مبتدیان جوان علم شیمی توصیه می شود که با این جدول یادگیری عناصر را شروع کنند شاید برای آنها ملموس و راحت تر باشد.
پرسش و پاسخ
جدول تناوبی عناصر چیست؟
جدول تناوبی یا عناصر یا جدول مندلیف، یک ساختار بسیار دقیق و کامل است که تمامی عناصر کشف شده طبق نظمی مشخص در آن معرفی شده اند. عناصر این جدول در هشت گروه عمودی و هفت دوره تناوب افقی، با ترتیب عدد اتمی، چیده شده ند. لانتانیدها و اکتیندها نیز در دو گروه افقی جداگانه در پایین جدول قرار گرفته اند.
چطور جدول تناوبی را حفظ کنیم؟
با توجه به اینکه حفظ کردن جدول تناوبی عناصر یکی از موارد بسیار مهم برای بسیاری از دانش آموزان و دانشجویان رشته شیمی است، پیشنهاد می کنیم ابتدا اصول ساختاری این جدول را که در این مقاله به طور کامل توضیح داده شده است یاد گرفته و سپس عناصر هر بخش را بررسی کنید.
خواص عناصر گروه ۱۶ جدول تناوبی مدنلیف چه هستند؟
گروه ۱۶ جدول تناوبی که به گروه اکسیژن یا کالکوژنها معروف است، شامل عناصر اکسیژن، گوگرد، سلنیوم، تلوریوم، پولونیوم و لیورموریوم است. این گروه در دسته P که شامل گروه های ۱۳ تا ۱۸ است قرار گرفته و به عنوان شبه فلزات شناخته می شود.
دسته های جدول تناوبی عناصر چیست؟
جدول تناوبی شامل چهار دسته کلی است که بر اساس اوربیتال فرعی الکترون لایه آخر نام گذاری شده اند. دسته s شامل دو گروه اول جدول و عناصر هیدروژن و هلیوم است. گروه های ۱۳ تا ۱۸ (شامل شبه فلزات) را دسته اعضای p هستند. دسته d شامل گروه های ۳ تا ۱۲ است و به عنوان فلزات واسطه شناخته می شوند. گروه f نیز شامل لانتانیدها و اکتینیدها است.
دانلود جدول تناوبی pdf
با کلیک بر روی لینک های پایین می توانید نسخه با کیفیت جدول تناوبی عناصر را با به دو صورت عکس (JPG) و PDF دانلود نمایید.
- دانلود جدول تناوبی PDF (دانلود نسخه PDF جدول تناوبی عناصر (جدول مندلیف) | مطابق با کتاب درسی شیمی ۱ پایه دهم، دوره دوم متوسطه)
- دانلود عکس جدول مندلیف با کیفیت بالا


















عالی بود ممنون از سایت عالی تون من خیلی لذت بردم . جامع و کامل
عالي دم شما گرم
چنتا سايتو گشتم ولي هيچكودوم به خوبيه شما نبود.
موفق باشيد😉
خواهش میکنیم
سپاس
عالییییییی بسیار متشکرم
خیلی خوب بود
متشکرم
جدول تناوبی شیمی دهم
تست شیمی دهم کنکور سراسری
عدد جرمی و تعداد نوترون اتمی به ترتیب برابر با ۱۶ و ۸ می باشد. این اتم متعلق به کدام دوره جدول تناوبی می باشد؟
الف: دوره اول
ب: دوره دوم
ج: دوره سوم
د: دوره چهارم
دوره دوم،،،، عنصر اکسیژن
ب
کنکور چه سالی؟ ۱۳۶۰؟ lol
فلزات جدول تناوبی
بچه چنتا نکته کنکوری فلزات اینجا می گم؛
خواص فلزات:
فلزات، رسانای خوب گرما و الکتریسیته هستند.
براق هستند.
شکل پذیرند (می توانند به صورت سیم های نازکی درآورده شوند.)
چکش خوارند (می توانند با کوبیدن و ضربه خوردن به صورت ورقه های نازکی درآیند.
یک خاصیت شیمیایی فلز، واکنش آن با آب است که منجر به زنگ زدگی و خوردگی فلز می شود.
ممنون
جدول تناوبی نهم بهمراه لینک دانلود رو قرار دادید
مطالب تون خیلی مفید و کاربردی هست
درود
از اینکه جدول تناوبی pdf و فایل عکسش رو گذاشتین خیلی ازتون ممنونم
الان می تونم pdf پرینت کنم و تا زمان کنکوری حسابی مرور کنم
فلزات و نافلزات جدول تناوبی
تغییرات برخی خاصیت های شیمیایی در جدول تناوبی
خاصیت فلزی
از بالا به پایین و از راست به چپ، خصلت فلزی در جدول تناوبی افزایش پیدا می کنه
فلزات، بزرگ ترین دسته ی عناصر را تشکیل می دهند. تمام فلزات به جز جیوه، در دمای اتاق فلز هستن و بیش تر آنها درخشندگی نقره گون دارن. به علاوه، فلزات معمولا چکش خوار و شکل پذیر هستن و رساناهای خوب گرما و الکتریسیته ان.
نافلزات
خصلت نافلزی از بالا به پایین و از چپ به راست در جدول تناوبی کم میشه. ۱۷ غیرفلز در جدول وجود دارد و در دمای اتاق، ۱۱ تای آنها گازی و یکی از آنها (برم) به صورت مایع و ۵ تای آنها به صورت جامد هستن( کربن، فسفر، گوگرد، سلنیوم و ید). هیچ کدام از نافلزات، نقره گون نیستند و بیش تر به رنگ های براقند. نافلزات جامد به جای نرم و چکش خوار بودن، شکننده اند و رسانای ضعیف گرما و الکتریسیته هستن
ممنون از شما
که جدول تناوبی کامل همراه توضیحات و لیک دانلود pdf رو گذاشتید
این صفحه خیلی کامل و عالی هست
سلام خوشحالیم که مطلب جدول تناوبی یا جدول مندلیف و لینک دانلود pdf جدول تناوبی برای شما مفید بوده است.
گروه ۳ تا ۱۲: فلزات واسطه
عناصر واسطه یا «فلزات واسطه»، عناصری هستن که زیرلایه d اونها به صورت جزئی پر شده.
لانتانیدها و اکتینیدها هم تو این گروه قرار می گیرن.
عناصر واسطه، فلزاتی سخت، چکشخوار (شکلپذیر)، براق و رسانای خوب الکتریسیته هستن.
در حقیقت، زمانی که واژه فلز را بکار میبریم، اولین چیزی که به ذهن میاد، شکل و خواص فلزات واسطه که از جمله اونا میشه به طلا، نقره، آهن، مس و پلاتین اشاره کرد
لانتانیدها عنصرهای ۵۸ تا ۷۱جدول تناوبی را تشکیل میدهند و جزو عناصر واسطه داخلی میباشند. وجه تسمیه لانتانیدها از عنصر ۵۷ جدول یعنی لانتان (La) گرفته شده است. باید توجه داشت که خواص شیمیایی این دسته از عناصر مشابه خواص لانتان میباشد همچنین به این گروه از عناصر ، عناصر خاکهای کمیاب نیز اطلاق میشود.
اکتینیدها همانند سایر فلزات و نرم هستن
تمامی شون رنگی نقرهای دارند در برابر هوا، کِدر میشوند. اکتینیدها دارای چگالی و پلاستیسیته بالایی هستند.
بعضی از اکتینیدها مثل فلزات قلیایی با چاقو برش میخورن. عنصری مثل «توریم» را میتوان حرارت داد و همانند فولاد، آن را به ورقههایی تبدیل کرد. چگالی این عنصر در حدود نصف چگالی اورانیوم و پلوتونیوم و از هردو این عناصر سنگینتر هست.
گروه ۱۳: خانواده بور
گروه سیزدهم جدول مندلیف یا خانواده بور (Boron Family)، شامل شبه فلز بور و فلزات آلومینیوم، گالیم، ایندیم و تالیم میشود.
گروه ۱۴: خانواده کربن
گروه خانواده کربن شامل چهاردهمین گروه از گروه های جدول تناوبی است. عناصر کربن، سیلیکون (سیلیسیم)، ژرمانیوم، قلع و سرب، ۵ عنصر این گروه را تشکیل میدهند.
عنصر «فلروویم» هم انتظار میره رفتاری مشابه سایر عناصر این گروه داشته باشه و به همین دلیل، آنرا در گروه ۱۴ جای میدن. گروه کربن در نزدیکی مرکز جدول تناوبی قرار دارد که در سمت راست آن، نافلزات و در سمت چپ آن، فلزات قرار دارن
گروه ۱۵: گروه نیتروژن
گروه پانزدهم جدول تناوبی شامل عناصر نیتروژن و فسفر (جز دسته نافلزات)، آرسنیک و آنتیموان (جز دسته شبه فلزات) و بیسموت (جز دسته فلزات) است.
آرایش الکترونی لایه ظرفیت این عناصر به صورت nS2 nP3 است و به این عناصر گروه خانواده نیتروژن نیز می گویند.
گروه ۱۶ : گروه اکسیژن (کالکوژنها)
کالکوژن به عناصر گروه ۱۶ جدول تناوبی گفته میشود. این گروه به خانوادهٔ اکسیژن نیز معروف هستند.
این خانواده از اکسیژن، گوگرد، سلنیوم، تلوریم و عنصر رادیواکتیو پولونیوم تشکیل شدهاست.
عنصر لیورموریوم سنتزشده نیز پیشبینی میشود که در این گروه قرار بگیرد.
اغلب با اکسیژن جدای از سایر کالکوژنها برخورد میشود و گاهی اوقات نیز از محدوده نام کالکوژنهای جدا میشود به دلیل رفتار شیمیایی متفاوتی که نسبت به سایر کالکوژنها مانند سلنیوم، سولفور، پولونیوم و تلوریوم نشان میدهد.
سولفور از روزگار باستان شناخته شدهاست و اکسیژن در قرن ۱۸ به عنوان یک عنصر شناخته شد. سلنیوم، تلوریوم و پولونیوم نیز در قرن ۱۹ و لیورمیوم در سال ۲۰۰۰ شناخته شدند.
همه کالکوژنها ۶ الکترون ظرفیتی دارند. رایجترین حالت اکسیداسیونی +۲٬۲، +۴، +۶ است.
کالکوژنها و مخصوصاً سبکترین آنها شعاع اتمی نسبتاً کوچکی دارند. کالکوژنهای سبک در حالت عنصریشان اغلب غیرسمی و عنصر مهم برای حیات هستند در حالی که سنگین ترها معمولاً سمی هستند.
همهٔ کالکوژنها نقش کوچکی در فعالیتهای بیولوژیکی دارند مثلاً به عنوان مواد مغذی یا سم. کالکوژنهای سبک مانند سولفور و اکسیژن به صورت خالص اغلب مفید هستند. سلنیوم ماده مغذی بسیار مهمی، اما معمولاً سمی است. تلوریوم اغلب تأثیرات ناخوشایندی دارد و پولونیوم به دلیل سمیت شیمیایی و خاصیت رادیواکتیویته آن همیشه بسیار خطرناک است.
گروه ۱۷: هالوژنها
هالوژنها گروه ۱۷ از عناصر در جدول تناوبی را با نامهای فلوئور، کلر، برم، ید و اَستاتین تشکیل میدهند. در زمان واکنشِ هالوژنها با فلزات، نمکهای بسیاری از جمله «کلسیم فلوراید»
تمامی هالوژن ها موادی بسیار سمی هستند و در زمان پیوند با هیدروژن، تولید اسید میکنند. یک هالوژن معمولا از نمکها و مواد معدنی بدست میآید. از کلر، برم و ید در ضدعفونیکنندهها استفاده میشود.
گروه ۱۸: گازهای نجیب
گازهای نجیب، (VIIIA) عنصرهای اصلی گروه هشتم
این گروه شامل عنصرهای گازی هلیم، نئون، آرگون، کریپتون و زنون است که حدود یک درصد حجم هوا را تشکیل میدهند.
کاربردهای مهم
در تهیه تابلوهای نئون (هلیم: زرد، نئو ن: قرمز، آرگو ن: قرمز یا آبی، کریپتون: سبز مایل ·
به آبی و زنون: آبی متمایل به سبز).
تهیه هوای تنفسی برای غواصی، رقیق کردن اکسیژن برای تنفس بیماران مبتلا به آسم ·
و جوشکاری.
تهیه لامپهای فلورسان و لامپهای معمولی و…
طبقه بندیهای دیگر در جدول تناوبی
برای بررسی جدول تناوبی، دستهبندیهای دیگری نیز ارائه میشوند که مختص به یک ستون یا گروه نیستند و به کمک آنها میتوان درک بهتری از عناصر و خواص مشترک بین برخی از آنها پیدا کرد. که به اختصار عبارتند از
فلزات پسواسطه
شبهفلزات
نافلزات
فلزات پس واسطه
روی، کادمیوم و جیوه معمولا جزو فلزات واسطه به حساب نمیآیند چراکه زیرلایه d آنها با آرایش الکترونی کاملا پر شده است. تحت شرایطی خاص، این عناصر به عنوان «فلزات پس واسطه» شناخته میشوند.
شبه فلزات
شبه فلزات مرز باریکی میان فلزات و نافلزات هستند وخواصی میان این دو دارند .
شبه فلزات مرز باریکی میان فلزات و نافلزات هستند وخواصی میان این دو دارند .
شبه فلزات در دمای اتاق بصورت جامد با رنگ نقره ای وجود دارند . ویژگی چکش خواری در شبه فلزات کم و شکنندگی در آنها زیاد است . شبه فلزتی که خواص فلزی بیشتری دارند چکش خواری بیشتری نیز خواهند داشت .
شبه فلزات شامل موارد زیر هستند : بور – سیلیسیوم – ژرمانیوم _ آرسنیک – آنتیموان – تلوریوم – پولونیوم . بعنوان مثال می توانیم به سیلیکون اشاره کنیم که رسانایی آن مابین عایق و هادی است .
عناصر دیگری نیز در جدول وجود دارند که خواص شان نامشخص است . درباره ی مایه تعنصر پولونیوم اختلاف نظر وجود دارد .برخی دانشمندان آن را شبه فلز و برخی آن را نا فلز می نامند.
ظرفیت گروه ها در جدول تناوبی
جدول تناوبی از ۱۸ ستون یا گروه تشکیل شده که در هر گروه تعداد الکترون های ظرفیت عناصر یکی است.
در یک گروه از جدول با حرکت از بالا به پایین شعاع اتمی با افزایش تعداد لایه های الکترونی، افزایش می یابد. اما به دلیل آن که با افزایش فاصله الکترون های ظرفیت از هسته اتم، به انرژی بیشتری برای جداکردن الکترون نیاز است، انرژی یونش عنصرها در یک گروه با افزایش تعداد لایه های الکترونی، کاهش می یابد.
به همین ترتیب الکترون دوستی در یک گروه، به واسطه فاصله بیشتر الکترون های ظرفیت از هسته، کاهش پیدا می کند.
خواص نافلزات
در هر سه حالت جامد و مایع و گاز دیده میشوند.
به غیر از الماس، موادی نرم هستند.
در حالت جامد، خاصیت شکنندگی دارند و به قطعات کوچکتری خرد میشوند.
به غیر از ید، هیچکدام شفاف نیستند.
الکترونگاتیوی بالایی دارند.
نسبت به فلزات، چگالی کمتری دارند.
تعداد شبه فلزات ۶ تاست
شش شبه فلز شناخته شده معمولاً بور، سیلیکون، ژرمانیم، آرسنیک، آنتیموان و تلوریم هستند.
شکل دیگر جدول تناوبی
در دیگر شکل جدولها، دو مجموعهٔ لانتانیدها و اکتینیدها به صورت دو ردیف (دوره) در میانهٔ بدنهٔ اصلی جدول جای داده میشود.
مواردی که برای یادگیری جدول تناوبی عناصر در کتاب درسی باید مورد توجه قرار دهید :
موارد استثنا در جدول تناوبی
خصوصیات مشترک عناصر یک گروه
روند تدریجی خواص عناصر در یک جدول
آشنایی اولیه با مفاهیمی مانند طول پیوند ، شعاع اتمی ، شعاع واندروالسی
افزایش انرژی نخستین یونش
افزایش خصلت نافلزی – کاهش خصلت فلزی
افزایش بار مؤثر هسته- افزایش جاذبه ی هسته بر لایه ی الکترونی
افزایش الکترونگاتیوی
کاهش شعاع اتمی
سلام
من تو شیمی دوم دبیرستان، هنوز متوجه نشدم که اکتینیدها و لانتانیدها تو کدوم گروه و خانواده جدول تناوبی قرار دارن، از چند نفر پرسیدم هر کدومشون یه جواب دادن
الکترون ظرفیت گروه های جدول تناوبی
الكترون ظرفیت با الكترون والانس هر یک از الکترون های لایه خارجی اتم که در ایجاد پیوندهای شیمیایی شرکت می کنند، می گویند. در واقع لایه ظرفیت همان آخرین لایه اصلی الکترونی یا آخرین سطح انرژی اصلی می باشد. برای هر اتم، تعداد الکترونهای ظرفیتی برابر با شماره گروهی از جدول تناوبی است که عنصر مورد نظر به آن تعلق دارد، چنانچه مولکول، به صورت یونی دارای بار منفی باشد، به تعداد بار مولکول، به تعداد کل الكترونها افزوده می شود و چنانچه دارای بار مثبت باشد، به همان تعداد از بار الكترون کاسته می شود
من دنبال دانلود جدول تناوبی به صورت عکس با کیفیت هستم ، منتها چون خودم می خوام تغییراتی روی جدول تناوبی اعمال کنم؛ به نسخه خام تصویر هم برای ویرایش نیاز دارم ، شما امکان ارسال نسخه خام جدول تناوبی را نیاز دارید؟
مقاله خیلی خوبی درباره جدول تناوبی تهیه کردید؛ فقط پیشنهاد می کنم، که توی مقاله جدولی قرار بدید و تک تک عناصر جدول مندلیف رو شرح و توضیح بدید.
یک پیشنهاد خیلی خوب برای پوستر جدول تناوبی دارم؛ من معلم شیمی دبیرستان هستم،
اگر شما پوستر بزرگ و جذاب جدول تناوبی را به رایگان در اختیار مدرسین حوزه شیمی با لوگوی خودتون قرار بدید ؛ معلمان هم برای تدریس علوم دوره راهنمایی یا شیمی دبیرستان از پوستر کاغذی جدول مندلیف شما استفاده می کنند.
توسعه جدول مندلیف یکی از مسائلی هست که در مورد این جدول خیلی ذهنم رو مشغول کرده ،
میشه جواب بدید که آیا امکان داره به طور منطقی باز هم عناصری به جدول تناوبی اضافه بشه؟
دنبال لیستی هستم که عناصر جدول مندلیف را به ترتیب سال کشف شون در سطرهای جدول نشان دهد.
اگر کسی شرایط تهیه چنین لیستی رو دارد حاضر به پرداخت هزینه هم هستم
ما دنبال خرید عمده ۵۰۰ عدد جدول تناوبی چاپی بزرگ هستیم، که به پوستر زیبا، شکیل و خوانا باشد
سایر فروشگاه های آنلاین ، نه برای جدول تناوبی طراحی اختصاصی انجام می دهند و نه برای فروش عمده تخفیف می دهند.
خیلی هم برای خرید عجله داریم،
شما فروش عمده جدول تناوبی چاپی دارید
به نظر شما بهترین راه برای به خاطر سپردن عناصر جدول تناوبی چیست ؟
برای حفظ کردن و یاد گیری عناصر جدول مندلیف بازیهای زیادی وجود دارد ؛ اما دنبال یک بازی مناسب هستم که برای تدریس جدول تناوبی از آن استفاده کنم
پیشنهادی دارید؟
خیلی مشتاقم که یک بازی فکری جدول تناوبی به عنوان هدیه تولد برای پسرم بخرم؛
چون پسرم به شدت به جدول تناوبی و کلا شیمی علاقه بسیار زیادی داره،
شما امکان معرفی بازی فکری جدول مندلیف رو دارید؟
اگر شما پذیرای پیشنهاد هستید؛ پیشنهادی عالی برای مفیدتر کردن مقاله جدول تناوبی سایت شما دارم،
طراحی یک مسابقه ، آموزش جدول تناوبی به نظرم شما رو بین سایت های دیگه واقعا متمایز می کند.
لطفاً به پیشنهادم حتما فکر کنید
سلام و وقت بخیر
به جرئت می تونم بگم که کمتر مقاله ای ، مثل این مقاله ، جدول تناوبی رو به طور کامل و مفصل توضیح داده
واقعا خسته نباشید داره
نسخه قابل دانلود جدول تناوبی را در مقاله قرار دادید؛ اما ایکاش فرمت های مختلف تصویری و فرمت خام جدول مندلیف را برای کسانی که نیاز به اعمال تغییرات روی تصویر جدول دارند به خوبی قرار می دادید
من معلم شیمی دبیرستان هستم ؛ یک سری ویدیوی آموزشی در رابطه با آموزش جدول تناوبی تهیه کردم،
تمایل به همکاری با سایت جهان شیمی ، برای فروش بسته آموزشی جدول مندلیف دارم.
در صورتی که مدیریت سایت شما هم مشتاق به این همکاری باشد.
شما تو این صفحه عکس جدول تناوبی رو قرار دادید ؛ ولی تک تک عناصر کلیک می کنم
توضیحات بیشتری به من نشون نمی ده، انتظار داشتم وقتی روی هر عنصر از جدول تناوبی کلیک می کردم ؛ وارد صفحه ای میشد که مفصلا در موردش توضیح می داد
با سلام وخسته نباشید
ارائه PDF جدول تناوبی بسیار عالی بود . و جای تشکر دارد . من رشته ام مکانیک است واستفاده مفید بردم
با سلام و عرض ادب ، من دروس شیمی و فیزیک و ریاضی رو حدود بیست و چند سالی میشد که کنار گذاشته بودم ولی اکنون با رشد فرزندم مجبور شدم که به گذشته برگردم و دنبال جزوه ای باشم که یادآور باشه برام ( البته من پسرم چون در کانادا تحصیل میکنه ) مجبور شدم خیلی کار کنم تا بتونم اول خودم رو آپدیت کنم و بعد مطالب رو از فارسی به انگلیسی بهش توضیح بدم .
و باید بگم که مطالب شما یکی از کاملترین ها هستش و تشکر فراوان از شما و گروهی که مطالب را تدوین و آماده و تایپ میکنند رو دارم.
سر بلند و پایدار باشید.
مرسی از اطلاعات کاملی که کمک کرد بعد ۸ سال همه چیزو تو نیم ساعت به یاد بیارم.
فقط اگه اشتباه نکنم، توی یکی از بندها، نمادهای مربوط به عدد اتمی و جرمی، جابجا تایپ شده.
امیدوارم روز فوقالعادهای داشته باشید.