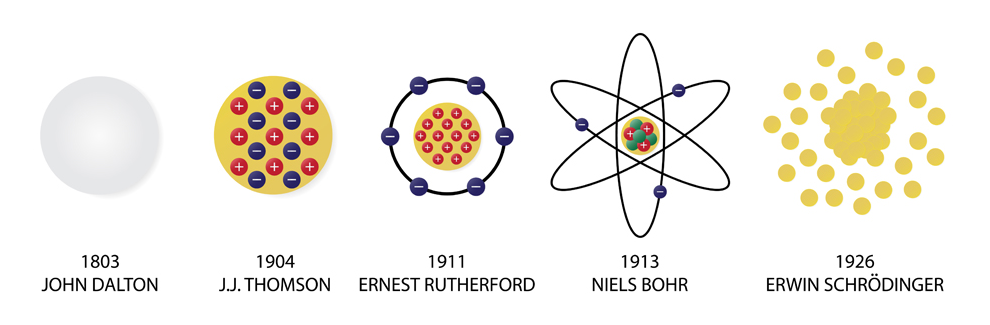
در علم شیمی، درک ساختار اتم ها و همچنین برهمکنش میان آنها بسیار مهم و حیاتی است. نظریه اتمی در واقع با استفاده از علوم شیمی، فیزیک و ریاضی توضیحی علمی از ماهیت اتم ها و ماده می دهد. برای اولین بار جان دالتون، نظریه اتمی را ارائه داد. اما این نظریه در طول زمان تکامل پیدا کرده است. در این مقاله در نشریه جهان شیمی فیزیک، تاریخچه نظریه اتمی، تکامل نظریه اتمی و در نهایت نظریه اتمی مدرن را به طور مختصر بیان می کنیم.
فهرست مطالب این مقاله
تاریخچه نظریه اتمی
نظريه اتمي در عصر جديد
قانون بقای جرم
قانون نسبت های معین
نظریه اتمی دالتون
قانون نسبت های چندگانه
چالش هاي نظريه اتمي دالتون
نظریه اتمی تامسون (مدل کیک کشمشی یا مدل هندوانه ای)
نظریه اتمی رادرفورد (مدل اتم هسته دار)
نظریه اتمی بور (مدل سیاره ای)
نظریه اتمی کوانتومی
تفاوت نظریه اتمی بور و نظریه کوانتومی
تاریخچه نظریه اتمی
برای یافتن نقطه شروع نظریه های اتمی باید به دوران بسیار قدیم (یونان باستان) برگردیم. زیرا کلمه اتم به معنای تجزیه ناپذیر برای اولین بار از یونان باستان آمده است. دانشمندان تصور می کردند كه ماده می تواند تا بی نهایت تقسیم شود. لوسيپوس (Leucippus) در حدود ۲۳۰۰ سال پیش این ایده را که مواد از ذرات بسیار ریزی تشکیل شده اند را مطرح کرد. در واقع وی معتقد بود که می توان با بریدن و یا شکستن مواد، آنها را به ذرات کوچک و کوچکتر تقسیم نمود. این تقسیمات تا جایی ادامه پیدا می کند که ذره نهایی دیگر قابلیت تقسیم شدن نداشته باشد. در حقیقت اعتقاد داشت که ماده از اجزا بسیار ریز تجزیه ناپذیری به نام اتم تشكیل شده است.
دموکریتوس (Democritus) شاگرد لوسيپوس بود که به نظریه استادش علاقمند شد و نظریه مذکور را گسترش داد. به نظر دموکریتوس، همه ی مواد از ذرات بسیار ریزی به نام اتم تشکیل شده اند. این ذرات غیر قابل مشاهده و غیر قابل تجزیه می باشند. دموکریتوس همچنین معتقد بود که اتم های مواد مختلف دارای شکل های متفاوتی می باشند.
این نظريات توسط افرادي چون اپيكوروس (Epicurus) و لوكريتوس (Lucretius) گسترش یافتند. متاسفانه این نظریه ها تنها بر اندیشه و فکر بیان شده بودند و به وسیله عمل و یا آزمایش اثبات نشدند. بنابراین این نظريات در حدود دو هزار سال فقط به صورت اندیشه باقی ماندند.
در قرن ۱۸، راجر بسکوویچ (Rudjer Boscovich) دوباره نظریه های بالا را زنده کرد. از نظر بسکوویچ، اتم ها در حقیقت نقاط بی اسکلتی هستند که بسته به فاصله آنها از هم، می توانند به یکدیگر نیروهای جذب کننده و یا دفع کننده وارد نمایند.
نظريه اتمي در عصر جديد
در اواخر قرن ۱۸، علم توانست شواهد محکمی از وجود اتم ها ارائه دهد. در سال ۱۷۸۹، آنتونی لاوازیه (Antoine Lavoisier) قانون پایستگی جرم را مطرح کرد و بعد از آن در سال ۱۷۹۹، ژوزف پروست (Joseph Proust) قانون نسبت های معین را ارائه نمود. علی رغم اینکه این دو نظریه هیچ اشاره ای به اتم ها نکرده بودند، اما دالتون از آن ها به عنوان پایه و اساس نظریه خود استفاده کرد. بنابراین قبل از بررسی نظریه اتمی دالتون، ابتدا به بررسی این دو نظریه می پردازیم.
قانون بقای جرم
بر طبق قانون بقای جرم، در یک واكنش شيميايی جرم محصولات با جرم مواد اوليه برابر است. در واقع می توان گفت جرم كلي مواد در جریان واکنش شیمیایی تغيير نمی کند. آنتونی لاوازیه با استفاده زیاد از ترازو، انقلابی در علم شیمی پدید آورد. وی از طریق قانون بقای جرم توانست تعدادی از پدیده های شیمیایی را توجیه کند.
قانون نسبت های معین
قانون نسبت های معین پایه و اساس استوکیومتری در علم شیمی است. این قانون بیان می کند که نسبت عناصر در تمامی نمونه های یک ترکیب شیمیایی خالص همواره یکسان است. مثلا، یک مولکول آب همیشه از یک اتم اکسیژن و دو اتم هیدروژن تشکیل شده است. به بیان دیگر، آب همواره از ۱۱/۱۹ درصد هیدروژن و ۸۸/۸۱ درصد اکسیژن تشکیل شده است. در واقع طبق تعریف قانون نسبت های معین، عناصر با نسبت های معینی با هم ترکیب می شوند و یک ترکیب شیمیایی را به وجود می آورند.
نظریه اتمی دالتون
جان دالتون (John Dalton) نظریه اتمی خود را در سال ۱۸۰۳ با استفاده از نظريات لاوازيه و پروست و مطالعه نظریه های سایر گذشتگان بیان کرد. نظریه اتمی دالتون توانست توضیحی برای بسیاری از مسائل در شیمی (از جمله واکنش های شیمیائی، قانون بقای جرم و قانون نسبت های ساده) که قبلا کشف شده بودند ارائه دهد. دالتون نظريه اتمي خود را به شرح زير بيان کرد:
- ماده از ذرات تجزيه ناپذيري به نام اتم تشكيل شده است.
- يك عنصر از اتم هاي مشابه به وجود آمده است.
- اتم ها کروی شکل هستند.
- همه اتم هاي يك عنصر جرم و خواص شیمیایی يكسان دارند.
- اتم های عنصر های مختلف جرم و خواص شیمیایی متفاوتی دارند.
- اتم هاي عناصر مختلف به هم متصل شده و یک ماده مرکب شیمیایی را به وجود مي آورند.
- در یک ماده مرکب معين، همواره نوع، نسبت و تعداد اتم هاي سازنده آن يكسان و ثابت است.
- اتم ها در طی یک واكنش شيميايي تفکیک می شوند و يا شيوه اتصال آنها تغيير می کند، اما در طي اين واكنش ها نه به وجود مي آيند و نه از بين مي روند.

قانون نسبت های چندگانه
نظریه اتمی دالتون قانون بقای جرم لاوازیه و قانون نسبت های جرمی معین پروست را توضیح می دهد. دالتون می گوید که جرم مواد به دلیل جرم اتم های آنها می باشد. از آنجاییکه اتم ها در طی یک واکنش شیمیایی نه تولید می شوند و نه نابود، بنابراین جرم آنها و همچنین جرم مواد در واکنش های شیمیایی تغییر نمی کند. در واقع با انجام واکنش شیمیایی، جرم مواد اولیه با جرم محصولات برابر خواهد بود.
از طرفی قانون نسبت های جرمی معین را به این گونه توضیح می دهد: هر ماده مرکب از اتم های سازنده به نسبت اعداد کامل که ثابت و معین اند تشکیل می شود. همان طور که در بند ۴ بیان شد، جرم تمام اتم های یک عنصر با هم برابر می باشند، بنابراین نسبت جرم عناصر سازنده یک ماده مرکب که در واقع همان نسبت جرم اتم های تشکیل دهنده آنها می باشد، ثابت و معین است.
جان دالتون بر اساس دو نظریه لاوازيه و پروست قانون نسبت های چندگانه را ارائه داد. این قانون از داده های تجربی گرفته شده است. قانون نسبت های چندگانه دالتون بیان می کند که جرم های عناصر در یک ترکیب (زمانیکه دو عنصر بیش از یک ترکیب ایجاد کنند)، عدد هایی صحیح و کوچک میباشند.
چالش هاي نظريه اتمي دالتون
با پیشرفت علم بسیاری از بند هاي نظريه اتمي دالتون رد شد. به عنوان مثال، با كشف اشعه کاتدی و آزمايش هاي انجام شده مشخص گردید که اتم ها قابل تجزیه می باشند. امروزه می دانیم که اتم ها از ذرات ریزی به نام الکترون، پروتون و نوترون ساخته شده اند (نقض بند ۱). با کشف ایزوتوپ ها مشخص گردید که، اتم های یک عنصر می توانند جرم های متفاوتی داشته باشند (نقض بند ۲). از طرفی در واکنش های هسته ای و یا مواد پرتوزا، اتم ها ممکن است تجزیه و همچنین به اتم های دیگری تبدیل شوند (نقض بند ۳).
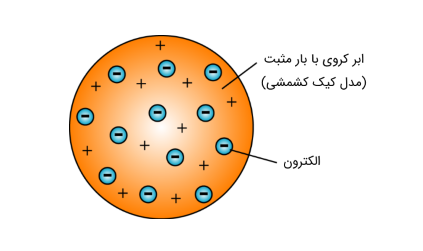
نظریه اتمی تامسون (مدل کیک کشمشی یا مدل هندوانه ای)
در سال ۱۸۹۷ جان تامسون (John Thomson) الکترون ها را کشف کرد. با کشف الکترون، تامسون قسمتی از نظریه اتمی دالتون را پذیرفت اما مدل دیگری را پیشنهاد داد. در مدل پیشنهادی تامسون، اتم را یک کره با بار مثبت که الکترون ها به صورت نقطه در سراسر این کره پراکنده شده اند در نظر گرفت. در واقع این مدل را می توان به صورت یک کیک کشمشی در نظر گرفت که در آن، کشمش ها نقش الکترون و کیک نقش کره با بار مثبت را دارند. از آنجاییکه اتم ها خنثی می باشند، بنابراين مجموع بار منفی الكترون ها با مقدار بار مثبت فضاي كروي ابرگونه مساوی است. همچنین، جرم اتم ها را به جرم الکترون های آن اتم نسبت داد.
نظریه اتمی رادرفورد (مدل اتم هسته دار)
یکی از دانشجویان تامسون به نام ارنست رادرفورد (Ernest Ratherford) مدل کیک کشمشی را در سال ۱۹۰۹ رد کرد. رادرفورد نظریه اتم هسته دار را پیشنهاد داد. مدل پیشنهادی رادرفورد به این صورت بود که، اتم ها را دارای هسته های کوچکی در نظر گرفت. هسته دارای بار الکتریکی مثبت است. رادرفورد متوجه شد که بیشتر جرم اتم و بار مثبت در هسته متمرکز می باشد. الکترون ها به دور هسته می چرخند. قسمت بیشتر حجم اتم را فضای خالی پیشنهاد داد.
نظریه اتمی بور (مدل سیاره ای)
مدل رادرفورد اشکالاتی داشت. به عنوان مثال قادر به توضیح طیف نشری و جذبی اتم ها نبود. از طرفی با اینکه رادرفورد الكترون ها را در خارج از هسته قرار داد، اما دلیلی برای اینکه چرا الکترون ها بر روی هسته سقوط نمی کنند نداشت. امروزه می دانیم که اگر الكترون ها در اطراف هسته در حال چرخش باشند، انرژي خود را از دست داده، شعاع گردش به مرور کم شده و در نهایت به درون هسته سقوط خواهند کرد. این اتفاق مخالف با پايداري اتم ها است.
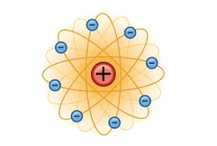
نیلز بور (Niels Bohr) دو سال بعد از رادرفورد مدل دیگری را پیشنهاد کرد. در مدل پیشنهادی بور، الکترون ها بر روی مدار هایی دایره ای شکل در اطراف هسته میچرخند. انرژي الكترون ها در اطراف هسته با فاصله آنها از هسته متناسب مي باشد.
بور در اطراف هسته هفت سطح انرژي در نظر گرفت، اگر الکترون های يك اتم در سطح بالاتري قرار گرفته باشند انرژي آنها نيز بيشتر است، بنابراین راحت تر از اتم جدا مي گردند. بر طبق این مدل الکترون ها نمی توانند به طور پیوسته انرژی از دست بدهند، بنابراین دیگر بر روی هسته سقوط نمی کنند. در واقع در این مدل برای انرژي الكترون ها میزان كوانتومي پیشنهاد شد.
نظریه اتمی کوانتومی
نظریه اتمی بور نسبت به نظریه های پیش از خود بهتر و کامل تر بود. نظریه بور توانست خطوط طیفی اتم هیدروژن را توضیح دهد اما در توصیف سیستم های بزرگتر و در واقع چند الکترونی ناتوان بود. علاوه بر آن، مدل بور با یکی از قوانین ارزشمند مکانیک کوانتومی (اصل عدم قطعیت هایزنبرگ)، تناقض دارد. در اصل عدم قطعیت هایزنبرگ بیان شده است که موقعیت و سرعت یک الکترون را نمی توان به طور همزمان اندازه گیری کرد.
در مدل کوانتومی، محل یک الکترون با قطعیت بیان نمی شود بلکه از احتمالات حرف می زند. از جمله دانشمندانی كه در پیشبرد این مدل اتمی سهم داشتند، میتوان به هایزنبگ (Werner Karl Heisenberg)، پلانک (Max Karl Ernst Ludwig Planck) و اروين شرودینگر (Erwin Schrodinger) اشاره کرد.
شرودينگر با استفاده از خاصيت ذره اي – موجي الكترون و با بکار بردن یک سری معادلات ریاضی مدل جامع تري را ارايه داد. این مدل تا کنون توانسته پديده هاي مختلف را توضیح دهد. در مدل شرودينگر از احتمال حضور الكترون در اطراف هسته صحبت شده است نه در مدار های دایره ای و معین. به این مناطق از فضا که احتمال حضور الكترون بیشتر است اوربیتال های الکترونی می گوییم. این اوربیتال ها می توانند کروی، دمبلی شکل و … باشد. شكل این اربيتال ها را با حل كردن معادلات شرودينگر به دست می آوریم.
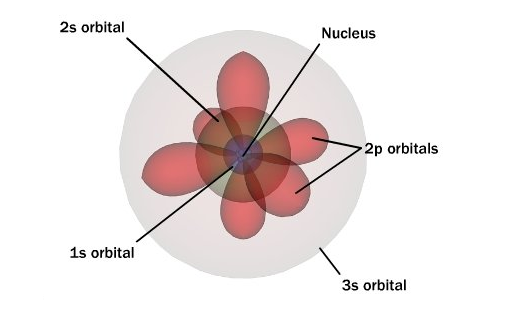
تفاوت نظریه اتمی بور و نظریه کوانتومی
در مدل اتمی بور برای معرفی الکترون از یک عدد کوانتومی استفاده شده است، درحالیکه در مدل کوانتومی چهار عدد کوانتومی را در نظر می گیرد. در مدل بور برای الکترون مسیر های دایره ای شکل در اطراف هسته در نظر گرفته، درحالیکه در مدل کوانتومی از احتمال حضور الکترون در اطراف هسته صحبت می شود.



















