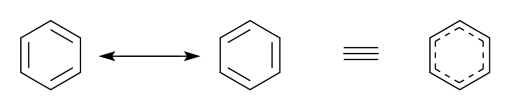
ساختار رزونانسی (Resonance Structure)، برای مولکول هایی کاربرد دارد که ساختار لوویس پیشنهاد شده برای آنها، نشان دهنده خواص واقعی و کامل مولکول نباشد. این خواص مولکولی می توانند مواردی مانند طول پیوند، زاویه پیوند و یا ممان دوقطبی باشد. در واقع در این حالت، از چندین ساختار لوویس به جای یک ساختار لوویس بهره می برند. این ساختار های پیشنهادی تنها در نحوه توزیع الکترون ها تفاوت دارند و مجموعا خواص واقعی و کامل مولکول مورد نظر را نشان می دهند. لازم به ذکر است که ساختار واقعی مولکول به وسیله هیبرید رزونانسی (Resonance Hybrid) که میانگینی از ساختار های رزونانسی می باشد نشان داده می شود. در ادامه این مقاله در نشریه جهان شیمی فیزیک به بررسی ساختار های رزونانس پرداخته می شود. لطفا با ما همراه باشید.
فهرست مطالب این مقاله
۱- مقدمه
۲- ساختار رزونانسی
۱-۲- رسم ساختار رزونانسی
۲-۲- سهم هر ساختار رزونانسی
۳- هیبرید رزونانسی
۱-۳- رسم ساختار هیبرید رزونانسی
۴- پایداری هیبرید رزونانسی
۵- لیست مولکول های مختلف با داشتن ساختار رزونانسی
مقدمه
ساختار های لوئیس پیشنهادی، در نمایش الکترون های غیر مستقر ضعیف عمل می کنند، بنابراین برای نمایش آنها از پدیده رزونانس کمک می گیرند. اما الکترون های غیر مستقر کدامند ؟ الکترون های پیوندی می توانند به جای اینکه تنها بین دو اتم مستقر باشند، بین بیش از دو اتم به اشتراک گذاشته شوند. بنابراین جاذبه بیش از دو هسته را احساس می کنند که به آنها، الکترون های پیوندی غیر مستقر می گویند. از طرف دیگر، الکترون های ناپیوندی نیز می توانند بین دو یا چند اتم به صورت همزمان قرار گیرند. در این حالت نیز تنها تحت تاثیر یک هسته قرار ندارند، بنابراین دیگر مستقر نیستند.
ساختار رزونانسی
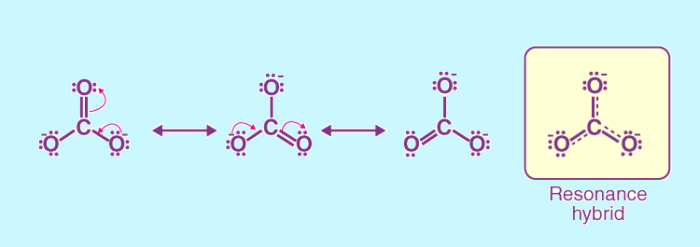
ساختار رزونانس در حقیقت ساختاری است که رابطه بین چند ساختار لوئیس پیشنهادی را با ساختار واقعی مولکول بر اساس جابهجایی الکترون توجیه می نماید. توجه داشته باشید که نباید ساختار های رزونانسی را به صورت مخلوطی از هم در نظر گرفت. در واقع تمام این ساختار های لوئیس پیشنهادی، توصیف کننده ساختار الکترونی مولکول می باشند، اما هیچ کدام به تنهایی کامل و واقعی نیستند. همانطور که بیان شد، تنها هیبرید رزونانسی می تواند ساختار الکترونی واقعی مولکول را نشان دهد.
رزونانس زمانی اتفاق می افتد که یک پیوند پای در مجاورت پیوند های سیگمای کاملا مشابه قرار بگیرد. در واقع حالتی است که در آن الکترون های پیوند دوگانه در مولکول غیر مستقرند. به عنوان نمونه می توان رزونانس در مولکول O۳ را در نظر گرفت. مولکول اوزون دارای یک پیوند دوگانه (O=O) و یک پیوند یگانه (O-O) می باشد. همانطور که می دانید طول پیوند O=O (120/7 پیکومتر) کمتر از طول پیوند O-O (148 پیکومتر) می باشد، بنابراین با توجه به رابطه بین طول پیوند و انرژی پیوند، باید انرژی پیوند O=O بیشتر از O-O باشد.
اندازه گیری طول پیوند و انرژی پیوند ها در مولکول اوزون نشان می دهد که هر دو پیوند اکسیژن – اکسیژن از نظر انرژی و طول پیوند (۱۲۷/۲ پیکومتر) با هم برابر و در حقیقت حد واسط (میانگین) میان پیوند یگانه و دوگانه می باشد. در واقع در مولکول اوزون، هر دو پیوند اکسیژن – اکسیژن کاملا هم ارز می باشند و از لحاظ خواص، مابین پیوندهای یگانه و دوگانه می باشند. در واقع ساختار های لوئیس هم ارز در مولکول اوزون را با نام ساختار رزونانس می شناسند. در شکل زیر ساختارهای لوئیس مولکول اوزون را مشاهده می نمایید.

رسم ساختار رزونانسی
در هنگام رسم ساختار های رزونانسی، محل اتم ها یکسان است، اما محل الکترون ها متفاوت می باشد. در واقع هر شکل رزونانسی می تواند الکترون های غیر مستقر را در یکی از حالت های ممکن به صورت مستقر نمایش دهد.
از فلش های دو طرفه برای ارتباط دادن ساختار های رزونانس استفاده می شود. این فلش های دو طرفه در واقع نشان می دهند که ساختار الکترونی واقعی و کامل در این گونه مولکول ها، میانگینی از این دو ساختار می باشد. لازم به ذکر است که مولکول اوزون بین این دو حالت نوسان نمی کند. در شکل زیر ساختارهای رزونانس مولکول اوزون را مشاهده می نمایید.
سهم هر ساختار رزونانسی
در تعیین سهم هر شکل رزونانسی از پایداری آن شکل رزونانسی کمک می گیرند. در حقیقت هر چه یک شکل رزونانسی پایدارتر باشد، پس آن شکل مطلوب تر است. در این حالت، سهم آن شکل رزونانسی در تعیین خواص واقعی مولکول بیشتر خواهد بود. در نتیجه ساختار واقعی و کامل مولکول مورد نظر به آن شکل رزونانسی نزدیکتر می باشد.
در صورتی که شکل های رزونانسی مشابه و یکسان باشند سهم آنها نیز برابر و یکسان خواهد بود. در نتیجه میانگین گیری خواص مولکول واقعی را نشان می دهد. مثلا برای مولکول اوزون، که دو شکل رزونانسی مشابه اند، سهم هر شکل رزونانسی برابر پنجاه درصد است. یا اگر مولکول SO۳ را در نظر بگیرید، با توجه به شکل زیر مشخص می شود که سهم هر شکل رزونانسی، برابر با ۳/۳۳ درصد است.
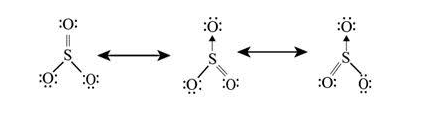
حال اگر شکل های رزونانسی مشابه یکدیگر نباشند، از قواعد زیر برای مقایسه پایداری آنها استفاده می شود.
۱- هر چه تعداد پیوند های یک شکل رزونانسی بیشتر باشد، بنابراین آن شکل رزونانسی پایدارتر است.
۲- اگر تمامی اتم ها از قاعده اکتت پیروی کنند، باعث پایداری آن شکل رزونانسی می شود.
۳- توزیع بارهای قراردادی بر روی اتم ها، باید با الکترونگاتیویته آنها همخوانی داشته باشد.
۴- بارهای قراردادی همنام نباید بر روی اتم های مجاور قرار گیرند.
۵- هر چه تعداد و اندازه بارها کمتر باشد، ساختار رزونانسی مربوطه، مطلوب تر می باشد.
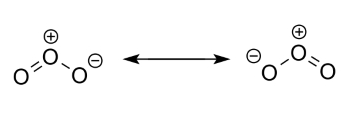
به عنوان مثال، شکل رزونانسی سوم سمت راستی در مولکول –OCN، به دلیل قرارگرفتن بار قراردادی مثبت روی اتم الکترونگاتیو اکسیژن و جدایی زیاد بار ناپایدار می باشد، پس حذف می شود.
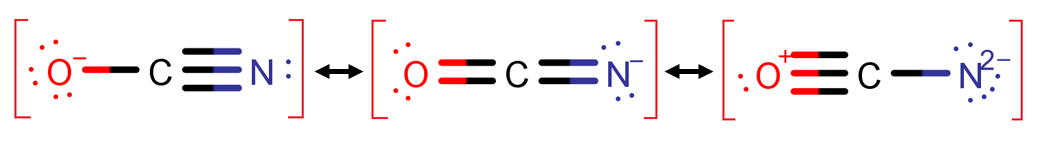
هیبرید رزونانسی
لازم به ذکر است که در نظر گرفتن دو ساختار رسم شده در شکل قبل، به این معنا نیست که نیمی از مولکول های اوزون ساختار سمت راستی و نیمی دیگر ساختار سمت چپی را دارند. یا اینکه مولکول اوزون لحظاتی ساختار سمت راستی و لحظاتی ساختار سمت چپی را نشان می دهد. در حقیقت تمام مولکول های اوزون در تمام لحظات یک شکل اند و آن شکل نه ساختار سمت راستی و نه ساختار سمت چپی است. بلکه ساختار واقعی ساختار میانگین این دو ساختار می باشد. در واقع ساختارهای رزونانسی فرضی می باشند و ساختار واقعی ساختار هیبرید رزونانسی است.
رسم ساختار هیبرید رزونانسی
برای رسم ساختار هیبرید رزونانس، ابتدا ساختار های لوئیس و رزونانس را برای مولکول مورد نظر رسم می کنند. در قدم بعدی از خط چین برای نشان دادن پیوند های دو گانه یا سه گانه استفاده می شود. در نهایت تنها جفت الکترون هایی که در تمامی ساختار های رزونانس مشترک اند را رسم کرده و بقیه جفت الکترونها را نمایش نمی دهند. مثلا ساختار هیبرید رزونانس مولکول اوزون را در شکل زیر مشاهده می نمایید.
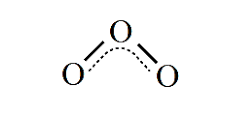
پایداری هیبرید رزونانسی
همانطور که بیان شد، الکترون های آزاد جاذبه تعداد هسته های بیشتری را احساس می کنند، بنابراین از الکترون های مستقر پایدارتر می باشند. وجود الکترون های آزاد یا وجود رزونانس باعث افزایش انرژی پیوند ها و در نتیجه پایداری مولکول مورد نظر می شود. هر مولکولی که به صورت هیبرید رزونانس نمایش داده شود، پایدارتر از سایر ساختار ها می باشد. علاوه بر آن، هر چه تعداد شکل های رزونانسی بیشتر، پایداری شکل های رزونانسی به یکدیگر نزدیک تر باشد، پایداری حاصل از رزونانس نیز بالاتر خواهد بود. از این پایداری به عنوان پایداری رزونانسی نام برده می شود.
لیست مولکول های مختلف با داشتن ساختار رزونانسی
در مولکول ها و یون های مختلف و زیادی می توان هیبرید رزونانس را مشاهده کرد. به عنوان مثال، مولکول هایی مانند بنزن، SO۲، SO۳ ،NO۲ و یا یون های کربنات، فسفات، سولفات، سولفیت، کربوکسیلات و غیره. ساختارهای رزونانسی و هیبرید رزونانس مولکول بنزن را در شکل زیر مشاهده می کنید.