عنصر کربن چیست؟ کاربرد و خواص عنصر کربن را می شناسید؟

عنصر کربن از عناصر شیمیایی موجود در جدول تناوبی بوده که با نماد شیمیایی C شناخته میشود. عدد اتمی عنصر کربن ۶ و عدد جرمی آن ۱۲ است. عنصر کربن در دوره دوم و گروه ۱۴ جدول مندلیف جای گرفته است. عنصر کربن در دسته عناصر غیرفلزی جای گرفته و عنصری ۴ ظرفیتی است. عنصر کربن با داشتن ۴ الکترون در لایه ظرفیت پیوندهای شیمیایی کووالانسی تشکیل میدهد. ایزوتوپ عنصر کربن در طبیعت وجود داشته و این ماده ۲ ایزوتوپ طبیعی و یک ایزوتوپ پرتوزای طبیعی را شامل میشود. انواع عنصر کربن به شکلهای مختلف مانند گرانیت و الماس در طبیعت وجود دارند. البته گرانیت و الماس آلوتروپ عنصر کربن نامیده شدهاند. کاربرد عنصر کربن در جهان به حدی است که بدون آن زندگی وجود نخواهد داشت. خواص عنصر کربن موجب شده تا از آن استفادههای زیادی در صنعت شود.
نشریه علمی جهان شیمی فیزیک به بررسی و معرفی عناصر جدول تناوبی پرداخته است. مانند: هیدروژن، هلیم، لیتیم، بریلیوم و… . در ادامه این مقاله به بررسی خواص و فواید عنصر کربن می پردازیم. با ما همراه باشید.
پیشینه کربن
کربن در اثر انفجار بزرگ آغازین پدید نیامده است. این عنصر برای تولید به یک برخورد سه مرحله ای ذرات آلفا (هسته اتم هلیم) نیاز دارد. جهان در ابتدا گسترش یافت. سپس به سرعت سرد شد و بنابراین امکان تولید این ماده غیر ممکن بود. کربن در جایی که ستارگان هسته هلیوم را با فرایند سه گانه آلفا به کربن تبدیل میکنند، پدید آمد.
کربن از واژه لاتین carbo به معنای زغال چوب در دوران بسیار قدیم کشف گردید. این ماده توسط مردم باستان مصرف می شد (تولید زغال چوب). باستانیان زغال چوب را از سوختن مواد آلی در اکسیژن ضعیف تولید میکردند. الماس از انواع عنصر کربن است که دگرشکل یافته و به عنوان ماده ای زیبا و کمیاب به حساب میآید و کشف آن سابقه ای طولانی دارد. فولرن ها نیز آخرین آلوتروپ عنصر کربن هستند که در دهه ۸۰ به عنوان محصولات جانبی آزمایشات پرتو مولکولی کشف شدند. گرافیت از دگرشکل های دیگر این ماده به شکل پودر و سفت شده به عنوان زغال چوب برای پخت غذا، در آثار هنری و… به کار می رود.

آشنایی با عنصر کربن، عنصر ۶ جدول تناوبی
واژه کربن برگرفته از واژه ای لاتین به نام کربو و به معنای زغال سنگ است. با اندکی تفکر متوجه می شویم که carbon نقش اساسی در دنیای ما ایفا می کند. در واقع آثار استفاده و کاربرد عنصر کربن در زندگی روزمره مشهود است. مانند دی اکسید کربن موجود در هوا و گرافیتی که در مداد وجود دارد و با آن می نویسیم. درواقع همه جا می توان آثار این ماده را مشاهده نمود. از لحاظ فراوانی عنصر کربن چهارمین عنصر در جهان است. این ماده دومین عنصر در بدن انسان از لحاظ فراوانی بشمار می آید. این ماده تعداد زیادی ترکیب را به وجود آورده که از ترکیبات دیگر عناصر بسیار بیشتر است. توانایی این ماده در برقراری پیوند با دیگر عناصر غیر فلزی آن را به عنصر سازنده حیات معروف نموده است.
منابع عنصر کربن
سنگ آهک، دولومیت و کربن دی اکسید از بزرگ ترین منابع عنصر کربن معدنی هستند. مقادیر قابل توجهی از کربن نیز به صورت ذخیره شده در منابع آلی وجود دارد. زغالسنگ، نفت خام و آذریخ (یخ آتشین یا هیدرات متان) از انواع این منابع بشمار می آیند.
ویژگی عنصر کربنی
نشان شیمیایی عنصر کربن، عنصر شماره ۶ جدول تناوبی با نماد C نشان داده می شود. این عنصر دارای عدد اتمی ۶ و عدد جرمی (جرم اتمی) ۱۲ می باشد. جالب است بدانید نقطه ذوب عنصر کربن بسیار بالا و در حدود ۳۵۰۰ درجه سانتی گراد است. این نقطه ذوب درواقع بالاترین نقطه ذوب در بین عناصر است. عنصر کربن به دلیل دارا بودن ۴ الکترون در لایه ظرفیت به عنوان عنصری ۴ ظرفیتی شناخته می شود. این ماده می تواند پیوند کووالانسی با سایر عناصر داشته باشد.
انواع عنصر کربن
به دلایل زیادی این ماده قابل توجه است. اشکال مختلف عنصر کربن وجود داد. نرمترین آن گرافیت و یکی از سختترین ها نیز الماس است. علاوه بر اشکال گفته شده گرافیت و فلورن نیز از انواع عنصر کربن به شمار می آیند. این ماده میل زیادی به پیوند با اتم های کوچک دیگر از جمله اتم های دیگر کربن دارد. اندازه بسیار کوچک آن امکان پیوند های متعدد را به وجود آورده است. این خصوصیات در این ماده بی نظیر، شکل گیری ده میلیون ترکیب کربنی را سبب شده است. درواقع ترکیبات کربن زیر بنای حیات را در زمین می سازند. چرخه کربن نیتروژن نیز قسمتی از انرژی تولید شده توسط خورشید و ستارگان دیگر را تامین میکند.
آلوتروپ عنصر کربن
تاکنون چهار آلوتروپ عنصر کربن شناخته شده است. این آلوتروپ ها به شکل زیر هستند. درواقع کربن به دلیل دارا بودن لایه ظرفیت، قادر است به شکل های گوناگونی از دگرشکل ها درآید.
- آمورف (غیر متبلور)
- گرافیت
- الماس
- فولرن
ویژگی گرافیت یک آلوتروپ عنصر کربن
گرافیت ظاهری کدر و سیاه رنگ دارد. گرافیت به عنوان یکی از نرم ترین مواد شناخته شده است. نرمی این ماده به قدری است که میتواند بر روی کاغذ اثری از خود برجای نهد. درواقع نام گرافیت از واژه یونانی به معنای نوشتن گرفته شده است.
گرافیت هدایت کننده خوب جریان الکتریکی است. گرافیت در شرایط STP دارای واکنشپذیری بالاتری نسبت به الماس است. اگرچه گرافیت دارای پایداری ترمودینامیکی بالاتری نسبت به الماس است. این واکنش پذیری بالاتر گرافیت به دلیل پیوند های پای نامستقر آن است که این ماده را راحت تر وارد واکنش شیمیایی می کند.
ذخایر طبیعی گرافیت با مصرف تجاری در بخشهای مختلفی از دنیا وجود دارند. مهم ترین منابع تجاری گرافیت در مناطقی مانند چین، هند، برزیل و کره شمالی قرار دارد.
ویژگی الماس، یک آلوتروپ carbon
الماس ترکیبی شفاف است و سخت ترین ترکیب طبیعی یافته شده بر روی کره زمین است. الماس از استحکام و بسیار بالایی برخوردار است. الماس یک رسانای ضعیف جریان الکتریسیته است. این ماده در بین جامدات در دمای ۲۵ درجه سانتی گراد بالاترین رسانایی گرمایی را داراست. اغلب ذخایری که دارای قابلیت برداشت الماس به صورت تجاری هستند در روسیه، استرالیا و جمهوری دموکراتیک کنگو قرار گرفته اند.
خواص آلوتروپ فولرن
فولرن ها بلور هایی سنتزی با ساختار مشابه گرافیت هستند. تفاوت آن ها در این است که تمام واحد های تشکیل دهنده فولرن از ششگوشه های مسطح ساخته نشدهاند. درواقع تعدادی واحد شش گوشه نامسطح، پنج گوشه و حتی هفت گوشه نیز در ساختار آن ها وجود دارد.
خواص خانواده ترکیبات فولرنی هنوز بهصورت کامل ارزیابی نشده است. فولرن ها زمینه وسیعی در تحقیقات نانو مواد را به خود اختصاص دادهاند. نام باکیبال، برگرفته از نام باکمینستر فولر و مخترع گنبد ژئودزیک است. گنبدی که دارای ساختاری مشابه با فولرن هاست. باکیبال ها ساختارهای مولکولی بزرگی از کربن دارا هستند. این اتم های کربن به صورت مثلثی با یکدیگر پیوند دادهاند. پیوند های کربنی موجب شکلگیری یک ساختار کرهگون شدهاند. شناخته شده ترین و سادهترین نوع فولرن، فولرن باکمینستر با ۶۰ اتم کربن است. C60 ساختاری شبیه به توپ فوتبال دارد.

ایزوتوپ عنصر کربن
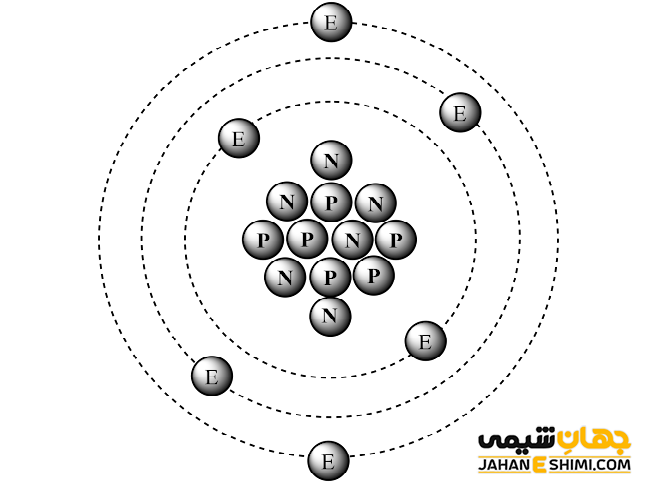
همگی اتم های کربن دارای شش پروتون هستند. تفاوت آن ها تنها در داشتن تعداد متفاوت نوترونهاست. تعداد نوترون ها در این ماده میتواند از ۲ تا ۱۶ متغیر باشد. عنصر کربن دارای ۱۵ ایزوتوپ شناخته شده از ۸C تا ۲۲C است. از این میان این ایزوتوپ ها، دو ایزوتوپ C-12 و C-13 به طور طبیعی در طبیعت وجود دارند. C-14 نیز ایزوتوپ پرتوزای طبیعی این عنصر است که دارای نیمه عمری برابر با ۵٬۷۳۰ سال است. ایزوتوپ C-12 حدود ۹۸٫۹۳ درصد از کربن موجود در زمین را تشکیل میدهد. ایزوتوپ C-13 نیز سهمی برابر با ۱٫۰۷ درصد دارد.
میزان C-12 در ترکیبات زیستی بسیار زیاد است. به طوری که که در واکنشهای زیست شیمیایی نیز تمایل زیادی برای کربن-۱۲ نسبت به کربن-۱۳ وجود دارد. اتحادیه بینالمللی شیمی در سال ۱۹۶۱ ایزوتوپ کربن-۱۲ را به عنوان مبنای تعیین جرم اتمی نسبی عناصر انتخاب کردند. از کربن-۱۳ نیز در طیفسنجی رزونانس مغناطیسی هستهای برای شناسایی ساختمان شیمیایی ترکیبات کربنی استفاده می گردد.
کربن-۱۴ دیگر ایزوتوپ carbon است که به طور طبیعی ایزوتوپی پرتوزا است. این ایزوتوپ توسط واکنش پرتو های کیهانی با نیتروژن در لایه بالایی جو و در بخش های پایینی استراتوسفر و بالایی تروپوسفر ایجاد میگردد.
کاربرد عنصر کربن
بخش بسیار مهمی در تمامی موجودات زنده را کربن تشکیل می دهد. درواقع بدون این عنصر زندگی نیز وجود نخواهد داشت. عمده ترین کاربرد اقتصادی عنصر کربن، فرم هیدروکربنی است. ۳ مورد از مهم ترین فرم های هیدروکربنی این ماده در ادامه آمده است.
- سوخت های فسیلی
- گاز متان
- نفت خام
برای تولید محصولات زیادی از نفت خام در صنعت پتروشیمی استفاده می شود. از جمله مهمترین آن ها بنزین، گازوئیل و نفت سفید است. این ترکیبات از طریق فرآیند تقطیر در پالایشگاه ها بدست میآیند. از نفت خام جهت تولید مواد اولیه بسیاری از مواد مصنوعی استفاده می شود. درواقع بسیاری از این مواد در مجموع پلاستیک نامیده میشوند.
مقاصد دیگر مصرف عنصر کربن
- ایزوتوپ C-14 که در سال ۱۹۳۰ کشف گردید در سن یابی کربن پرتوزا مورد استفاده قرار می گیرد.
- از گرافیت در ترکیب با خاک رس به عنوان مغز مداد استفاده می شود.
- از الماس جهت تزئین و جواهرسازی استفاده می شود.
- الماس در مته ها و سایر کاربرد هایی که سختی الماس مورد نظر است نیز کاربرد دارد.
- در صنایع فولاد سازی برای تولید فولاد نیز به آهن، کربن اضافه می شود.
- کاربرد عنصر کربن سیاه به عنوان رنگ دانه سیاه در چاپ جوهر، رنگ روغن و رنگهای آبی، کاغذ کاربون، اتمام رنگ خودرو، مرکب هندی و گرد جوهر چاپگر لیزری.
- کاربرد و مصرف عنصر کربن به عنوان افزودنی های پلیمری در محصولاتی مانند لاستیک و در ترکیبات پلاستیکی
- استفاده از کربن اکتیو به عنوان یک جاذب و جذب کننده سطحی در مواد فیلتر دار: کربن اکتیو در ساخت ماسکهای گازی، خالصسازی آب و هود آشپزخانه و در پزشکی برای جذب زهرابه، سموم یا گازهای دستگاه گوارش مورد استفاده قرار می گیرد.
- استفاده از کاربید تنگستن در متههای حفاری
مدل اتمی عنصر کربن
در حالت پایه یک اتم C دارای اوربیتال های اتمی با آرایش الکترونی ۱s۲ ۲s۲ ۲p۲ است. اتم کربن با تغییر سطح انرژی اوربیتال های اتمی خود می تواند طی هیبریداسیون اوربیتالهای لایه ظرفیت خود را هم تراز کند. هیبریداسیون منجر به چینش مجدد الکترون های این اوربیتال ها می شود. اوربیتالهای هیبریدی نیمه پر ایجاد شده امکان برقراری پیوند با اتم های دیگر را دارند. بنابراین برای اتم کربن با توجه به وجود چهار اوربیتال نیمه پر، امکان تشکیل حداکثر چهار پیوند کووالانسی وجود خواهد داشت.
اتم کربن، بسته به میزان مشارکت اوربیتال های پی در فرایند هیبریداسیون، میتوانند سه نوع هیبریداسیون شود. مشارکت سه اوربیتال پی در هیبریداسیون موجب ایجاد هیبریداسیون sp۳، مشارکت دو اوربیتال پی موجب هیبریداسیون sp۲ می شود. اگر یکی از اوربیتال های پی در فرایند هیبریداسیون شرکت کنند، هیبریداسیون اتم مورد نظر از نوع sp می شود.
نوع پیوند هایی که اتم carbon می تواند داشته باشد نیز متفاوت است. این پیوند ها به پیوند یگانه (C-C)، دوگانه (C=C) و سهگانه (C≡C) تقسیم میشوند. این که اتم در کدام نوع پیوند شرکت کند به هیبریداسیون آن وابسته است. اگر هیبریداسیون sp۳ باشد، نوع پیوند یگانه است. اگر هیبریداسیون sp۲ باشد، نوع پیوند دوگانه است. در مورد هیبریداسیون sp نیز نوع پیوند سهگانه خواهد بود.
هشدار مصرف عنصر کربن
باید توجه شود که ترکیبات کربنی گستره وسیعی از آثار سمی را نیز دارند. به مثال های زیر توجه کنید.
مونوکسید کربن (CO) موجود در اگزوز موتورهای درونسوز می تواند منجر به آلودگی هوا شود. علاوه بر آن منوکسید کربن (CO) برای انسان و حیوان بسیار سمی است. در صورت عدم اکسیژن کافی برای شکل گیری دی اکسید کربن، منوکسید شکل می گیرد. در بسیاری از کشور های جهان مسمومیت با منوکسید کربن یکی از متداول ترین و کشنده ترین مسمومیت هاست.
سیانید (CN) که گاهی در آلودگی های معدنی وجود دارد برای پستانداران بسیار سمی است.
گازهای آلی مثل اتیلن (H۲C=CH۲) و اتان و متان (CH4) در صورت مخلوط شدن با هوا قابلیت انفجار و اشتعال خطرناکی پیدا میکنند.
البته بسیاری از ترکیبات دیگر کربن نیز هستند که سمی نیستند. در واقع این ترکیبات برای زیست ممکن است ضروری هم باشند.
کربن فلز است یا نافلز علوم هفتم
کربن یک غیر فلز است. یک عنصر غیر فلزی در شیمی اینگونه توصیف می شود که فاقد خواص و ویژگی های یک فلز است. کربن یک عنصر جامد است که در طبیعت به شکل غیر فلز یافت می شود. معمولاً این عناصر الکترون می گیرند و یون های منفی تشکیل می دهند. برخی از خواص فیزیکی غیر فلزات این است که نقطه ذوب و جوش پایینی دارند. آنها به عنوان یک جامد شکننده هستند و هدایت حرارتی و الکتریکی ضعیفی دارند. برخی از خواص شیمیایی غیر فلزات عبارتند از میل ترکیبی الکترون بالا و انرژی یونیزاسیون بالا. کربن نسبت به غیر فلزات الکترونگاتیو کمتری دارد و با فلزات ترکیبات کووالانسی ایجاد می کند. رایج ترین حالت اکسیداسیون کربن +۴ است
کربن یک عنصر بسیار ویژه است با توجه به اینکه می تواند آلوتروپ تشکیل دهد. آلوتروپ ها ترکیباتی هستند که در اثر پیوند کربن به روش های مختلف به وجود آمده اند. شناخته شده ترین آلوتروپ های کربن فولرن، گرافیت و الماس هستند. یکی دیگر از جنبه های مهم کربن این است که آنها در ترکیبات آلی نقش دارند. ترکیبات آلی آن دسته از ترکیبات در شیمی هستند که حاوی پیوندهای کربن و هیدروژن هستند.
بر روی زمین، الماس سخت ترین ماده ای است که به طور طبیعی وجود دارد. گرافیت که آلوتروپ کربن است نیز یک عنصر غیر فلزی است. این یک ماده فلزی است که جریان الکتریکی را هدایت می کند. عناصر غیر فلزی رسانای ضعیف الکتریسیته هستند. عناصر غیر فلزی در طبیعت نرم و شکننده هستند. اینها در طبیعت شکل پذیر هستند. با در اختیار داشتن الکترون ها، غیر فلزات وارد پیوند کووالانسی با فلزات می شوند. این خواص باعث می شود که آنها از فلزات متفاوت باشند.
کربن در کجا یافت می شود؟
کربن یکی از عناصر مهم و فراوانی است که در اشکال و مکان های مختلف یافت می شود. این عنصر در طبیعت به صورت ترکیبات آلی و معدنی وجود دارد. ترکیبات آلی مهمترین منابع کربن هستند که در موجودات زنده و بقایای آنها یافت می شوند. بدن جانوران و ساختار گیاهان از کربن برای ساختن مولکول های زیستی مانند پروتئینها، چربیها و کربوهیدراتها استفاده می کنند. وقتی موجودات زنده می میرند، ترکیبات آلی بدن آنها به سوخت های فسیلی مانند زغال سنگ، نفت و گاز طبیعی تبدیل می شوند که منابع مهم کربن در جهان هستند.
کربن همچنین به صورت غیرآلی در سنگ ها و کانی ها یافت می شود. کربنات ها مانند کلسیت و دولومیت مهمترین ترکیبات معدنی کربن هستند که در پوسته زمین به شکل سنگهای رسوبی وجود دارند. همچنین کربن اشکال مختلفی مانند الماس و گرافیت نیز یافت می شود. الماس شکل بلوری و سخت کربن است که در شرایط فشار و دمای بالا در اعماق زمین شکل میگیرد. گرافیت نیز یک شکل دیگر کربن است که نرم و رسانای برق بوده و کاربرد گسترده ای در صنایع مختلف دارد.
کربن همچنین در اتمسفر به صورت دی اکسید کربن وجود دارد که نقش مهمی در حفظ دمای زمین و فرآیند فتوسنتز گیاهان دارد. بطور کلی، کربن یک عنصر اساسی در زمین است که در چرخه زندگی و سیستم های زیست محیطی ایفا نقش می کند و در بخش های مختلف زمین به شکلهای گوناگون یافت می شود.