
در مباحث پیشین نشریه، مطالبی در خصوص تیتراسیون ارائه شده است. در این مقاله به طور ویژه به بررسی تیتراسیون اسید – باز (Acid – base titration) پرداخته می شود و این گروه از تیتراسیون با جزئیات بیشتری بیان می گردد.

در واقع، این نوع از تیتراسیون شامل اندازه گیری غلظت یک اسید مجهول به وسیله یک محلول باز استاندارد (اسیدی متری) و یا اندازه گیری غلظت یک باز موجود در یک محلول به وسیله یک محلول اسید استاندارد (قلیا سنجی) می باشد. در این مقاله در نشریه جهان شیمی فیزیک به معرفی تیتراسیون اسید و باز، انواع و کاربرد های آن در علوم شیمی و آزمایشگاهی پرداخته می شود. لطفا با ما همراه باشید.
همانطور که می دانید، تیتراسیون یک تکنیک و روش برای تعیین غلظت یک محلول مجهول می باشد. در فرآیند تیتراسیون اسید – باز، غلظت یک اسید یا باز مجهول از طریق خنثی سازی آنها به وسیله یک اسید یا باز دیگر (با غلظت معلوم) مشخص می شود. در واقع، در این فرآیند از واکنش خنثی شدن بین اسید و باز و همچنین دانستن آنکه چگونه این دو ماده با ترکیب معلوم با یکدیگر واکنش می دهند استفاده می کنند. لازم به ذکر است که خنثی شدن به معنای از بین رفتن اثر اسیدها به وسیله بازها و برعکس می باشد.
فرایند تیتراسیون تا زمانی ادامه پیدا می کند که واکنش در نقطه هم ارزی به خنثی شدن اسید و باز برسد. به شرط آنکه مولاریته محلول اسید یا باز معلوم باشد، در نقطه هم ارزی و خنثی شدن، می توان مولاریته و غلظت محلول باز یا اسید مجهول را محاسبه کرد. در این حالت با تغییر رنگ واکنش، پایان واکنش اعلام می گردد. همچنین برای نمایش و محاسبه تغییرات pH ، یک شناساگر به ظرف حاوی تیترانت اضافه می شود. در حقیقت بدست آوردن نقطه پایانی به کمک شناساگر و با تغییر رنگ آن، قابل شناسایی خواهد بود.
لازم به ذکر است که به فرآیند تیتراسیون، تیتر کردن، تیترامتری و یا آنالیز حجمی نیز گفته می شود. از طرفی دیگر، به تیتراسیون اسید باز، تیتراسیون خنثی شدن، اسید سنجی و یا قلیا سنجی نیز می گویند.
بررسی اسید و باز
اسید قوی ترکیبی است که در محلول به صورت کامل به یون هیدرونیوم (+H۳O) تجزیه می شود، اما اسید ضعیف نمی تواند به طور کامل به یون هیدرونیوم تجزیه شود. از طرفی، باز قوی ترکیبی است که در محلول به صورت یون هیدروکسیل تجزیه می شود، اما باز ضعیف نمی تواند به صورت کامل به شکل –OH تبدیل شود. در جدول زیر مثالی از انواع اسید و باز را می توانید مشاهده نمایید.
| اسید قوی | اسید ضعیف | باز قوی | باز ضعیف |
| هیدروکلریدریک اسید (HCl) | اسید استیک (CH₃COOH) | سدیم هیدروکساید (NaOH) | آمونیوم هیدروکساید (NH۴OH) |
| سولفوریک اسید (H۲SO۴) | اسید اگزالیک ۲ (COOH) | پتاسیم هیدروکساید (KOH) | آمونیاک (NH۳) |
| نیتریک اسید (HNO۳) | اسید فسفریک (H۳PO۴) | لیتیم هیدروکساید (LiOH) |
لازم به ذکر است که اسید ضعیف دارای باز مزدوج قوی و باز ضعیف دارای اسید مزدوج قوی می باشد. بنابراین اسید ضعیف و باز ضعیف همیشه در محلول به صورت مزدوج ظاهر می گردند. به عنوان مثال، HA اسید و –A باز مزدج آن، در حالیکه –A باز و HA اسید مزدوج آن به حساب می آید.
HA + H۲O ↔ H۳O++ A–
A– + H۲O ↔ OH– + HA
اصطلاحات تیتراسیون
۱- محلول نمونه یا آنالیت مورد آزمايش (محلول تيتر شونده) که غلظت آن نا معلوم است.
۲- محلول تیترانت یا استاندارد (محلول تيتر كننده) که دارای غلظت مشخص و معین می باشد.
۳- معرف هاي شيميايي رنگين یا شناساگر ها
۴- نقطه هم ارزی، در این نقطه میزان اکی والان های آنالیت و تیترانت برابر می شوند.
۵- نقطه پایانی، نقطه ای که در آن تغییر رنگ محلول توسط شناساگر مشاهده می شود.
توجه داشته باشید که نقطه پایانی با نقطه هم ارزی تفاوت دارد. نقطه هم ارزی یک نقطه نظری است که از استوکیومتری واکنش تعیین می شود. اما نقطه پایانی، با تغییر رنگ شناساگر مشخص می گردد. برای تشخیص نقطه پایانی، می توان از روش چشمی يا فتومتری و بر پایه تغییر رنگ شناساگر استفاده کرد. در روش دوم با استفاده از ابزار و دستگاه برای تشخیص تغییر pH محلول استفاده می کنند.
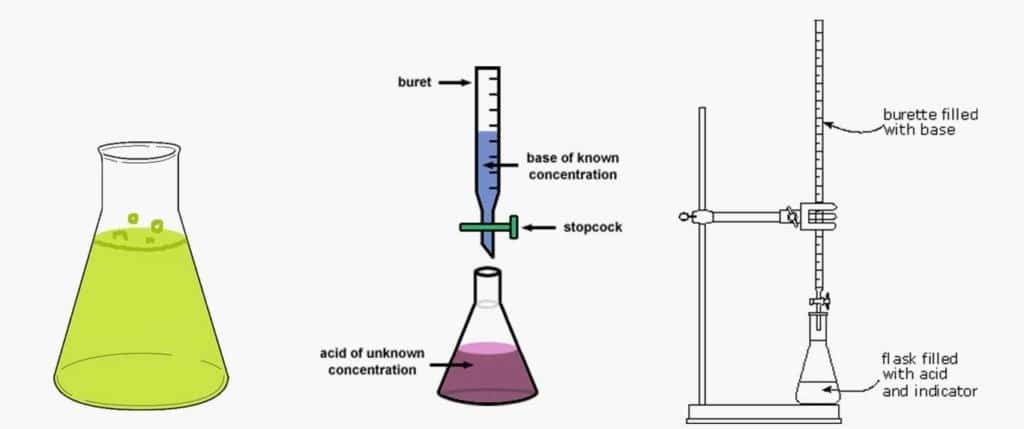
ابزارهای لازم برای انجام تیتراسیون
– بورت و پایه نگه دارنده بورت
– پیپت
– ارلن مایر یا یک ظرف مخروطی دیگر
– مزور یا استوانه مدرج
– قیف
– بالن
– پوآر
– بشر
– صفحه زمینه سفید یا کاشی سفید، که در آن تغییر رنگ محلول به آسانی نمایان باشد.
روش تیتر کردن اسید – باز
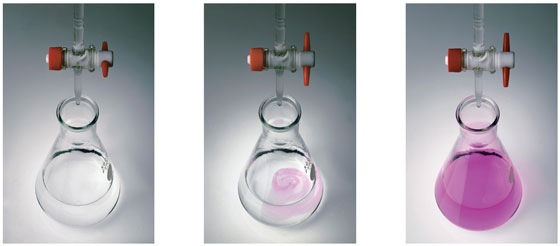
روش کار به این صورت است كه حجم مشخصی از محلول حاوی نمونه (با غلظت مجهول) که با پیپت اندازه گرفته شده است، در یک ارلن می ریزند. از طرفی دیگر، محلول استاندارد را در یک بورت ریخته و حجم اولیه آن را یادداشت می کنند. در این قسمت از یک شناساگر مانند متیل اورانژ یا فنول فتالئین استفاده می شود. توجه داشته باشید که هرچه میزان شناساگر کمتری ریخته شود، دقت کار بیشتر خواهد بود.
ارلن را زیر بورت قرار می دهند و شیر بورت را به آهستگی باز می کنند. از طریق بورت، محلول استاندارد به صورت قطره قطره به محلول آنالیت در ارلن اضافه می شود. به طور همزمان ارلن را تکان می دهند تا تیترانت و نمونه به خوبی با هم مخلوط شوند. تا زمانیکه واکنش به نقطه هم ارزی برسد و در نتیجه واکنش کامل شود.
با مشاهده اولین تغییر رنگ، شیر بورت را بسته و حجم پایانی تیترانت را یادداشت می کنند. در واقع از اختلاف حجم نهایی و حجم ابتدایی تیترانت، میزان حجم مصرفی بدست آمده و از آن در محاسبات استفاده می کنند. لازم به ذکر است که برای بالا بردن دقت در آزمایش، بهتر است که فرآیند تیتراسیون سه مرتبه انجام شود، بنابراین میانگین حجم های بدست آمده به عنوان حجم تیتراسیون انتخاب می شود.
با توجه به حجم لازم تيترانت براي رسيدن به نقطه هم ارزي (Vt)، حجم معلوم آناليت (Va)، غلظت معلوم تيترانت (Ct) و ضرايب آناليت و تيترانت در واكنش كمي بين آنها و با استفاده از رابطه زیر می توان غلظت آنالیت (Ca) را محاسبه کرد.
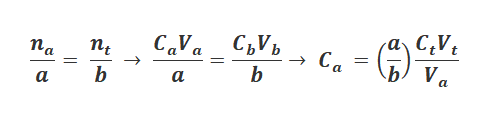
نکته: در فرآیند تیتر کردن، اسید و باز نمونه، می توانند به صورت آزاد وجود داشته باشد یا در نتیجه هیدرولیز یون های آن نمونه به وجود آمده باشند. واکنش کلی به صورت زیر است :
H+ + OH– → H۲O
زیرا هر مول +H با یک مول –OH خنثی می شود. در واقع می توان گفت که، یک اکی والان از اسید در محلول آبی یک مول پروتون (+H) تولید می کند، در حالیکه یک اکی والان از باز در محلول آبی یک مول هیدروکسید (–OH) تولید می کند.
توجه داشته باشید که در فرآیند تیتراسیون همواره تعداد اكی والان های مصرف شده تیترانت با تعداد اكی والان های واكنش داده از محلول آنالیت برابر است، بنابراین مي توان با توجه به حجم مصرفی تیترانت و با استفاده از رابطه زیر نرماليته مجهول را بدست آورد.
Na × Va = Nt × Vt
در رابطه فوق Nt نرماليته تیترانت، Vt حجم مصرفي تیترانت، Va حجم محلول آنالیت و Na نرماليته مجهول محلول مورد آزمايش می باشند.
شرایط لازم برای تیتر کردن
۱- واکنش تیتراسیون سریع باشد.
۲- واکنش تیتراسیون کمی باشد و استوکیومتری واکنش های مربوط به آنالیت و تیترانت شناخته شده باشد.
۳- روش دقیقی برای تعیین نقطه پایانی با سطح دقت قابل قبول وجود داشته باشد.
منحنی تیتراسیون اسید – باز
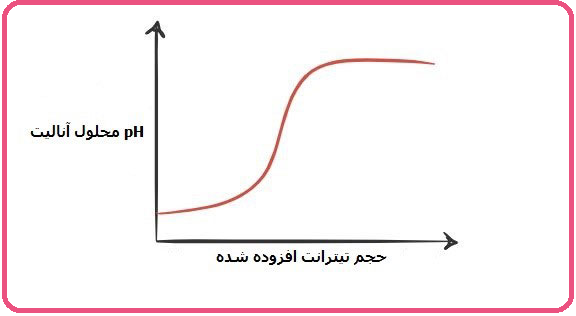
در فرآیند تیتراسیون اسید – باز، با اضافه شدن تیترانت که در واقع دارای خاصیت اسیدی – بازی مخالف آنالیت می باشد، pH محلول تغییر می کند. بنابراین می توان یک منحنی بر اساس تغییرات pH محلول و میزان تیترانت اضافه شده رسم کرد. در منحنی تیتراسیون رسم شده، تغییرات pH بر روی محور عمودی و میزان تیترانت مصرف شده بر روی محور افقی قرار می گیرند. این منحنی بسته به نوع و قدرت آنالیت و تیترانت به شکل های مختلفی می باشد. اما تمامی آنها دارای منطقه جهش، شروع و خاتمه می باشند.
این منحنی از pH اولیه که وابسته به تیترانت است شروع می شود. بعد از یک جهش که در حوالی نقطه اکی والان می باشد، در نهایت در pH ای که وابسته به نوع تیترانت می باشد و با میل به یک مقدار که آن نیز به غلظت تیترانت بستگی دارد، پایان پیدا می کند. توجه داشته باشید که هر چه اسید و باز قوی تر باشند، جهش در نقطه اکی والان زیادتر خواهد بود. برای رسم این نمودار لازم است که pH محلول را در هر حجم اضافه شده از تیترانت داشته باشند، بنابراین باید از دستگاه pH متر استفاده کنند.
انواع روش های تیتراسیون
تیتراسیون های خنثی شدن را به دو نوع كلي تقسيم بندي می کنند : تیتراسیون مستقیم و تیتراسیون معکوس ( برگشتی). توجه داشته باشید که تیتراسیون مستقيم به دليل صرفه جويي در ميزان مواد مصرفي و همچنین راحتي كار با آن عمومي تر می باشد.
انواع تیتراسیون اسید – باز
انواع متفاوتی از تیتر کردن بر اساس غلظت و قوی یا ضعیف بودن واکنشگر ها وجود دارد. انواع آن عبارتند از :
۱- اسید قوی – باز قوی
مانند تیتراسیون اسید کلریدریک با سود و یا برعکس آن. فرض کنید اسید کلریدریک به عنوان آنالیت و هیدروکسید سدیم به عنوان تیترانت باشد. نمودار تیتراسیون به صورت زیر نشان داده می شود.
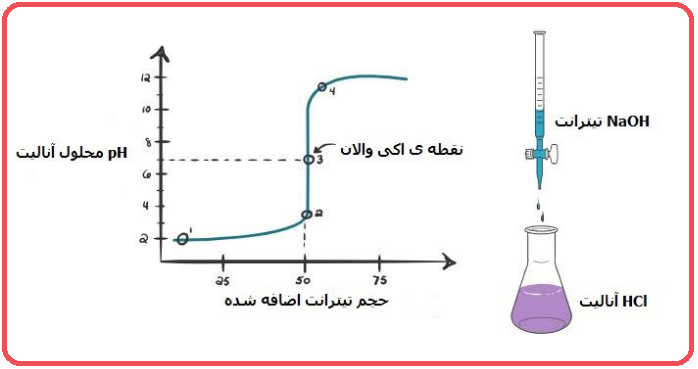
در ابتدا و در نقطه شماره ۱، به دلیل آنکه هنوز سود به محلول اضافه نشده است، pH آنالیت پایین می باشد. سود موجود در بورت قطره قطره به آنالیت افزوده می شود، بنابراین شاهد تغییر در pH و بالا رفتن آن خواهید بود. کم کم یون هیدروکسیل با یون هیدرونیوم وارد واکنش می شود. pH در نقطه ۲، زمانی ثبت شده است که خنثی سازی به طور کامل انجام نگرفته است.
نقطه ۳ در شکل فوق را نقطه هم ارزی می نامند، در این نقطه یون هیدرونیوم به وسیله یون هیدروکسید خنثی می شوند. pH در این نقطه که تنها شامل نمک و آب است خنثی و برابر با ۷ می باشد. با ادامه پیدا کردن افزایش سود به محلول در نقطه ۴، pH افزایش پیدا کرده و محلول بازی می شود. در اینجا اسید هیدروکلریک به طور کامل خنثی شده است. بنابراین شاهد افزایش یون هیدروکسید به دلیل تفکیک NaOH در محلول می باشید.
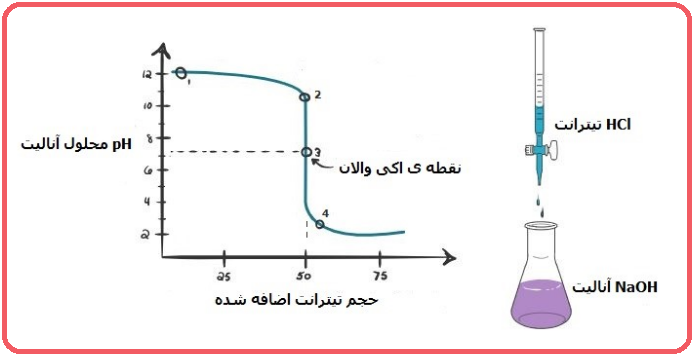
حالا فرض کنید آنالیت سدیم هیدروکسید و تیترانت مورد استفاده HCl باشد. در این صورت نمودار عکس حالت قبل است. زیرا آنالیت مورد استفاده سود می باشد، پس در ابتدا شاهد بالا بودن pH خواهید بود که و با اضافه کردن اسید، pH کاهش می یابد. نمودار تیتراسیون باز قوی به وسیله اسید قوی را در شکل زیر مشاهده می کنید.
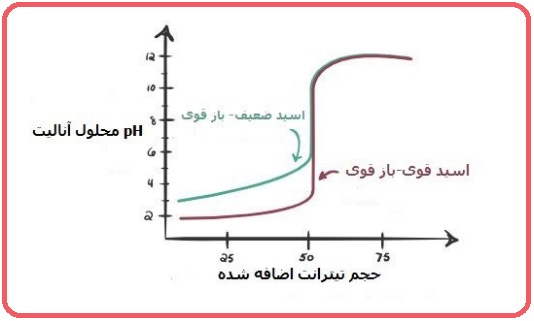
۲- اسید ضعیف – باز قوی
مانند تیتراسیون اسید استیک با سود. در شکل زیر مقایسه نمودار این تیتراسیون را با حالتی که اسید قوی و باز قوی داشته باشید را مشاهده می کنید.
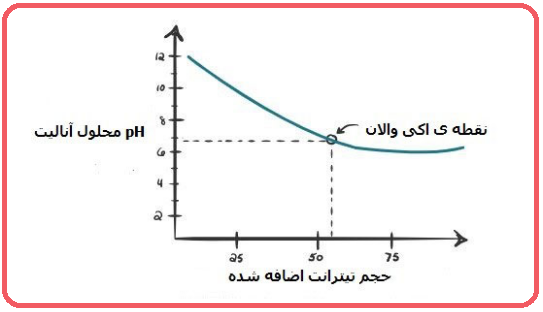
۳- باز ضعیف – اسید قوی
مانند تیتراسیون آمونیاک با اسید کلریدریک. مقایسه نمودار این تیتراسیون را با حالتی که اسید قوی و باز قوی باشند را مشاهده می کنید.
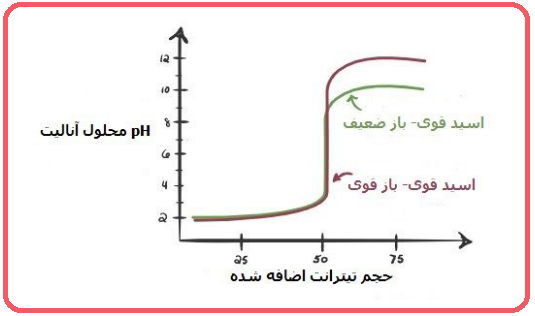
۴- اسید ضعیف – باز ضعیف
مانند تیتراسیون آمونیاک با اسید استیک. منحنی تیتراسیون اسید ضعیف با باز ضعیف در شکل زیر نشان داده شده است.
خطای تیتراسیون اسید – باز
استاندارد نبودن تیترانت مورد استفاده برای تیتر کردن، کالیبره نبودن وسایل آزمایشگاهی مورد استفاده و نداشتن دقت کافی در تعيين نقاط اکی والان و پایانی، منجر به ایجاد خطای محاسباتی و در نتیجه خطا در اندازه گیری غلظت آنالیت می شوند.
انتخاب مناسب شناساگر، بسیار مهم می باشد و می توان با انتخاب درست خطای تیتراسیون را کاهش داد. بنابراین در تیتراسیون های اسید – باز، باید PKa شناساگر انتخابی به pH محلول مورد نظر نزدیک باشد. در غیر اینصورت، اگر تغییر رنگ شناساگر بعد از نقطه اکی والان رخ دهد، حجم نقطه پایان بیشتر از نقطه هم ارزی خواهد بود و اگر تغییر رنگ شناساگر قبل از نقطه اکی والان باشد، حجم نقطه پایان کمتر از نقطه هم ارزی خواهد بود.

کاربردهای تیتراسیون اسید – باز
این تیتراسیون در اندازه گیری گونه های معدنی، آلی و یا زیستی که خاصیت اسیدی یا بازی ذاتی دارند کاربرد دارد، همانند اندازه گیری نیتروژن، نمک های آمونیوم، آمونیاک، نیتریت، نیترات و گروه های عاملی آلی. یکی دیگر از کاربرد های تیتراسیون اسید و باز، در تهیه سوخت های زیستی است.
شرح آزمایش تیتراسیون اسید و باز
تیتراسیون اسید-باز تکنیکی است که برای آزمایش و کسب اطلاعات در مورد محلولی حاوی اسید یا باز استفاده می شود. همانطور که می دانید، صدها ترکیب، آلی و همچنین معدنی وجود دارد. با کمک تیتراسیون می توان خواص اسیدی یا بازی آنها را تعیین کرد. اسید با یک باز تیتر می شود و یک باز با یک اسید تیتر می شود. استفاده از یک نشانگر نقطه پایانی در تیتراسیون را تعیین می کند.
تیتراسیون اسید-باز برای محاسبه مقدار یک ماده اسیدی یا بازی شناخته شده از طریق واکنش های اسید-باز استفاده می شود. کلمه تیتراسیون از کلمه لاتین titulus گرفته شده است که به معنای کتیبه یا عنوان است. در زبان فرانسوی کلمه عنوان به معنای رتبه است. از این رو، تیتراسیون به معنای تعیین غلظت یا رتبه یک محلول نسبت به آب با pH 7 است. یک محلول استاندارد از دستگاهی به نام بورت اضافه می شود. فرآیند افزودن محلول استاندارد تا زمانی که واکنش کامل شود، تیتراسیون نامیده می شود. ماده ای که باید تعیین شود تیتر شده است.
یک واکنش تنها در صورتی می تواند مرجعی به عنوان تیتراسیون دریافت کند که شرایط خاصی را برآورده کند. در اینجا چند شرط وجود دارد که به تعیین تیتراسیون بودن یک واکنش کمک می کند: واکنش باید سریع باشد. تغییر انرژی آزاد در طول واکنش باید به اندازه کافی بزرگ باشد که واکنش خود به خودی باشد. همیشه باید راهی برای تصمیم گیری وجود داشته باشد. تکمیل واکنش، نقطه پایانی و نقطه معادل در تیتراسیون نقطه پایانی واکنش مرحله ای است که تکمیل واکنش را نشان می دهد.
نقطه پایانی با یک تغییر فیزیکی که توسط خود محلول یا با افزودن یک معرف به نام شاخص ایجاد می شود، شناسایی می شود. نقطه معادل مرحله ای است که مقدار معرف اضافه شده دقیقاً معادل مقدار ماده واکنش دهنده در محلول تیتر شده است.



















