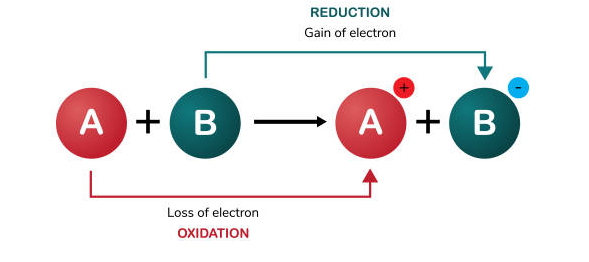
هرگونه تغییر شیمیایی را که در نتیجه انتقال الکترون انجام شده باشد را واکنش اکسایش – کاهش (reduction–oxidation) یا ردوکس (Redox) می نامند. به بیان دیگر به واکنشی گفته می شود که در طی انجام آن یک یا چند اتم، الکترون از دست داده، در حالیکه یک یا چند اتم دیگر الکترون می گیرند. در مطالب پیشین نشریه جهان شیمی فیزیک، در خصوص مفهوم عدد اکسایش و نحوه تعیین آن و همچنین واکنش های اکسایش – کاهش مطالبی را مطرح کرده ایم. در این مقاله آموزشی قصد داریم تا با روش های موازنه واکنش های اکسایش و کاهش آشنا شویم. لطفا با ما همراه باشید.
فهرست مطالب این مقاله
۱- موازنه واکنش های شیمیایی
۲- موازنه واکنش های اکسایش و کاهش
۱-۲- روش عدد اکسایش
۲-۲- روش یون ـ الکترون
۴- مراحل کامل موازنه واکنش های اکسایش و کاهش
موازنه واکنش های شیمیایی
برای تحلیل یک واکنش شیمیایی لازم است که در ابتدا موازنه واکنش را انجام دهید. در واقع به واکنشی که تعداد اتم های مربوط به هر عنصر در دو طرف واکنش برابر باشد، واکنش موازنه شده گفته می شود. به طور مشابه زمانیکه تعداد هر نوع اتم در دو طرف معادله با هم یکسان نباشد، معادله موازنه نشده می باشد. روش های متفاوت و گوناگونی برای موازنه واکنش های شیمیایی تعریف شده است. هر کدام از این روش ها می توانند در بعضی موارد بهتر از سایر روش ها باشند. بنابراین با تمرین و تکرار می توان مهارت موازنه کردن را بهبود بخشید.
لازم به ذکر است که، موازنه یک واکنش در حقیقت قانون پایستگی جرم را اثبات می کند. زیرا در یک واکنش شیمیایی اتم ها و یا تعداد آنها را نمی توان از بین برد. بلکه فقط می توان با مولکول های واکنش دهنده کار کرد و یا در نهایت در آنها تغییری ایجاد نمود.
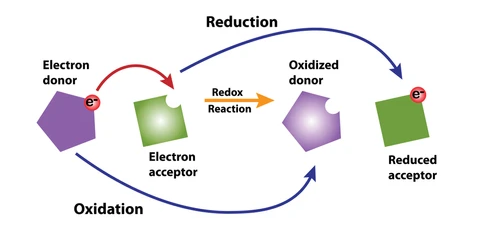
در یک واکنش شیمیایی از نوع اکسایش و کاهش، علاوه بر قانون بقای جرم قانون بقای بار الکتريکی نیز باید رعايت شود. از این جهت، در ابتدا باید مشخص شود که کدام عنصر اکسید و کدام یک کاهیده شده است. بر طبق تعریف، اتم یا مولکولی که الکترون جذب می کند، کاهش می یابد و اتم یا مولکولی که الکترون از دست می دهد اکسایش یافته است.
توجه داشته باشید که یک ماده نمی تواند احیا شود مگر آن که همزمان ماده ای دیگر، اکسید شود. بنابراین، ماده ای كه اكسيد مي شود كاهنده می باشد و به سایر مولکول ها الکترون می دهد. به طور مشابه مولکول اکسید کننده از سایر مولکول ها الکترون می گیرد، در این حالت آنها را اکسید کرده و خود احیا می شود.
موازنه واکنش های اکسایش و کاهش
به طور معمول موازنه واکنش های اکسایش و کاهش که کاکس نامیده می شود، سختر از موازنه سایر واکنش ها می باشد. برای موازنه این دسته از واکنش ها از دو روش متداول زیر استفاده می شود.
۱- روش عدد اکسایش
۲- روش یون ـ الکترون
روش عدد اکسایش
همان طور که می دانید، در جريان يک واکنش شیمیایی از نوع اکسايش و کاهش، اعداد اکسايش برخی از واکنش دهنده ها و يا حتی تمامی آنها تغيير می کند. از آنجایی که در هر واکنش شيميايی، همان گونه که قانون بقای جرم باید رعايت شود، قانون بقای بار الکتريکی نیز باید رعايت گردد.
بنا به قانون بقای جرم، در موازنه واکنش های شيميايی باید تعداد اتم ها يا اتم گرم های هر عنصر در دو طرف یک معادله شيميايی برابر و مساوی باشد. برای برقراری موازنه بار الکتریکی، تعداد الکترون هايی که واکنش دهنده ها می توانند بگیرند، با تعداد الکترون هايی که واکنش دهنده ديگر از دست می دهد، باید برابر و مساوی باشد. در نتیجه در این روش می توان از تغییر اعداد اکسایش برای موازنه واکنش های شیمیایی استفاده نمود.
نکته
در روش عدد اکسایش برای موازنه کردن واکنش های اکسایش و کاهش، مراحل زیر وجود دارد.
۱- عدد اکسایش هر یک از عناصر شرکت کننده در واکنش را برای شناسایی اتم هایی که اکسید و یا احیا شده اند تعیین می کنند. لازم به ذکر است که عدد اکسايش اتمی که احيا می شود کاهش یافته است. بنابراین، تغيير عدد اکسایش آن در واکنش منفی می باشد. از طرف دیگر، عدد اکسايش اتمی که اکسيد می شود، افزايش یافته است، بنابراین تغيير آن در واکنش مثبت می باشد. تغيير عدد اکسايش هر اتم در واقع از عدد اکسايش آن اتم بعد از شرکت در واکنش منهای عدد اکسايش همان اتم قبل از شرکت در واکنش محاسبه می شود.
۲- اگر اتمی در سمت چپ واکنش مورد نظر زیروندی به غیر از یک داشته باشد، باید تغییر عدد اکسایش را در آن زیروند ضرب نمود. لازم به ذکر است که مقدار تغییر عدد اکسایش را بدون علامت در زیروند ضرب می کنند.
۳- مقدار کاهش عدد اکسایش را ضریب عنصر اکسید شده و به طور مشابه میزان افزایش عدد اکسایش را ضریب عنصر احیا شده قرار می دهند. توجه داشته باشید که ضرایب به گونه ای اضافه می شوند که در نهایت کاهش کل در عدد اکسایش با افزایش کل برابر شوند. زیرا شرط اصلی در یک واکنش اکسايش – کاهش اینست که مجموع جبری تغيير در اعداد اکسايش برابر با صفر باشد.
۴- در واکنش هايی که شامل ترکيبات هيدروژن دار و یا اکسيژن دار می باشند، تشکيل مولکول آب در آنها بسيار محتمل می باشد. بنابراین، در بیشتر موارد می توان برای موازنه کردن اتم های هيدروژن و اکسيژن، مولکول های آب را به تعداد لازم به يکي از طرفين واکنش اضافه نمود.
مثال
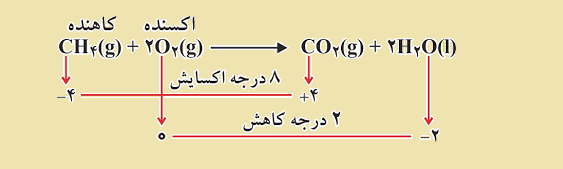
ضرايب معادله واکنش زیر را به روش تغيير عدد اکسايش موازنه کنيد.
H۲SO۴ + Cu → CuSO۴ + SO۲ + H۲O
عدد اکسایش و تغییرات آن برای هر یک از عناصر شرکت کننده در واکنش به شکل زیر می باشد.
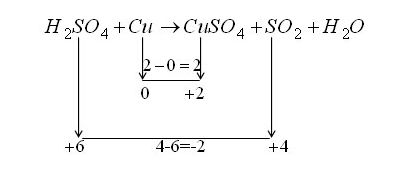
همانطور که در شکل مشخص است، فلز مس اکسایش یافته است، بنابراین کاهنده می باشد. در حالیکه گوگرد کاهش یافته است، پس نقش اکسنده را دارد. علاوه بر آن، در واکنش مذکور با شرکت يک Cu و تبديل آن به کاتیون +Cu۲ و از طرف دیگر شرکت يک S از مولکول اسید سولفوریک و تبديل آن به مولکول SO۲، واکنش از نظر تغيير عدد اکسايش موازنه می باشد. يعني در حقیقت، مجموع جبری تغيير اعداد اکسايش واکنش مورد نظر برابر با صفر شده است.
۱ (+۲) + ۱ (–۲) = ۰
بعد از موازنه معادله شيميايی از لحاظ تغيير اعداد اکسايش، در قدم آخر سراغ موازنه معادله از نظر جرم می رویم. توجه داشته باشید که برای برقراری موازنه جرمی، بايد ضريب مولکول H۲SO۴ را برابر با ۲ در نظر گرفت، بنابراین به همین صورت ضريب مولکول های SO۲ و H۲O نيز برابر با ۲ می شود. معادله نهایی موازنه شده به صورت زیر می باشد.
۲H۲SO۴ + Cu → CuSO۴ + SO۲ + ۲H۲O

روش یون ـ الکترون
این روش به نام های روش نیمه سلولی، نیم واکنش و یا نیم پیلی نیز مشهور می باشد. همانطور که در مقاله اکسایش – کاهش بیان شد، از دست دادن يا گرفتن الكترون به تنهايي انجام نمی شود. بنابراین در یک واکنش شیمیایی، هر اکسایش با کاهش متناظر همراه می باشد. در حقیقت یک نیم واکنش بخشی از یک واکنش کلی اکسیداسیون – احیا می باشد که طی آن الکترون های آزاد به وسیله مواد گرفته یا آزاد می شوند.
در واقع به کلیه واکنش هایی که طی آن ماده ای الکترون از دست می دهد و عدد اکسایش آن افزایش می یابد اکسایش می گویند، درحالیکه به کلیه واکنش هایی که طی آن ماده ای الکترون می گیرد و عدد اکسایش آن کاهش می یابد احیا گفته می شود. در نیمه واکنش های اکسایش و کاهش، الکترون ها به ترتیب در سمت راست و چپ نیمه واکنش نوشته می شوند.
لازم به ذکر است که در موازنه واکنش های شیمیایی به روش یون – الکترون، دو دسته واکنش دارید که کمی با یکدیگر متفاوت می باشند. یک دسته برای واکنش هایی می باشد که در محلول اسیدی انجام می گیرند. دسته دوم مربوط به واکنش هایی است که در محلول قلیایی انجام می شوند .در این حالت در محیط، یون های هیدروژن یا هیدروکسید خواهید داشت. به طور کلی، وقتیکه مواد واکنش به صورت محلول های آبی باشند، روش یون ـ الکترون روش بهتر و مناسب تری نسبت به روش موازنه اکسایش و کاهش به کمک عدد اکسایش می باشد.
نکته
به طور کلی، موازنه کردن یک واکنش اکسایش – کاهش با استفاده از این روش شامل سه مرحله می باشد که عبارت اند از:
۱- معادله اولیه که موازنه نشده است را به دو نیمه واکنش اولیه موازنه نشده تفکیک می شود. زیرا همانطور که بیان شد، هر واکنش اکسایش-کاهش در حقیقت مجموع دو نیمه واکنش اکسایش و کاهش می باشد.
۲- هر نیمه واکنش به طور جداگانه از لحاظ اتمی (عنصری) موازنه می شود. در ادامه کار، تعداد الکترون ها را موازنه می کنند. به صورتی که تعداد الکترون های از دست رفته در نیم واکنش اکسایش با تعداد الکترون های گرفته شده در نیم واکنش کاهش متناظر با آن برابر باشند. در واقع می توان به هر نیمه واکنش، الکترون اضافه کرد تا بار خالص در سمت راست معادله مورد نظر با بار خالص در سمت چپ آن معادله برابر شود. همچنین اگر نیاز بود می توان یک یا هر دو معادله جزئی را در عددی ضرب نمود تا تعداد الکترون های گرفته شده و از دست رفته برابر شود.
۳- با جمع کردن دو نیمه واکنش اکسایش و کاهش موازنه شده، معادله اکسایش-کاهش موازنه شده نهایی را بدست می آورند. توجه داشته باشید که در مرحله دوم، تمام الکترون ها حذف می شوند. بنابراین در معادله موازنه شده نهایی ظاهر نمی شوند. در صورتیکه الکترونی در معادله نهایی باقی مانده باشد، آن معادله نادرست می باشد.
موازنه اتم های اکسیژن و هیدروژن در روش نیمه واکنش ها
در واکنش هایی که در محلول اسیدی انجام می شوند، برای موازنه اتم های اکسیژن و هیدروژن، هر سمت معادله که اتم اکسیژن کم داشته باشد، به همان تعداد مولکول H۲O اضافه می کنند. علاوه بر آن به طرف مقابل به تعداد دو برابر تعداد مولکول های آب اضافه شده، کاتیون +H اضافه می شود. به عنوان نمونه نیم واکنش زیر را در نظر بگیرید.
Cr۲O۷۲- + ۶e– → ۲Cr۳+
معادله موازنه شده به صورت زیر است.
Cr۲O۷۲- + ۶e– + ۱۴H+ → ۲Cr۳+ + ۷H۲O
در واکنش هایی که در محلول قلیایی انجام می شوند، برای موازنه اتم های اکسیژن و هیدروژن، هر سمت معادله که اتم اکسیژن کم داشته باشد، دو برابر تعداد مورد نیاز آنیون –OH اضافه می کنند. علاوه بر آن به طرف مقابل نصف تعداد آنیون –OH اضافه شده، مولکول H۲O اضافه می شود. به عنوان نمونه نیم واکنش زیر را در نظر بگیرید.
Cl° → ClO۳– + ۵e–
معادله موازنه شده به صورت زیر است.
Cl° + ۶OH– → ClO۳– + ۵e– + ۳H۲O
مثال برای واکنش های محلول قلیایی
MnO۴– (aq) + C۲O۴۲- (aq) + OH– (aq) → MnO۲ (s) + CO۳۲- (aq) + H۲O (l)
در مرحله اول، معادله کلی را به صورت دو معادله جزئی می نویسند.
نیم واکنش کاهش :
MnO4– (aq) → MnO2 (s)
نیم واکنش اکسایش :
C۲O۴۲- (aq) → ۲CO۳۲- (aq)
در مرحله دوم به موازنه جرم هر یک از نیم واکنش ها می پردازند. در اینجا چون واکنش در محیط قلیایی انجام می شود، بنابراین برای موازنه اتم های اکسیژن و هیدروژن از قوانین مربوط به محیط قلیایی استفاده می کنند.
۲H۲O (l) + MnO۴– (aq) → MnO۲ (s) + 4OH– (aq)
۴OH– (aq) + C۲O۴۲- (aq) → ۲CO۳۲- (aq) + 2H۲O (l)
همچنین، موازنه بار به وسیله قرار دادن تعداد مناسب الکترون در هر نیم واکنش انجام می شود.
۲H۲O (l) + MnO۴– (aq) + 3e → MnO۲ (s) + 4OH– (aq)
۴OH– (aq) + C۲O۴۲- (aq) → ۲CO۳۲- (aq) + 2H۲O (l) + 2e
برای موازنه کردن الکترون ها، معادله اول را در عدد ۲ و معادله دوم را در عدد ۳ ضرب می کنند. در این صورت الکترون از دو طرف معادله حذف می شود.
۴H۲O (l) + 2MnO۴– (aq) + 6e → ۲MnO۲ (s) + 8OH– (aq)
۱۲OH– (aq) + 3C۲O۴۲- (aq) → ۶CO۳۲- (aq) + 6H۲O (l) + 6e
در نهایت دو معادله را با یکدیگر جمع کرده و معادله کلی نوشته می شود.
۲MnO۴– (aq) + 3C۲O۴۲- (aq) + 4OH– (aq) → ۲MnO۲ (s) + 6CO۳۲- (aq) + 2H۲O (l)
مثال برای واکنش های محلول اسیدی
I– (aq) + H۲O۲ (aq) + H+ (aq) → I۲ (aq) + H۲O (l)
در مرحله اول، معادله کلی را به صورت دو معادله جزئی می نویسند.
نیم واکنش کاهش :
I– (aq) → I۲ (aq)
نیم واکنش اکسایش :
H۲O۲ (aq) → H۲O (l)
در مرحله دوم به موازنه جرم هر یک از نیم واکنش ها می پردازند. در اینجا چون واکنش در محیط اسیدی انجام می شود، بنابراین در نیم واکنش کاهش از کاتیون +H برای موازنه کامل جرم استفاده شد.
۲I– (aq) → I۲ (aq)
H۲O۲ (aq) + 2H+ (aq) → ۲H۲O (l)
علاوه بر آن، موازنه بار به وسیله قرار دادن تعداد مناسب الکترون در هر نیم واکنش انجام می شود.
۲I– (aq) → I۲ (aq) + 2e
۲e + H۲O۲ (aq) + 2H+ (aq) → ۲H۲O (l)
در مرحله سوم، زیرا تعداد الکترون ها در هر نیم واکنش با هم برابر بود، پس نیم واکنش ها را با یکدیگر جمع کرده و معادله کلی نوشته می شود.
۲I– (aq) + 2H+ (aq) + H۲O۲ (aq) → I۲ (aq) + 2H۲O (l)

مراحل کامل موازنه واکنش های اکسایش و کاهش
به طور کلی براي موازنه کامل يک واکنش اکسايش – کاهش بايد مراحل زير را به ترتيب انجام داد.
۱- واکنش دهنده ها و فرآورده ها را به دقت مشخص نمود.
۲- معادله موازنه نشده ای را برای واکنش مورد نظر با توجه به واکنش دهنده ها و فرآورده ها نوشت.
۳- اتم هايي که عدد اکسايش آنها تغيير کرده است را مشخص نمود، همچنین تغيير عدد اکسايش هر کدام از آنها را تعیین کرد.
۴- براي هر يک از مواد، ضريب مناسب در نظر گرفت، به صورتیکه مجموع تغييرات اعداد اکسايش اتم ها در واکنش برابر با صفر شود.
۵- بر اساس ضرايب مشخص شده در بند قبلی، واکنش مورد نظر را در مجموع موازنه کرد.
۶– در محيط های آبی با استفاده از کاتیون +H و آنیون –OH به تعداد لازم در يکی از طرفين واکنش، می توان به موازنه کردن واکنش کمک نمود.
۷- توجه داشته باشید که در بیشتر مواقع، براي موازنه اتم های هيدروژن و اکسيژن، مي توان از مولکول های H۲O کمک گرفت.



















