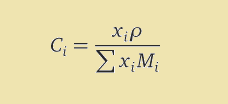کسر مولی (Mole fraction) یا جزء مولی یک روش برای بیان غلظت می باشد که در علم شیمی برای تعیین عناصر متفاوت موجود در یک ترکیب و یا غلظت یک ترکیب مورد نظر در یک مخلوط به کار می رود. کسر مولی یک محلول که با نماد X نشان داده می شود، برابر با نسبت تعداد مول های یک جز در یک مخلوط به تعداد کل مول های آن مخلوط تعریف می شود. در این مقاله در نشریه جهان شیمی فیزیک، توضیحات بیشتری در رابطه با کسر مولی، نحوه محاسبه و اهمیت آن در واکنش های شیمیایی ارائه شده است. لطفا با ما همراه باشید.
فهرست مطالب این مقاله
۱- مقدمه
۲- مفهوم کسر مولی
۱-۲ درصد جزء مولی
۲-۲- محاسبه کسر مولی مخلوطی از مواد
۳- محاسبه مول با استفاده از کسر مولی
۴- کاربرد جزء مولی
۵- تبدیل کسر مولی و مولالیته
۶- تبدیل جزء مولی و غلظت مولار
مقدمه
توجه داشته باشید که اگر اجزای یک مخلوط به صورت يكسان و يكنواخت پخش شوند، يا به عبارتی دیگر مخلوط همگن باشد، مخلوط مورد نظر، محلول ناميده می شود. معمولا نسبت اجزاء در محلول را با غلظت محلول بيان می کنند. در حقیقت غلظت یک جز در محلول برابر با نسبت مقدار آن جزء به مقدار حلال يا محلول تعریف می شود.
همانطور که می دانید از کمیت های زیادی برای بیان غلظت، در علم شیمی استفاده می شود. معمولا برای انجام کارهای روزمره به دلیل سادگی و راحتی از مولاریته استفاده می کنند. اما غلظت مولار یا همان مولاریته وابسته به دما بوده و با تغییر دما اندکی تغییر می کند. از طرفی دیگر، برخی از خواص محلول ها به ماهیت محلول مورد بررسی وابسته نمی باشند، بلکه به غلظت ذرات حل شده در آن بستگی دارند.
از این جهت در محاسبات این دسته از خواص محلول ها (من جمله خواص کولیگاتیو)، بهتر است از کمیت هایی استفاده کنند که به دما وابسته نیستند. دو نوع از این کمیت های اندازه گیری غلظت عبارتند از: کسر مولی و مولالیته. در واقع این دو کمیت در دسته بندی غلظت ها، بر اساس نسبت مول يا جرم حل شونده به مول يا جرم حلال و يا محلول طبقه بندی می شوند.
مفهوم کسر مولی
کسر مولی یک جز در محلول از نسبت تعداد مول های آن جز مورد نظر به مجموع تعداد کل مول های تمام اجزای موجود در محلول (محلول و حل شونده) محاسبه می شود. این کمیت به کمک رابطه زیر محاسبه می شود :
که در آن، Xi کسر مولی جز i، علامت ni نشان دهنده تعداد مول جز i و nt نشان دهنده تعداد کل مول ها می باشد. با توجه به معادله مشخص می شود که کسر مولی یک کمیت بدون بعد می باشد. لازم به ذکر است که کسر مولی به صورت درصد بیان نمی شود، بنابراین مقدار آن بین اعداد صفر تا یک می باشد.
می توان با یک مثال مفهوم کسر مول را به خوبی متوجه شد. فرض کنید مخلوطی از ۶ مول آب، ۴ مول دی اکسید کربن و ۲ مول اکسیژن دارید. برای محاسبه جزء مولی بایستی در ابتدا مجموع کل مول ها را محاسبه کنید (۱۲= ۲ +۴ +۶). حال برای محاسبه جزء مولی اکسیژن، تعداد مول آن را تقسیم بر تعداد کل مول ها می کنند. در نتیجه داریم ۲/۱۲ یا ۰/۱۶. علاوه بر آن، کسر مولی آب برابر با ۶ تقسیم بر ۱۲ یا ۰/۵ خواهد بود و کسر مولی دی اکسید کربن برابر است با ۰/۳۳.

درصد جزء مولی
توجه داشته باشید که برای محاسبه درصد جزء مولی اجزاء تشکیل دهنده یک مخلوط، باید کسر مولی را در عدد ۱۰۰ ضرب کنید. توجه داشته باشید که مجموع درصد های جزء مولی تمام اجزای موجود در یک مخلوط همواره برابر با ۱۰۰ می باشد.
محاسبه کسر مولی مخلوطی از مواد
اگر مخلوطی از مواد وجود داشته باشد، مثلا مخلوطی از اجزای C ,B ,A و … را در نظر بگیرید. در این مخلوط تعداد مول هر يك از آنها به ترتيب برابر با مول های nC ,nB ,nA و … می باشد. در این صورت کسر مولی جز A (xA)، کسر مولی جز B (xB)، کسر مولی جز C (xC) و … به صورت زیر تعریف می شوند. توجه داشته باشید که در روابط بیان شده nt نشان دهنده تعداد مول کل مخلوط یا در حقیقت همان مجموع تعداد مول تمام اجزای سازنده مخلوط می باشد ( …nA + nB + nC + n) می باشد.
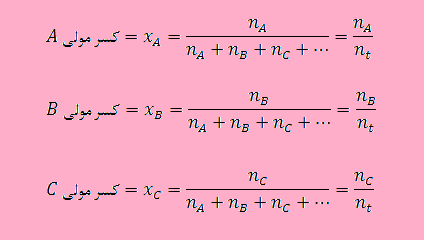
لازم به ذکر است که جمع کسر های مولی تمام اجزای موجود در یک محلول یا مخلوط همواره برابر با ۱ می باشد.
XA + XB +XC +… = ۱
برای اثبات آن داریم :
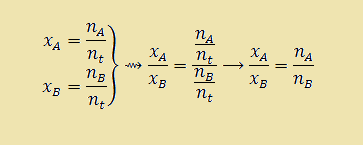
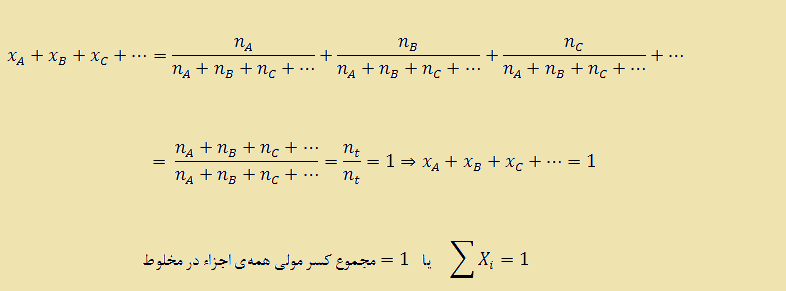
مثال
کسر مولي اجزاء محلولی که شامل ۹۲ گرم گليسرول مخلوط شده با ۹۰ گرم آب می باشد را محاسبه کنید؟
ابتدا باید ببینید که ۹۲ گرم گليسرول و ۹۰ گرم آب معادل چند مول می باشند. جرم مولی گليسرول و آب به ترتیب برابر با ۹۲ و ۱۸ گرم می باشد.
۹۰ g water = 90 g water × ۱ mol water / 18 g water = 5 mol water
۹۲ g glycerol = 92 glycerol × ۱ mol glycerol / 92 glycerol = 1 mol glycerol
حالا تعداد کل مول ها را بدست می آوریم.
total mol = 5 + 1 = 6 mol
در اینجا با کمک رابطه می توان کسر مولی گليسرول و آب را در محلول محاسبه کرد.
Xwater = ۵ mol / 6 mol = 0.833
Xglycerol = ۱ mol / 6 mol = 0.167
علاوه بر آن می توان درستی رابطه XA + XB +XC +… = ۱ را نیز تست نمود. بنابراین داریم :
Xwater + Xglycerol = ۰.۸۳۳ + ۰.۱۶۷ = ۱
محاسبه مول با استفاده از کسر مولی
لازم به ذکر است که با توجه به تعریف کسر مولی و معادله مربوط به آن، می توان تعداد مول هر جز در محلول را نیز محاسبه کرد. در واقع، تعداد مول جز مورد نظر در محلول برابر با حاصلضرب کسر مولی آن جز در تعداد کل مول مخلوط می باشد. به عنوان مثال برای جز i در مخلوط داریم :
تعداد مول کل × کسر مولی جز مورد نظر (i) = تعداد مول جز مورد نظر (i)
ni = Xi × nt
توجه داشته باشید که نسبت تعداد مول دو جز در مخلوط در واقع همان نسبت کسر مولی آنها می باشد. به عنوان مثال، در يك مخلوط كسر مولی جز A برابر با ۰/۲ و كسر مول جز B برابر با ۰/۵ می باشد. در صورتيكه در اين مخلوط ۱۵ مول B داشته باشيد، چند مول A خواهید داشت ؟
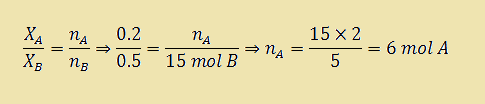
کاربرد جزء مولی
بیشترین استفاده از آن برای تعیین غلظت محلول هایی است که دمای آن محلول تغییر می کند (زیرا همان طور که می دانید جرم حل شونده و یا جرم حلال بر اثر تغییر دما تغییر نمی کند). علاوه بر آن، از کسر مول در مطالعه خواص کولیگاتیو نیز کمک می گیرند.
جزء مولی در استوکیومتری گازها بسیار پر اهمیت و کاربردی می باشد. همانطور که بیان شد میزان محاسبه شده برای جزء مولی مستقل از دما می باشد، بنابراین در یک مخلوط گاز ایده آل می توان از آن برای محاسبه فشارهای جزئی هر یک از گازهای موجود در مخلوط گاز استفاده کرد. مثلا فشار جزئی گاز A به کمک کسر مولی به فشار کل در یک مخلوط گازی (قانون دالتون) مرتبط می شود.
PA = XA × Pt
که در رابطه بالا، PA فشار جزئی گاز A، نماد XA جزء مولی و Pt فشار کل در یک مخلوط گازی می باشند. همچنین به طور متقابل می توان فشار جزئی هر یک از گازهای موجود در یک مخلوط را با ضرب کردن مقدار کسر مولی آن در کل فشار وارد شده توسط مخلوط گازی محاسبه نمود.
از طرفی دیگر ارتباط بین فشار بخار اجزای محلول و غلظت آنها (کسر مول) را به کمک قانون رائول بیان می شود.
*PA = XA × PA
که در آن، PA فشار جزئی گاز A، نماد XA جزء مولی و *PA فشار بخار A خالص می باشند.
نکته
لازم به ذکر است که برای تعیین کسر مولی در مخلوط گازها راه دیگری نیز وجود دارد. همانطور که می دانید در مخلوط گازها حجم و دمای یکسانی برای هر گاز وجود دارد، از این رو تعداد مول گازها را می توان با فشار جزئی آنها متناسب دانست. در نتیجه کسر مولی در مخلوط گازها را می توان با استفاده از نسبت فشارهای جزئی نیز محاسبه نمود. این نسبت عبارت است از :
Xi = Pi / Pt

تبدیل کسر مولی و مولالیته
با کمک تعریف غلظت مولال و کسر مولی، می توان این دو واحد را به یکدیگر تبدیل نمود. در واقع برای تبديل این دو کمیت به هم، معمولا تنها داشتن جرم مولی ها كفايت می كند. به این منظور در ابتدا ۱۰۰۰ گرم آب را به مول تبدیل می کنند. برای این کار جرم آب که ۱۰۰۰ گرم می باشد را بر وزن مولکولی آب که ۱۸ گرم بر مول است، تقسیم می کنند.
۱۰۰۰ g water × ۱ mol water / 18 g water = 55.55 mol water
در نهایت با جایگذاری این مقادیر مولی در تعریف جزء مولی، جزء مولی آب و جز حل شده در محلول محاسبه می شود. به عنوان مثال، کسر مولی حل شونده و حلال را در محلول ۳ مولال سدیم کلرید محاسبه نمایید.
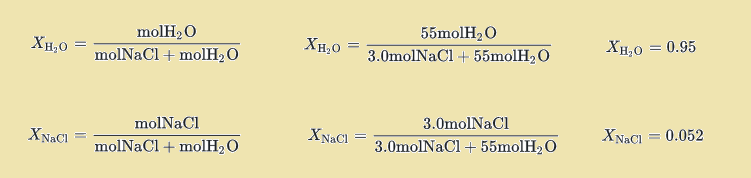
می توان رابطه مولالیته و جزء مولی را به صورت کلی نوشت. اگر جزء مولی جز حل شونده و حلال را به صورت زیر داشته باشید :
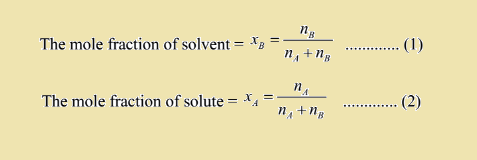
از تقسیم دو معادله بر یکدیگر دارید :
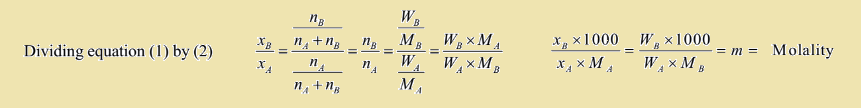
که در آن، XA جزء مولی جز حل شونده، XB جزء مولی حلال، nA نشان دهنده تعداد مول حلال، nB نشان دهنده تعداد تعداد مول جز حل شونده، WA جرم حلال، WB جرم حل شونده، MA جرم مولی حلال، MB جرم مولی حل شونده و m مولالیته می باشند. بنابراین رابطه نهایی به شکل زیر خواهد بود.
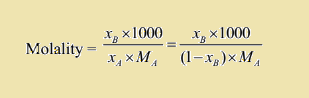
تبدیل جزء مولی و غلظت مولار
با کمک تعریف غلظت مولار و جزء مولی، می توان این دو واحد را به یکدیگر تبدیل نمود. در این تبدیل علاوه بر داشتن جرم مولی ها بايد اطلاعاتی در مورد رابطه بین جرم و حجم محلول يا همان چگالی محلول نیز داشته باشيد. شکل کلی معادله به صورت زیر می باشد.
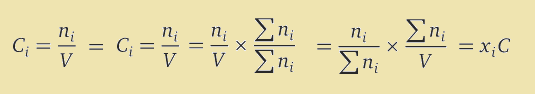
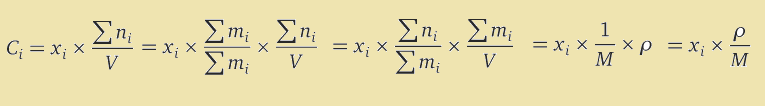
که در آن، Ci مولاریته جزء i، نماد ni نشان دهنده تعداد مول جزء i، نماد V حجم حلال، C غلظت مولار کلی، r چگالی و M میانگین جرم مولی می باشند. بنابراین رابطه نهایی به شکل زیر خواهد بود.