
در علم شیمی، آمفوتر (Amphoterism) یا دوخصلتی به گروه خاصی از مواد گفته می شود که می توانند در واکنش با اسید ها به عنوان باز و به طور مشابه در واکنش با باز ها به عنوان اسید شرکت کنند. به عبارت دیگر، به مولكول ها يا يون هايی كه قادر هستند در مقابل اسيد ها نقش باز و در مقابل باز ها نیز نقش اسيد داشته باشند، آمفوتر ناميده می شوند. توجه داشته باشید که به این ماده مورد نظر، ماده آمفوتریک گفته می شود که می تواند در برابر تغییرات جزئی اسید یا باز مقاومت نماید. در مباحث پیشین نشریه جهان شیمی فیزیک، مطالبی در خصوص اسید و باز به ویژه اسید و باز لوئیس ارائه شده است. در این مقاله با مفهوم آمفوتر و خواص آن آشنا خواهید شد. در ادامه با ما همراه باشید.
فهرست مطالب این مقاله
۱- آمفوتر
۲- اکسید آمفوتری
۳- هیدروکسید آمفوتری
۴- چه موادی خاصیت آمفوتری دارند ؟
۵- تفاوت میان واژه های آمفوتریک و آمفولیت
۶- کاربرد مواد آمفوتر
آمفوتر
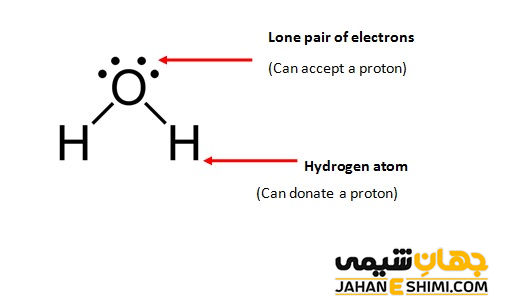
کلمه آمفوتر، از واژه یونانی آمفوتروس به معنای هر دو گرفته شده است. همانطور که بیان شد، به ماده ای گفته می شود که هم رفتاری به شکل اسید ها و هم به شکل باز ها داشته باشد. در واقع اسید به ترکیباتی گفته می شود که دهنده پروتون و یا گیرنده الکترون باشند، در حالیکه باز، ترکیبی است که گیرنده پروتون و یا دهنده الکترون می باشد. با توجه به معنای واژه آمفوتری مشخص می شود که این دسته از مواد، توانایی انجام هر دو عمل را دارند. به عبارت دیگر، آمفوترها موادی محسوب می شوند که می توانند هم با اسید ها و هم با باز ها واکنش دهند.
توجه داشته باشید که بسته به شرایط محیط، این مواد می توانند یکی از نقش های اسید یا باز را ایفا کنند. به عنوان مثال، آب را در نظر بگیرید. مولکول آب در مقابل اسید هیدروکلریک به عنوان باز رفتار می کند، پس می تواند پروتون اسید را بپذیرند.
H۲O + HCl → H۳O+ + Cl−
در حالیکه در مقابل یک باز همچون آمونیاک، می تواند نقش اسیدی داشته باشد. در این صورت پروتون خود را به آمونیاک می دهد.
H۲O + NH۳ → NH۴+ + OH−
اکسید آمفوتری
اکسید ها در حقیقت ترکیبات دوتایی می باشند که شامل اکسیژن و یک عنصر دیگر خواهند بود. اکسید اسیدی به اکسیدی گفته می شود که زمانی با آب واکنش دهد، اسید تولید نماید. این نوع از اکسید ها، به نام انیدرید اسید یا اسید بی آب نیز مشهورند. اغلب اکسید های نا فلزی در این دسته قرار می گیرند، مانند گوگرد تری اکسید و یا نیتروژن دی اکسید. از طرفی دیگر، اکسید بازی به اکسیدی گفته می شود که در آب، باز تولید کند. اکسید های فلزی در صورتیکه درجه اکسایش فلز در آنها پایین باشد، در این دسته قرار می گیرند، مانند اکسید فلزات قلیایی و یا اکسید قلیایی خاکی.
اکسید آمفوتر به اکسیدی گفته می شود که هم خاصیت اسیدی و هم خاصیت قلیایی دارد. به بیان دیگر هم می تواند با اسید ها واکنش دهد و هم با باز ها. اکسید های فلزی که برای تولید آب و نمک با اسید و باز، واکنش می دهند، در این دسته قرار می گیرند. توجه داشته باشید که خاصیت آمفوتری یک اکسید به عدد اکسایش آن اکسید وابسته می باشد. از جمله اکسید های آمفوتری می توان به اکسید سرب اشاره کرد. در شکل زیر عناصر بلوک s و p جدول تناوبی نشان داده شده است. دقت داشته باشید که رنگ بنفش نشان دهنده اکسید های قلیایی، آبی نشان دهنده اکسید های آمفوتری و صورتی نشان دهنده اکسید های اسیدی می باشند.

هیدروکسید آمفوتری
علاوه بر اکسید آمفوتری، هیدروکسید برخی فلزات نیز می توانند هم به شکل باز و هم به شکل اسید عمل کنند که به آنها هیدرو کسید های آمفوتری گفته می شود. از جمله آنها می توان به هیدرو کسید های Al(OH)۳، Sn(OH)۲ ، Cr(OH)۳ ، Be(OH)۲ ، Sb۲O۳ و As۲O۳ اشاره کرد. دقت داشته باشید که هیدرو کسید های دیگری همچون Cu(OH)۲ و Ag۲O خاصیت آمفوتری را به میزان کمتری نشان می دهند. لازم به ذکر است که این دسته از ترکیبات در آب نامحلول می باشند، در حالیکه در محلول هایی با PH بالا یا پایین به راحتی حل می شوند. برای مثال هیدرو کسید روی را در نظر بگیرید. این هیدروکسید در اضافی اسید هیدروکلریک و همچنین در محلول سدیم هیدروکسید حل می گردد.
چه موادی خاصیت آمفوتری دارند ؟
- فلزاتی مانند سرب، قلع، آلومینیوم، بریلیم و روی به همراه اکسید و هیدروکسید این فلزات، آمفوتر می باشند.
- بیشتر شبه فلزات و عناصر دیگری مانند گالیوم، ژرمانیوم، تیتانیوم، ایندیم، اسکاندیم، زیرکونیوم، وانادیوم، آهن، کبالت، کروم، نقره، طلا، مس، تلوریم، آنتیموان و بیسموت که اکسید های آمفوتری را تشکیل می دهند.
- تمام بنیان های منفی اسید های معدنی و آلی که هیدروژن متصل به اکسیژن داشته باشند. به عبارت دیگر، یون های منفی که هیدروژن حاصل از یونش اسید داشته باشند مانند مانند HCO3–، H۲PO۴ و –H۲PO۳. توجه داشته باشید که دو آنیون –H۲PO۲ و –HPO۳۲ آمفوتر نمی باشند.
- اسید هایی که عنصر اکسیژن ندارند اما چند ظرفیتی می باشند. بنیان های هیدروژن دار این دسته از اسید ها آمفوتر محسوب می شوند مانند –HS.
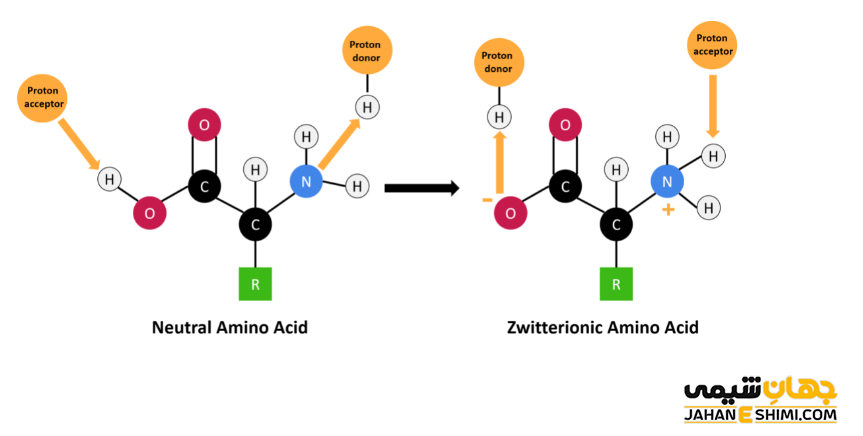
- آمینو اسید ها به دلیل اینکه یک قسمت اسیدی (کربوکسیلیک اسید) و یک قسمت بازی (گروه های آمین) دارند در این دسته قرار می گیرند.
- پروتئین ها، ماکرو مولکول هایی هستند که از مجموعه ای از اسید آمینه های مختلف ساخته شده اند.
- خون
تفاوت میان واژه های آمفوتریک و آمفولیت
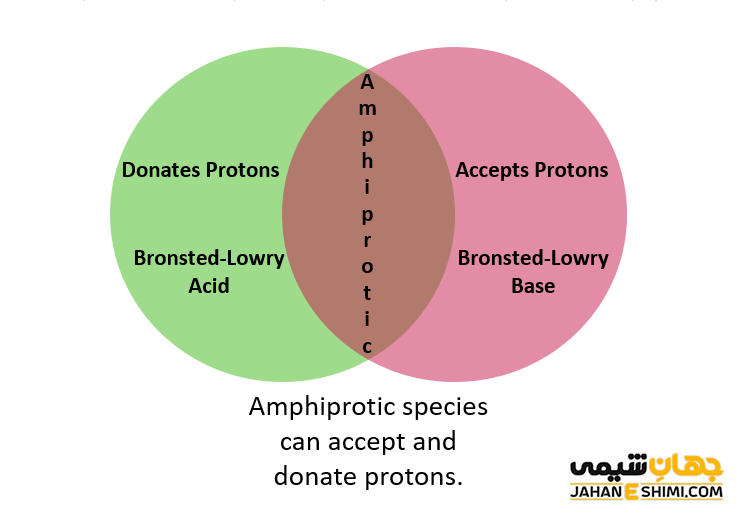
تا اینجای مقاله با واژه آمفوتریک آشنا شده اید. در این بخش به بررسی واژه آمفولیت می پردازیم. از آنجاییکه شباهت آنها می تواند گیج کننده باشد، پس لازم است که مفهوم دو اصطلاح را از یکدیگر متمایز کنید. آمفولیت (Ampholyte) در واقع یک مولکول است که همزمان دارای گروه های بازی و اسیدی می باشد. از بهترین نمونه های رایج برای آمفولیت ها می توان به اسید های آمینه اشاره کرد. در حالیکه اصطلاح آمفوتریک نشان دهنده یک خاصیت می باشد. می توان چنین گفت که واژه آمفوتریک به معنای توانایی یک مولکول، یون و یا هر ترکیب پیچیده دیگری در عمل به عنوان اسید یا باز خواهد بود. بنابراین می توان گفت که آمفولیت ها مولکول هایی هستند که آمفوتریک می باشند.
کاربرد مواد آمفوتر
از اکسید آلومینیوم، در فرآیند تولید آلومینیوم استفاده می کنند. علاوه بر آن، این اکسید کاربرد زیادی در تولید کرم های ضد آفتاب و در واقع صنایع آرایشی و بهداشتی دارد. همچنین می تواند به عنوان کاتالیست در واکنش های آب گیری الکل ها استفاده شود. مثال دیگر، اکسید سرب است که در ساخت شیشه بکار می رود. از پر کاربرد ترین آنها می توان به اکسید روی اشاره کرد. این اکسید به عنوان ماده افزودنی در بسیاری از محصولات مانند شیشه، پلاستیک، سیمان، سرامیک، روان کننده ها، باتری ها، رنگ ها، چسب ها و … کاربرد دارد.
جالب است بدانید که جوش شیرین نیز ترکیبی آمفوتری می باشد. در واقع سدیم بی کربنات با نام آیوپاک سدیم هیدروژن کربنات (NaHCO۳) که با نام های بیکینگ سودا و جوش شیرین نیز شناخته می شود، کاربرد های زیادی دارد. از جمله آنها می توان به کاربرد در صنایع غذایی و پخت و پز، در صنایع دارویی و پزشکی، در کنترل آفات، کپسول های آتش نشانی، وسایل آتش بازی، به عنوان عامل خنثی سازی اسید ها و باز ها، عامل تمیز کننده، عامل ضد عفونی کننده ملایم، عامل افزایش pH و … اشاره کرد.




















