عنصر نیتروژن چیست؟ کاربرد و خواص نیتروژن را می شناسید؟

عنصر نیتروژن در جدول تناوبی عناصر شیمیایی به عنوان عنصر شماره ۷ شناخته میشود. نماد شیمیایی عنصر نیتروژن N، عدد اتمی آن ۷ و عدد جرمی آن ۱۴ است. عنصر نیتروژن از عناصر حیاتی در بین تمام موجودات موجودات است. کاربرد عنصر نیتروژن بسیار گسترده بوده و در بخش های مختلف از صنعت تا کشاورزی و پزشکی کاربرد دارد. عنصر نیتروژن نافلز است و در گروه ۱۵ و تناوب دوم جدول مندلیف جای گرفته است. این عنصر حاوی ۵ الکترون ظرفیت در اوربیتال خود دارد. شاید برایتان جالب باشد که عنصر نیتروژن ۷۸% از جو زمین را شامل میشود. عنصر نیتروژن ۳ ظرفیتی است و میتواند با عناصر دیگر پیوند برقرار کند. در شرایط STP عنصر نیتروژن به صورت گاز وجود دارد.
نشریه علمی جهان شیمی فیزیک به بررسی عناصر جدول مندلیف پرداخته است. عناصری مانند: هیدروژن، لیتیم، بریلیوم، کربن و… . در ادامه با بررسی کاربرد و خواص عنصر کربن با ما همراه باشید.
عنصر نیتروژن در طبیعت
نیتروژن موجود در هوا در هنگام رعد و برق به اکسید نیتروژن تبدیل می شود. اکسید نیتروژن در باران حل شده و پس از رسیدن به زمین جذب خاک می شود. در خاک، ترکیبات نیتروژنی توسط باکتری ها به مواد قابل جذب توسط گیاهان تبدیل می گردند. حیوانات نیز با خوردن گیاهان، نیتروژن را وارد بدن خود می کنند. با مرگ و تجزیه اندام حیوانات، نیتروژن وارد هوا می شود و این چرخه انتقال نیتروژن ادامه می یابد.
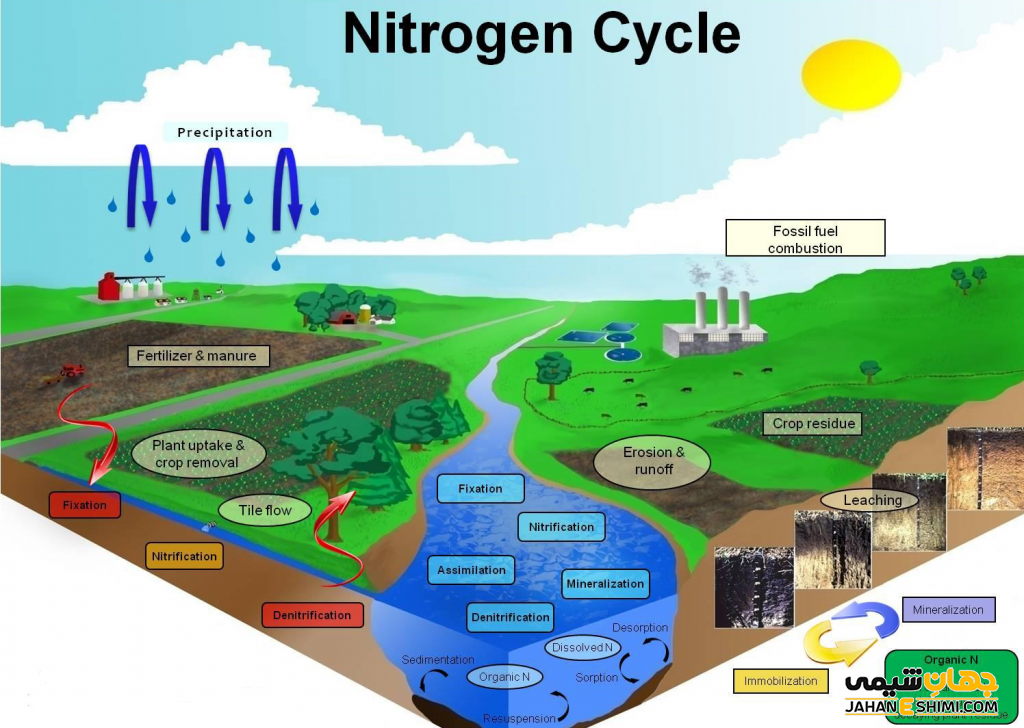
گیاهان فتوسنتز کرده و اکسیژن، انرژی و گلوکز تولید می کنند. اما گیاه برای اینکه با کمک قند ساخته شده بتواند پروتئین سازی کند به نیتروژن نیاز دارد. اغلب گیاهان نمی توانند نیتروژن را بهطور مستقیم از هوا دریافت کنند. گیاهان این ماده را بهصورت یک ماده محلول در آب به نام نیترات توسط ریشه هایشان جذب می کنند. لازم به ذکر است که عنصر نیتروژن گازی بی اثر و بی رنگ است و ۷۸٪ جو زمین را به خود اختصاص داده است.
پیشینه عنصر نیتروژن
درواقع ترکیبات نیتروژنی در قرون وسطی شناخته شده بود. کیمیاگران در آن دوران اسید نیتریک را به عنوان بازدم آب میشناختند. تیزاب سلطانی در آن دوران حاوی ترکیبات نیتروژنی بوده و برای آب کردن طلا مشهور بود. عنصر نیتروژن که با نام لاتین nitrum شناخته می شود توسط شخصی به نام Daniel Rutherford کشف شد. رادرفورد در سال ۱۷۷۲ آن را کشف کرد و نام هوای مهلک را به آن نامید. اواخر قرن ۱۸ شیمیدانان هنگام آزمایشی دریافتند که بخشی از هوا عمل احتراق را همراهی نمیکند. در همان زمان، نیتروژن بوسیله Carl Wilhelm Scheele ، Henry Cavendish و Joseph Priestley کشف شد. آنها نام هوای سوخته را بر این عنصر نهادند. عنصر نیتروژن گازی به قدری بی اثر بود که Antoine Lavoisier آن را ازت نامید. ازت به معنی بدون زندگی است.
ویژگی عنصر نیتروژن عنصر شماره ۷ جدول تناوبی
این ماده از عناصر شیمیایی جدول مندلیف بوده که با نشان شیمیایی N شناخته می شود. این عنصر صدر نشین عناصر گروه ۱۵ است. همچنین در تناوب دوم مابین کربن و اکسیژن قرار گرفته است. این ماده حتی در بافت های زنده مانند آمینواسیدها نیز وجود دارد. ویژگی و کاربرد عنصر نیتروژن به دلیل خواص بی نظیری است که در ادامه به آن ها اشاره شده است. این ماده در گروه ۱۵ جدول تناوبی صدر نشین بوده و بالا تر از فسفر قرار دارد. در تناوب دوم نیز جایگاهی مابین اکسیژن و کربن قرار دارد.
- نماد (نشان) شیمیایی: N
- عدد اتمی: ۷
- جرم اتمی: ۱۴
- نقطه ذوب: ۲۱۰- درجه سانتی گراد
- نقطه جوش: ۱۹۵.۸- درجه سانتی گراد
- ظرفیت: ۳ و ۵
- رنگ: بی رنگ
- حالت STP: گاز
- شماره گروه: ۱۵
- انرژی یونیزاسیون: ۱۴۰۲ کیلوژول بر مول
- شعاع اتمی: ۶۵ pm
- دوره تناوبی: ۲
- شعاع کوالانسی: ۷۱
- گرمای تبخیر: ۵.۵۶ کیلوژول بر مول
مصرف و کاربرد عنصر نیتروژن
یک کاربرد عنصر نیتروژن در اقتصاد و صنعت ساخت آمونیاک از طریق فرایند هابر (Haber) است. معمولاً برای تولید کود و مواد تقویتی و اسید نیتریک از آمونیاک استفاده میشود. کاربرد و مصرف عنصر نیتروژن در موارد زیر صورت می پذیرد:
- بهعنوان پرکننده بی اثر در مخزن های بزرگ برای نگهداری مایعات قابل انفجار، در هنگام ساخت قطعات الکترونیک مانند ترانزیستور، دیود و مدار یکپارچه و همچنین برای ساخت فلزات ضد زنگ استفاده می شود.
- کاربرد عنصر نیتروژن به عنوان ماده خنککننده، برای منجمد کردن غذا و ترابری آن، نگهداری اجساد و یاختههای تناسلی (اسپرم و تخمک) و غده های جنسی (بیضه و تخمدان).
- در زیستشناسی برای نگهداری پایدار از نمونه های زیستی
- نمک اسید نیتریک شامل ترکیبات مهمی مانند نیترات پتاسیم و سدیم و نیترات آمونیوم است. از نیترات پتاسیم برای تولید باروت، نیترات سدیم برای تولید کود استفاده می شود.
- ترکیبات نیترات شده مانند نیتروگلیسیرین و تری نیترو تولوئن (تیانتی) معمولاً منفجر شونده اند.
- از اسید نیتریک به عنوان ماده اکسیدکننده در مایع سوخت موشک ها استفاده می شود. هیدرازین و مشتقات آن نیز در سوخت موشک ها کاربرد دارند.
- نیتروژن اغلب به صورت مایع (معمولاً LN2) در سرمازا ها (Cryogens) استفاده میشود. نیتروژن مایع با عمل تقطیر هوا تولید می گردد. در فشار جو، نیتروژن در دمای منفی ۱۹۵٫۸ درجه سانتی گراد مایع می شود.
عنصر نیتروژن و نقش بیولوژیکی آن
عنصر نیتروژن بخش اصلی اسید آمینه و اسید های هسته ای است که ماده ای حیاتی برای ادامه زندگی اند. لوبیا یک گیاه است و مانند بیشتر گیاهانی که دانه سبوسی دارند عمل بازیافت نیتروژن را به طور مستقیم از هوا انجام می دهد. زیرا ریشه های آن ها برآمدگی هایی دارد که حاوی میکروب هایی است که طی فرایندی به نام تثبیت نیتروژن عمل تبدیل به آمونیاک را انجام میدهند. این گیاهان آمونیاک را به اکسید های نیتروژن و آمینو اسید تبدیل کرده و پروتئین میسازند.
ایزوتوپ عنصر نیتروژن
عنصر نیتروژن عنصر شماره ۷ جدول تناوبی است. این ماده ایزوتوپ هایی را نیز دارد که در ادامه مورد بحث قرار می گیرد. عنصر نیتروژن دو ایزوتوپ پایدار دارد. این ایزوتوپ ها با نام های N-14 و N-15 شناخته می شوند. مهمترین ایزوتوپ عنصر نیتروژنN-14 با فراوانی ۹۹.۶۳۴% است. این ایزوتوپ در چرخه CNO در ستارگان تولید می شود. ایزوتوپ N-15 نیز مقدار درصد باقیمانده را شامل می شود. موارد گفته شده ایزوتوپ های طبیعی این عنصر هستند.

یکی از ده ایزوتوپ این عنصر که به صورت مصنوعی تولید میشود دارای نیمه عمری برابر با نه دقیقه بوده و ایزوتوپهای دیگر نیمه عمر چند ثانیه یا حتی کمتر دارند.
واکنش های زیستشناختی واسطه ای مانند همانند سازی، جذب و ترکیب نیترات سازی و… باعث کنترل پویایی نیتروژن در خاک می شوند. این ترکیبات اغلب نی توانند به عمل غنی سازی N-15 لایه زیرین و تخلیه محصول منجر شوند. البته این فرایند اغلب مقادیری از آمونیام و نیترات نیز دربردارد. خاک نیتراتی نسبت به خاک آمونیومی، توسط ریشه درختان بهتر جذب و ترکیب میشود.
فواید عنصر نیتروژن در زندگی گیاهان
در واقع عنصر نیتروژن غذای اصلی گیاهان است. این ماده از اجزای اصلی پروتئین بشمار می آید. کاربرد عنصر نیتروژن این ماده شگفت انگیز در موارد زیر نیاز است:
- ساخت اسید های آمینه
- در کاتالیز واکنشهای شیمیایی
- حمل و نقل الکترونها
- کلروفیل (قادر ساختن فتوسنتز)
- بسیاری از بخشهای دیگر گیاهان
علاوه براین این ماده نقش مهمی در فرایند های فیزیولوژیکی مختلف داراست. رنگ سبز تیره را القا کرده و رشد برگ، ساقه و سایر بخش های گیاه و نمو آن ها را افزایش میدهد. این ماده با تحریک رشد ریشه فواید زیر را فراهم می کند:
- بهبود کیفیت میوه
- افزایش محتوای پروتئین
- جذب و استفاده بیشتر از سایر مواد مغذی نظیر پتاسیم و فسفر
تاثیر کاهش و افزایش عنصر نیتروژن
کمبود نیتروژن: کاهش رشد، کلروز (تغییر رنگ سبز به زرد)، ایجاد لکه های قرمز و صورتی بر روی برگ ها را ایجاد می کند.
کاربرد زیاد نیتروژن: باعث ایجاد رنگ سبز تیره، اثر منفی روی رشد گیاه و تولید میوه با کمترین کیفیت و کمیت میشود.
با منابع عنصر نیتروژن در جهان آشنا شوید
کاربرد عنصر نیتروژن برای مصرف از منابع مختلفی در دسترس قرار گرفته است.
- تثبیت صنعتی
- تثبیت اتمسفری آن
- تثبیت بیولوژیکی
- منابع آلی
نیتروژن قابل دسترس صنعتی مهم ترین منبع عنصر نیتروژن در جهان است. تثبیت صنعی این ماده توسط Caro در سال ۱۹۰۱ با استفاده از N2 و Ca(CN2) از کلسیم کاربید برای اولین بار صورت گرفت. سپس آمونیاک از گاز نیتروژن و گاز هیدروژن در حرارت بالا ۴۰۰ تا ۶۰۰۰ درجه سانتی گراد و فشار حدود ۲۰۰ تا ۱۰۰۰ اتمسفر توسط Harber و Bosh تولید شد.
روش های تثبیت نیتروژن
- تثبیت نیتروژن اتمسفری
تثبیت نیتروژن اتمسفری زمانی رخ می دهد که گاز نیتروژن توسط انرژی نور شکسته شده و سپس تبدیل به نیتریک اکسید (NO2) میشود. سپس با اکسیژن ترکیب شده و نیترات را تولید میکند. نیترات توسط باران به زمین منتقل می شود. اما مقدار نیتروژنی که توسط این روش تثبیت میشود کم می باشد.
- تثبیت بیولوژیکی نیتروژن
تثبیت بیولوژیکی نیتروژن توسط میکروارگانیسم ها صورت میگیرد. میکروارگانیسمها نیتروژن اتمسفری را توسط فرایندی به نام آمونیفیکاسیون (توسط باکتری) تبدیل به آمونیم میکنند. باکتری هایی مانند nitrosomonas, nitrosospira nitrosococcus , آمونیوم را تبدیل به نیتریک اکسید می کنند. سپس باکتری هایی مانند نیتروباکتر، نیتروسپیرا، نیتروسپینا و نیتروکوکوس نیتریک اکسید را به نیترات تبدیل می کنند. این بهترین فرم قابل جذب برای رشد و نمو گیاه است.
- تثبیت آلی نیتروژن
انواع مختلفی از کود های آلی وجود دارد. این کود ها حاوی انواعی از ترکیبات عنصر نیتروژن میباشند. کود های متراکمی مانند کود های مورد استفاده در حیاط خانه، کود مرغی، کمپوست مزرعه و کود سبز از انواع کودهای حاوی ترکیبات نیتروژنی هستند.
ترکیبات عنصر نیتروژن
هیدرید نیتروژن: که اصلی ترین آن آمونیاک است (NH۳). البته هیدرازین (N۲H۴) نیز از ترکیبات مشهور است. ترکیب آمونیاک ساده تر از آب بوده و در حالت محلول، یون آمونیوم (NH۴+) را تشکیل می دهد. زنجیره ها، حلقه ها و ساختار های بزرگ تر هیدرید های نیتروژنی نیز شناخته شدهاند، ولی در واقع ناپایدار هستند.
آنیون های نیتروژن، آزیدین ها (N۳–) مولکول هایی خطی بوده و نسبت به دی اکسید کربن ایزو الکتریک هستند.
مولکول دیگر با ساختار مشابه، مونوکسید دی نیتروژن N۲O یا گاز خنده است، و یکی از اکسید های گوناگون بوده و برجسته تر از مونوکسید نیتروژن (NO) و دی اکسید نیتروژن (NO۲) است، که هر دوی آنها الکترون غیر زوج دارند. NO۲ تمایل به دو پار شدن داشته و از اجزای تشکیل دهنده هوای آلوده است.
اکسیدهایی مانند تری اکسید دی نیتروژن (N2O3) و پنتاکسید دی نیتروژن (N2O5) معمولاً تا حدی نا پایدار و قابل انفجار هستند. اسید های متناظر آن ها نیتروس (HNO2) و اسید نیتریک (HNO3) بوده و نمک های متناظر هم نیتریت ها و نیترات ها نامیده میشوند.
فراوانی عنصر نیتروژن در جهان
بیشترین عنصر جو کره زمین از نظر حجم همین ماده است. در حدود %۷۸ از جو کره زمین را تشکیل می دهد. تولید عنصر نیتروژن برای اهداف صنعتی با عمل تقطیر هوای مایع صورت می پذیرد. N-14 در اثر همجوشی هسته ای در ستارگان، تولید می گردد. همچنین ترکیبات عمده ضایعات حیوانی عنصر نیتروژن بوده و این ماده معمولاً به صورت ترکیباتی مانند اوره، اسید اوریک و ترکیبات نیتروژنی دیگر یافت می گردد.
اسید نیتریک یکی از چند اسیدی است که از هیدرونیوم قوی تر است.
هشدار و خطرات مصرف عنصر نیتروژن
عنصر نیتروژن گازی کاملا بی اثر است اما گاهی ممکن است باعث بروز خطراتی شود.
کود های نیتراتی شسته شده منبع مهم آلودگی رود ها و آب های زیر زمینی هستند. سیانور (CN–) ترکیب نیتروژنی بسیار سمی است.
عنصر نیتروژن اگر بسیار سرد شود به حالت مایع در می آید. اگر این ماده به دست برخورد کند، دست از شدت سرما ترک ترک و خشک می شود. در این حالت ممکن است اکسیژن به آن نرسد.
این عنصر ۸۰% اتمسفر را تشکیل می دهد. اگر این مقدار به ۱۰۰% برسد (نیتروژن بسیار شود) در اثر فشار و کمبود اکسیژن انسان خفه شده و در عرض کمتر از ۳۰ دقیقه می میرد.




















