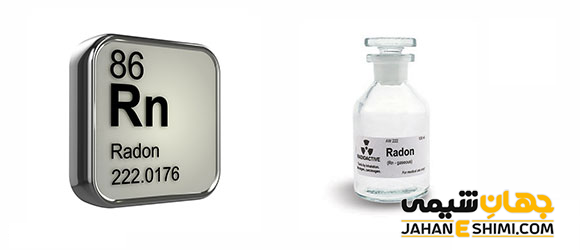
عنصر رادون (Radon) با نماد شیمیایی Rn، یکی از عناصر شیمیایی جدول مندلیف است که عدد اتمی آن ۸۶ می باشد. این عنصر در حقیقت هشتاد و ششمین عنصر از جدول تناوبی بوده که در گروه هجده (XVIII) و دوره ششم جدول تناوبی عناصر قرار گرفته است. در واقع عنصر رادون گازی است بی رنگ، بی بو، بدون طعم و سنگین که از عناصر گروه گاز های نجیب (Noble Gas) می باشد. این گاز با عناصر هلیم (He)، نئون (Ne)، آرگون (Ar)، کریپتون (Kr)، زنون (Xe)، و اگانسون (Og)، در گروه هشت اصلی IA و بلوک p جدول تناوبی قرار گرفته است. در ادامه این مقاله در نشریه جهان شیمی فیزیک به بررسی عنصر رادون پرداخته می شود. لطفا با ما همراه باشید.
تاریخچه کشف عنصر رادون
عنصر رادون برای نخستین بار در سال ۱۹۰۰ میلادی، توسط فیزیکدان آلمانی به نام فریدریش ارنست دورن (Friedrich Ernst Dorn) کشف شد. وی این عنصر را برون تابه رادیوم (Radium Emanation) نامید. لازم به ذکر است که ویلیام رمزی (William Ramsay) و رابرت ویتلا-گری (Robert Whytlaw-Gray) در سال ۱۹۰۸ میلادی، آن را جدا نموده و چگالی رادون را تعیین کردند. این دو دانشمند متوجه شدند که رادون سنگین ترین گاز شناخته شده تا آن زمان است. آنها نام نیتون را برای رادون انتخاب نمودند. این گاز در نهایت از سال ۱۹۲۳ میلادی، رادون نامیده شد. در واقع واژه رادون تلفیقی دیگر از نام عنصر رادیم می باشد.
پیدایش و منابع عنصر شماره ۸۶ جدول تناوبی
یک مولکول از گاز رادون به طور میانگین در هر ۲۱۱۰ مولکول هوا وجود دارد. همانطور که بیان شد، رادون عنصری پرتوزا است که در حقیقت از فروپاشی عنصر رادیم بوجود می آید. در واقع در هر یک مایل مربع از خاک (به عمق ۶ اینچ)، یک گرم عنصر رادیوم وجود دارد که می تواند به رادون تجزیه شود. در این صورت، مقادیر بسیار ناچیزی از این گاز کشنده و پرتوزا، در هوا منتشر می شود.
گاز رادون همچنین از واپاشی اورانیم موجود در طبیعت نیز ایجاد می شود. اورانیم طبیعی و همچنین رسوبات آن، در خاک پوسته زمین، صخره ها و سنگ گرانیت در سراسر کره زمین وجود دارند. در نتیجه می توانند در مصالح ساختمانی و با غلظت های مختلف پیدا شوند. در این صورت، رادون تولید شده در خاک یا مصالح ساختمانی می تواند به تدریج وارد هوای محیط اطراف زندگی ما شود. توجه داشته باشید که رادون تولید شده از این طریق نیز می تواند ذرات پرتوزای دیگری را تولید کند. علاوه بر آن، رادون در برخی از چشمه های آب گرم، آب های زمینی، منابع گاز طبیعی، احتراق زغال سنگ و همچنین بعضی صنایع بشری نیز یافت می گردد.
ویژگی های فیزیکی و شیمیایی عنصر رادون
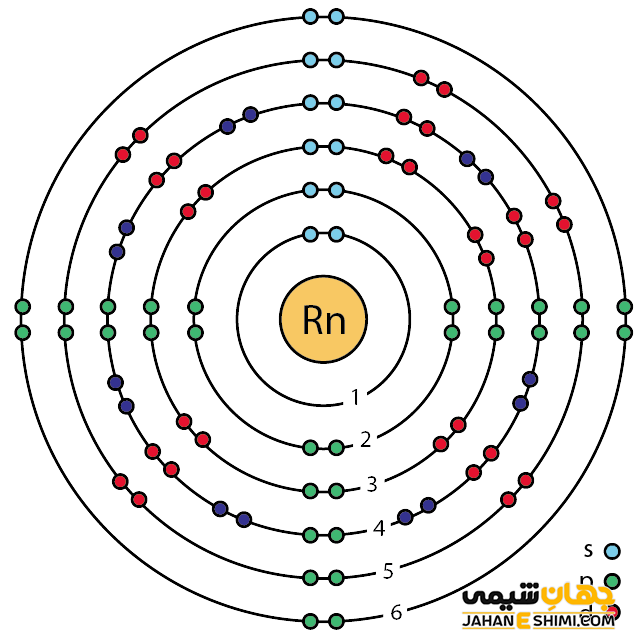
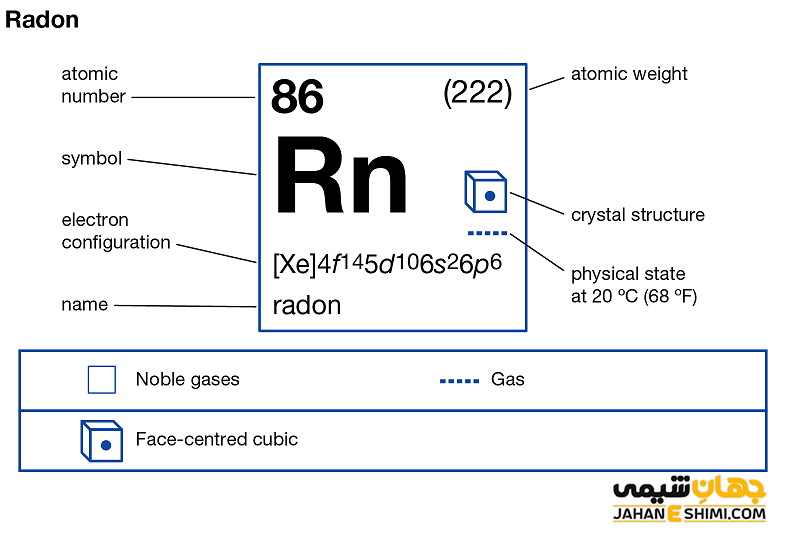
رادون گازی پرتوزا محسوب می شود که از فروپاشی رادیم بوجود آمده است. خصوصیات ویژه و قابل توجه رادون از ساختار اتمی ([۵۴Xe] 4f۱۴ ۵d۱۰ ۶s۲ ۶p۶) آن ناشی می شود. همانند دیگر گاز های نجیب، هشت الکترون در دورترین لایه الکترونی رادون وجود دارد. در نتیجه با توجه به آرایش الکترونی رادون و قاعده اکتت مشخص می شود که اوربیتال های لایه آخر این عناصر از الکترون پر می باشند. بنابراین این عنصر میلی به گرفتن و یا از دست دادن الکترون ندارد. در حقیقت از این حیث پایدار خواهد بود.
جالب است بدانید که رادون در حالت عادی یک گاز بی رنگ می باشد. در حالیکه با سرما دادن به آن (تا زیر دمای انجماد)، به رنگ سبز درخشان و فسفری مشاهده می شود. با سرد کردن بیشتر، به رنگ زرد در می آید. در نهایت و با رسیدن به دمای ذوب، به رنگ نارنجی مایل به قرمز تغییر می کند.
- حالت فیزیکی آن در دمای ۲۵ درجه سلسیوس و فشار ۱ اتمسفر به صورت گاز است.
- دمای ذوب و دمای جوش این عنصر به ترتیب ۷۱- و ۶۱.۷- درجه سانتی گراد است.
- ساختار بلوری آن به شکل مکعبی مرکز وجوه پر (fcc) است.
- این عنصر آلوتروپ ندارد.
- جرم اتمی رادون برابر با ۲۲۲ g/mol است.
- چگالی آن نیز برابر با ۰.۰۰۹۷۳ g/cm۳ می باشد.
- شعاع اتمی آن نیز برابر با ۱۲۰ pm می باشد.
- یون های رادون معمولا عدد اکسایش برابر با اعداد ۰، +۲ و +۶ را دارند. اعداد اکسایش ۰ و +۲ متداول تر می باشند.
- انرژی یونیزاسیون آن برابر با ۱۰۳۷ kJ/mol است.
گاز های نجیب
همانطور که بیان شد، عنصر شماره ۸۶ جدول تناوبی به گروه گاز های نجیب تعلق دارد. تمامی گاز های نجیب (به جز هلیوم)، آرایش الکترونی ns۲ np۶ را نشان می دهند. این آرایش الکترونی بسیار پایدار است. علت نامگذاری آنها به گاز های نجیب و یا گاز های بی اثر، به دلیل واکنش پذیری بسیار سخت آنها می باشد. این گازها از لحاظ شیمیایی خنثی می باشند. از این رو، تمایلی به شرکت در واکنش های شیمیایی ندارند. دلیل این امر در واقع آرایش الکترونی لایه ظرفیت آنها می باشد. این آرایش، کاملا از الکترون پر است، بنابراین تمایلی به گرفتن و یا از دست دادن الکترون ندارند. در واقع عدد اکسایش این گاز ها صفر است.
توجه داشته باشید که در بین عناصر هر تناوب در جدول تناوبی، گاز های نجیب بیشترین انرژی یونیزاسیون را نشان می دهند. در حالیکه الکترونگاتیویته این گازها بسیار پایین است. علاوه بر آن، نقطه ذوب و جوش نیز پایین می باشد. این گاز ها همچنین حلالیت بسیار کمی در آب دارند.
در گذشته به گاز های نجیب، عناصر گروه صفر نیز گفته می شد. زیرا تصور بر این بود که این عناصر نمی توانند با دیگر اتم ها پیوند تشکیل دهند. به علاوه، در زمان گذشته به نظر دانشمندان، این گاز ها در جهان بسیار نادر بودند. از طرفی دیگر، از لحاظ شیمیایی نیز خنثی بوده و ترکیب نمی شدند. بنابراین آنها را گاز های نادر (Rare Gases) یا گاز های راکد نیز (Inert Gases) نامیدند. اما امروزه می دانید که این عناصر در جهان فراوان می باشند، پس کلمه نادر ممکن است گمراه کننده باشد. کلمه راکد نیز می تواند این مفهوم را برساند که این عناصر نمی توانند ترکیبات شیمیایی ایجاد کنند، از این رو بهتر است که از این کلمه نیز استفاده نشود.

ایزوتوپ های عنصر رادون
همانطور که می دانید، ایزوتوپ های یک عنصر، تنها در تعداد نوترون ها با یکدیگر تفاوت دارند. رادون دارای ۳۹ ایزوتوپ شناخته شده است. جرم اتمی این ایزوتوپ ها در محدوده ۱۹۳ تا ۲۳۱ قرار گرفته است. پایدار ترین ایزوتوپ پرتوزای رادون، ۲۲۲Rn است که محصول فروپاشی (ایزوتوپ های دختر خوانده) رادیوم ۲۲۶ (۲۲۶Ra) می باشد. این رادیو ایزوتوپ با نیمه عمر ۳/۸۲۳ روز، ذرات آلفای پرتوزا تابش می دهد. ایزوتوپ پرتوزای ۲۲۰Rn، حاصل تجزیه عنصر توریوم (Thorium) می باشد. این ایزوتوپ، تورون نامیده می شود و نیمه عمری برابر با ۵۵/۶ ثانیه دارد. این ایزوتوپ نیز پرتوی آلفا از خود می تاباند. ایزوتوپ رادیواکتیو ۲۱۹Rn، از عنصر آکتینیوم (Actinium) گرفته شده است. از این جهت، آکتینون نامیده می شود. این ایزوتوپ که تاباننده پرتو آلفا می باشد، نیمه عمری برابر با ۳/۹۶ ثانیه دارد.

کاربرد های عنصر رادون
در اوایل قرن بیستم، از گاز رادون در پرتو پزشکی و برای از بین بردن سلول های سرطانی استفاده شده است. اما با فهمیدن این نکته که پرتو گیری با پرتو های یون ساز، می تواند باعث اختلالات ژنتیکی و همچنین تولید سلول های سرطانی شود (به دلیل ایجاد رادیکال های آزاد در بدن)، این روش منسوخ شد. علاوه بر آن، تصور می شد که پرتو گیری با رادون، می تواند در بهبود بیماری های سیستم ایمنی تاثیر گذار باشد. از این رو، به منظور درمان بیماری هایی همچون آرتروز ها کاربرد داشت. این کاربرد نیز متوقف شده است. امروزه بعضی بیمارستان ها، با پمپاژ گاز رادون از یک منبع رادیومی و ذخیره کردن آن در لوله هایی بسیار کوچک (سوزن یا دانه) رادون تولید می کنند که در موارد درمانی مورد استفاده قرار می گیرد.
در علوم اتمسفری، می توان با کمک غلظت گاز رادون در فضای باز، تا حدودی به ردیابی توده های هوا پرداخت. همچنین از گاز رادون در مطالعات هیدرولوژی (آب شناسی)، برای بررسی فعل و انفعالات و میزان نفوذ آب های زیر زمینی به آب چشمه ها، نهرها و رودخانه ها بکار گرفته می شود. به علاوه، با مطالعه بر روی تغییرات غلظت گاز رادون می توان به پیش بینی زمین لرزه نیز پرداخت.
ترکیبات عنصر رادون
محققان در گذشته تصور می کردند که رادون نیز مثل سایر گاز های کمیاب، از لحاظ شیمیایی بی اثر است. اما تحقیقات نشان داده است که بعضی از ترکیبات رادون وجود دارند. از جمله این ترکیبات می توان به رادون دی فلورید (RnF۲) اشاره کرد. در واقع، عنصر فلور می تواند با رادون واکنش دهد. در این صورت فلورید رادون کلاثریت های (clathrates) رادون گزارش شده است.
خطرات رادون بر روی سلامتی انسان
گاز رادون، یک گاز رادیواکتیو طبیعی است. پس همواره باید با احتیاط کامل با رادون کار کرد. همانطور که بیان شد، رادون یکی از سنگین ترین گاز ها است. بنابراین برای سلامتی مضر می باشد. این گاز به عنوان ماده ای سرطان زا شناخته می شود. از آنجاییکه این عنصر، از خود ذرات آلفا انتشار می دهد، بنابراین استنشاق آن بسیار خطرناک است. ذره آلفا در حقیقت جرم سنگینی دارد. همچنین بار الکتریکی آن نیز دو برابر بار الکترون، اما با علامت مثبت می باشد.
ذرات آلفا انتشار یافته در ریه، انرژی دارند. این انرژی می تواند باعث حرکت ذرات آلفا در بافت های ریه شود. این ذرات کم کم و در مسیر حرکت خود و در هنگام برخورد با سلول بافت های ریه، یون سازی می کنند. این عمل تا زمانیکه ذرات، انرژی خود را به طور کامل از دست بدهند و متوقف شوند، ادامه دارد. انرژی ذرات آلفا که به وسیله بافت ها جذب شده است، سبب آسیب به بافت ریه یا حتی مرگ آن می شود. در واقع اگر هوای تنفسی انسان دارای رادون بسیار زیاد باشد، بافت های ریه به آرامی آسیب می بینند. در نهایت و در دراز مدت، انرژی این ذرات آلفا می تواند سبب سرطانی شدن این بافت ها گردد. به بیان دیگر، گاز رادون دومین عامل اصلی سرطان ریه بعد ازمصرف سیگار است.

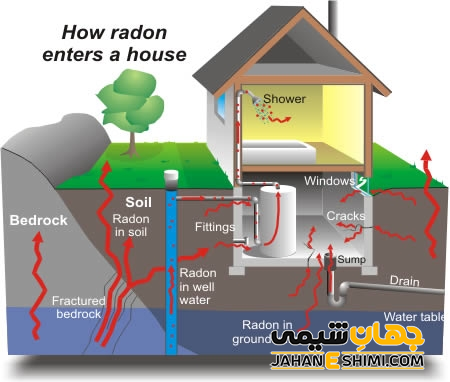
راه های ورود گاز رادون به خانه
وجود ترک و درز در دیوار های خانه، منافذ عبور شبکه تاسیسات ساختمان، منفذ و روزنه در اتصالات و مصالح ساختمان ممکن است در نفوذ گاز رادون به داخل ساختمان موثر باشند. در واقع، بیشترین میزان گاز رادون در زیر زمین خانه و سپس در طبقات اولیه و پایینی ساختمان ها وجود دارد. از جمله راه های ورود رادون به داخل ساختمان می توان به موارد شکاف در کف ساختمان، شکاف در دیوار ها، اتصالات ساختمانی، درز ها در اطراف لوله های سرویس های بهداشتی، فضا های خالی داخل دیوار های خانه، آب های مصرفی در داخل حمام، دستشویی و آشپزخانه اشاره کرد.
بنابراین ضروری است که اقداماتی جهت کاهش نفوذ رادون به داخل خانه انجام گیرد. از جمله این اقدامات می توان به بستن ورودی های اصلی رادون، بکار گیری سیستم لوله های خروج گاز، استفاده از هواکش های مناسب، بکار گیری روش مکش خاک، ایجاد فشار مثبت در خانه، تهویه هوا به صورت طبیعی (باز کردن پنجره ها، باز کردن در ها و تعبیه مجاری خروج هوا در طبقات تحتانی ساختمان) استفاده از یک چاهک فاضلاب کوچک و رنگ آمیزی دیوار ها به کمک رنگ های غیر قابل نفوذ اشاره کرد.