
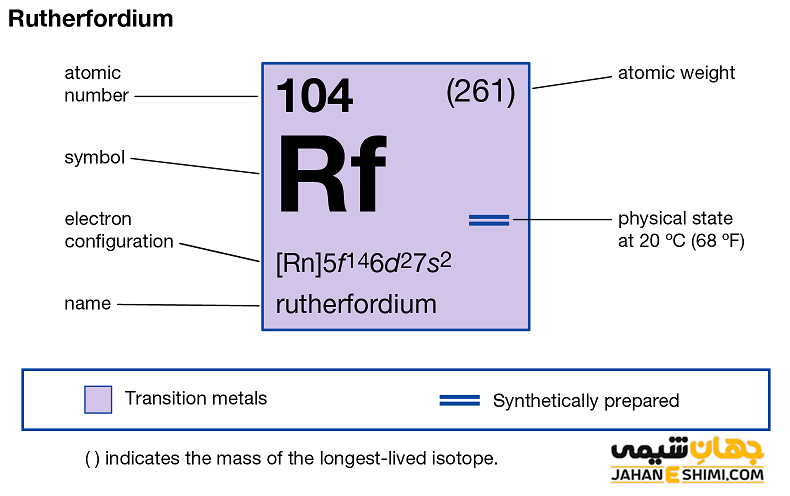
عنصر رادرفوردیم (Rutherfordium) با نماد شیمیایی Rf، یکی از عناصر شیمیایی جدول مندلیف است که عدد اتمی آن ۱۰۴ می باشد. این عنصر در حقیقت صد و چهارمین عنصر جدول تناوبی عناصر بوده که در گروه IVB و تناوب هفتم جدول تناوبی قرار دارد. در واقع عنصر رادرفوردیوم یک فلز واسطه (Transition Metals) مصنوعی و از عناصر به شدت رادیواکتیو است. این فلز با عناصر تیتانیوم (Ti)، زیرکونیوم (Zr) و هافنیوم (Hf) در گروه چهار واسطه جدول تناوبی قرار گرفته است. در ادامه این مقاله در نشریه جهان شیمی فیزیک به بررسی عنصر رادرفوردیوم پرداخته می شود. لطفا با ما همراه باشید.
تاریخچه کشف عنصر رادرفوردیم
کشف عنصر رادرفوردیم بحث برانگیز بوده است. زیرا کشف این عنصر توسط گروه های مختلفی از ایالات متحده آمریکا و اتحاد جماهیر شوروی ادعا شده بود. عنصر رادرفوردیم برای اولین بار در سال ۱۹۶۴ میلادی، به صورت مصنوعی در موسسه تحقیقات هسته ای دوبنا (Dunba) شوروی سابق تهیه شد. دانشمندان در این سنتز، ابتدا اتم پلوتونیوم را با یون های نئون بمباران کردند. سپس آن را در دسترس ترکیب کلریدی مانند زیرکونیم تترا کلرید قرار دادند. در نتیجه آنها با ماده شیمیایی با خواص اکا- هافنیم روبرو شدند. در این حالت، دانشمندان روسی ادعا کردند که توانسته اند اثری را از این شکاف هسته ای را در میکروسکوپ مشاهده کنند. این اثر اشاره به ظهور یک عنصر جدید دارد.
در سال ۱۹۶۹ میلادی، محققان دانشگاه برکلی کالیفرنیا، عنصر جدید را از ترکیب ایزوتوپ کالیفرنیوم- ۲۴۲ و هسته کربن ۱۲ و از طریق برخورد آنها با یک منبع انرژی قوی تهیه کردند. این محققان همچنین اعلام کردند که نتوانسته اند ترکیب ادعا شده توسط دانشمندان روسی را مجدد سنتز و بدست آورند.

نامگذاری عنصر رادرفوردیم
همانطور که بیان شد، ادعا های زیادی مبنی بر سنتز عنصر رادرفوردیوم از آزمایشگاه های اتحاد جماهیر شوروی و ایالات متحده آمریکا مطرح شده بود. بنابراین اولویت اکتشاف و نامگذاری این عنصر در میان دانشمندان شوروی و آمریکایی مورد بحث بود. دانشمندان روسی نام کورچاتوفیم (kurchatoium) و نماد Ku را در تکریم ایگور واسلیهویچ کورچاتوف (Igor Vasliecvich Kurchatov)، آخرین رییس تحقیقات هسته ای انجمن شوروی، پیشنهاد کردند. اما این نام با مخالفت دانشمندان آمریکایی مواجه شد. محققان آمریکایی در حقیقت نام رادرفوردیم را به افتخار فیزیکدان نیوزلندی نامی و برنده جایزه نوبل شیمی یعنی ارنست رادرفورد (Ernest Rutherford) انتخاب کرده بودند. سپس دانشمندان روسی نام دوبنیم را براین این عنصر پیشنهاد کردند، ولی بازهم با مخالفت دانشمندان آمریکایی مواجه شدند.

در نهایت انجمن بين المللي شيمي محض و كاربردي یا همان آیوپاک (IUPAC)، نام موقت آننيلكواديم (Unnilquadium) را برای این عنصر انتخاب کرد. البته در سال ۱۹۹۷ میلادی، آیوپاک به این مباحث خاتمه داد و واژه رادرفوردیم را به عنوان نام رسمی این عنصر تایید کرد. لازم به ذکر است که واژه دوبنیم به عنصر بعدی (عدد اتمی ۱۰۵) تعلق گرفت. در حالیکه تاکنون عنصری با نام کورچاتوفیم نامگذاری نشده است.
پیدایش و منابع عنصر شماره ۱۰۴ جدول تناوبی
عنصر رادرفوردیم در طبیعت وجود ندارد، پس در پوسته زمین یافت نشده است. این عنصر در حقیقت به دست بشر و در آزمایشگاه ساخته شده است. به طور کلی می توان گفت که این عنصر از طریق بمباران يك هدف کالیفرنیومی با هسته هاي کربن ۱۲ سنتز می شود. توجه داشته باشید که بمباران ذرات در دستگاهي به نام شتاب دهنده های خطی انجام می شود. در این شتاب دهنده ها، یون هایی که با سرعت بسیار بالا حرکت می کنند، به هدف هایی از عناصر سنگین برخورد می کنند. در این صورت، عناصر تازه ای بوجود می آورند.
به بیان بهتر، اتم های عنصر رادرفوردیم از طریق هم جوشی میان اتم های کالیفرنیم و کربن بدست آمده است. این کار با شتاب دادن یون های کربن در دستگاه های شتاب دهنده ها انجام شده است. در نهایت و بعد از چند روز، ذرات شتاب دار کربن به سوی هدف کالیفرنیمی، جهت سنتز عنصر رادرفوردیم، بمباران شده اند. هسته های کربن (با عدد اتمی ۶) و کالیفرنیم (با عدد اتمی ۹۸) در یک واکنش هم جوشی هسته ای با یکدیگر ادغام می گردند. بدین شکل، هسته های عنصر جدید را تشکیل دادند که عدد اتمی آن (۱۰۴) حاصل جمع عدد اتمی دو عنصر کربن و کالیفرنیم خواهد بود.

ویژگی های فیزیکی و شیمیایی عنصر رادرفوردیم
همانطور که بیان شد، عنصر رادرفوردیم تاکنون تنها به مقدار کمی تهیه شده است. از این جهت، اطلاعات کمی درباره شكل ظاهري و یا خواص شیمیایی آن وجود دارد. با این وجود، تعدادی پیش بینی و نتایج تجربی اولیه در مورد خواص آن انجام شده است. رادرفوردیوم در چهارمین و در واقع آخرین دوره بلوک- d قرار دارد. توجه داشته باشید که در این بلوک، دومین عنصر است. از طرفی، اولین عنصر سری ترانس آکتینیدی (Transactinide) نیز محسوب می شود.
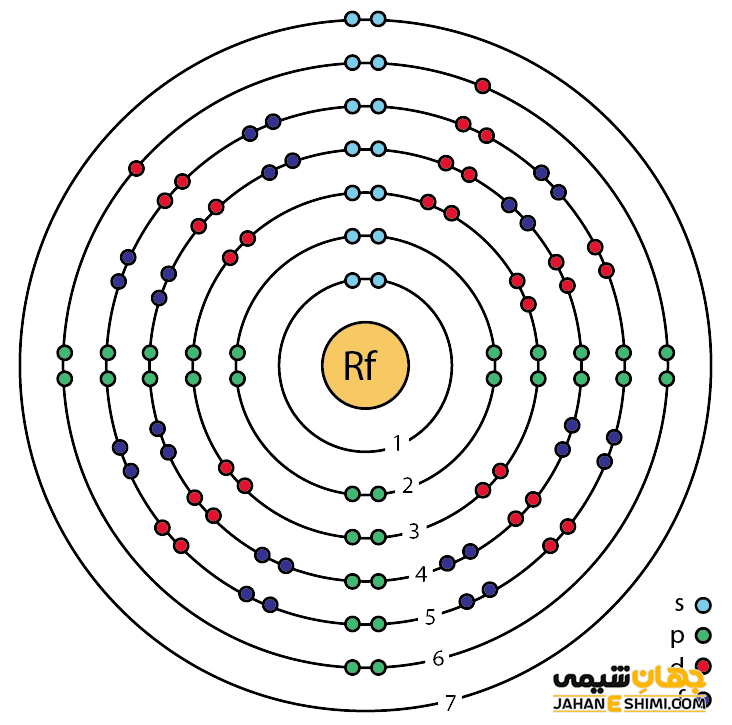
خصوصیات ویژه رادرفوردیم از ساختار اتمی ([۸۶Rn] 5f۱۴۶d۲۷s۲) آن ناشی می شود. همانطور که از آرایش الکترونی مشخص است، اوربیتال d لایه ماقبل آخر در این عنصر در حال پر شدن است. این عنصر به واسطه آرایش الکترونی که دارد، در دسته فلزات واسطه قرار می گیرد. فلزات واسطه در حقیقت در بین فلزات قلیایی خاکی (گروه دوم) و عناصر گروه بور در جدول تناوبی قرار گرفته اند. به عناصر واسطه، عناصر گروه B نیز گفته می شود. با توجه به آرایش الکترونی مشخص است که چهار الکترون در دورترین لایه الکترونی آن وجود دارد. پس در بیشتر ترکیبات شیمیایی به صورت کاتیون چهار بار مثبت (+Rf۴) ظاهر مي شود. از این رو می تواند در چهار پیوند کووالانسی شرکت کند. لازم به ذکر است که انتظار می رود رادرفوردیوم بتواند حالت اکسیداسیون ۳+ (ثبات کمتر) را نیز تشکیل دهد.
خواص ویژه رادرفوردیم
پیش بینی های اولیه بیان می کرد که خواص شیمیایی رادرفوردیم ممکن است شبیه عنصر سرب باشد. این پیش بینی بر این اساس بود که اثرات نسبیتی بر روی پوسته الکترونی ممکن است به اندازه ای قوی باشد که اوربیتال های ۷p سطح انرژی کمتر و پایین تری نسبت به اوربیتال های ۶d داشته باشند. در این صورت رادرفوردیوم می تواند آرایش الکترونی ۶d۱ ۷s۲ ۷p۱ و یا حتی ۷s۲ ۷p۲ را نشان دهد. با انجام روش های محاسباتی بهتر و همچنین مطالعات تجربی مشخص شد که این اتفاق نمی افتد. بنابراین رادرفوردیم نیز مانند بقیه عناصر گروه ۴ رفتار می کند. به بیان دیگر، خواص شیمیایی عنصر رادرفوردیم مشابه عنصر هافنیم می باشد. از دیگر ویژگی های عنصر رادرفوردیوم می توان به موارد زیر اشاره کرد.
- حالت فیزیکی آن در دمای ۲۵ درجه سلسیوس و فشار ۱ اتمسفر احتمالا به صورت جامد است.
- دمای ذوب و دمای جوش این عنصر به ترتیب ۲۱۰۰ و ۵۵۰۰ درجه سانتی گراد پیش بینی می شود.
- خاصت مغناطیسی عنصر رادرفوردیم نیز نا مشخص است.
- انتظار می رود که ساختار بلوری آن به شکل شش ضلعی یا هگزاگونال (hcp) باشد.
- این عنصر احتمالا آلوتروپ ندارد.
- جرم اتمی رادرفوردیم برابر با ۲۶۷ g/mol است.
- چگالی آن نیز برابر با ۱۷ g/cm۳ پیش بینی می شود.
- شعاع اتمی آن نیز ۱۵۷ pm تخمین زده شده است.
- یون های رادرفوردیم معمولا عدد اکسایش برابر با اعداد ۰، +۲، +۳ و +۴ را دارند. اعداد اکسایش ۰، +۳ و +۴ متداول تر می باشند.
- انرژی یونیزاسیون آن برابر با ۵۸۰ kJ/mol است.
ایزوتوپ های عنصر رادرفوردیم
همانطور که در مقالات پیشین نشریه جهان شیمی فیزیک بیان شده است، ایزوتوپ های یک عنصر تنها در تعداد نوترون ها با یکدیگر تفاوت دارند. عنصر رادرفوردیم ایزوتوپ های فراوانی دارد. نخستین ایزوتوپ شناسایی شده آن، می تواند رادیو ایزوتوپ ۲۵۹Rf که در سال ۱۹۶۶ میلادی و یا ایزوتوپ رادیواکتیو ۲۵۷Rf که در سال ۱۹۶۹ میلادی کشف شد، باشد. از آنجاییکه عنصر رادرفوردیوم، عنصری مصنوعی است، بنابراین ایزوتوپ پایدار ندارد. این عنصر در حقیقت به صورت سنتزی و در رآکتور های هسته ای تهیه شده است. در نتیجه نمی توان برای آن جرم اتمی استاندارد تعریف کرد. ۱۶ ایزوتوپ پرتوزا از عنصر رادرفوردیم شناسایی شده است. رادیو ایزوتوپ ۲۶۷Rf پایدار ترین ایزوتوپ رادرفوردیم با نیمه عمر ۱ ساعت و ۱۸ دقیقه است.
بقیه ایزوتوپ های پرتوزای آن، نیمه عمری کمتر از ۱۰ دقیقه دارند. لازم به ذکر است که بیشتر آنها حتی نیمه عمری کمتر از میلی ثانیه دارند. دقت داشته باشید که از میان ایزوتوپ هایی که نیمه عمر آنها مشخص است، ایزوتوپ های سبک تر اغلب نیمه عمر کوتاه تری دارند. از طرفی دیگر، سنگین ترین ایزوتوپ های رادرفوردیم، پایدارترین ایزوتوپ ها هستند. علاوه بر آن، رادرفوردیوم دارای چهار حالت متا (m) نیز می باشد. ایزوتوپ های رادیواکتیو این عنصر دارای جرم های اتمی در محدوده ۲۵۳ تا ۲۷۰ amu (به استثنای جرم های اتمی ۲۶۴ و ۲۶۹) می باشند.

کاربرد های عنصر رادرفوردیم
از آنجاییکه عنصر شماره ۱۰۴ جدول تناوبی به میزان بسیار ناچیز سنتز شده است، بنابراین خیلی کم کاربردی خارج از پژوهش های علمی، هسته ای و تحقیقاتی دارد. به عبارت دیگر، به دلیل نیمه عمر کم رادرفوردیم، این عنصر کاربرد تجاری ندارد. محققان امیدوار هستند که تعدادی از ایزوتوپ های آن که نیمه عمرهای پایینی دارند (مانند رادیوایزوتوپ های ۲۶۱Rf ،۲۶۳Rf ،۲۶۵Rf و ۲۶۷Rf) در پزشکی هسته ای کاربرد داشته باشند. به بیان دیگر، این ایزوتوپ ها می توانند در تشخیص سرطان و یا تومور شناسی مورد استفاده قرار گیرند.
علاوه بر آن، از این عنصر می توان در سیکلوترون ها برای کشف عناصر جدید استفاده کرد (به عنوان هدف جهت بمباران نوترونی). در واقع، ایزوتوپ های سنگین تر رادرفوردیوم که در مقایسه با ایزوتوپ های سبک تر، نیمه عمر طولانی تری دارند، برای این کار مناسب هستند. در نتیجه جهت تحقیقات و مطالعات درباره خواص فیزیکی- شیمیایی عناصر سنگین تر، کاربرد دارند. دقت داشته باشید از آنجاییکه انرژی واپاشی رادرفوردیم چندان زیاد نیست، پس نمیتواند برای تولید انرژی هسته ای به صورت گسترده کاربرد داشته باشد.

ترکیبات عنصر رادرفوردیوم
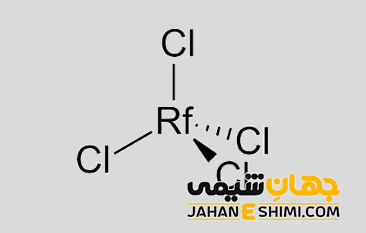
پیش بینی می شود که عنصر رادرفوردیوم بتواند به راحتی با عناصر اکسیژن و هالوژن ها واکنش دهد. در نتیجه اکسید و هالید ها را تولید نماید. به عنوان نمونه، مانند عناصر زیرکونیوم و هافنیوم می تواند یک اکسید بسیار پایدار و نسوز (RfO۲) را تشکیل می دهد. از طرفی دیگر با هالوژن ها واکنش داده و تترا هالید ها (RfX۴) را تشکیل می دهد. این ترکیب در تماس با آب هیدرولیز می شود و اکسی هالید (RfOX۲) تشکیل می شود. تترا هالید ها در حقیقت جامدات فراری محسوب می شوند که به صورت مولکول های چهار وجهی تک مری در فاز بخار وجود دارند. از جمله ترکیبات آن می توان به موارد زیر اشاره کرد.
- اکسید رادرفوردیم (RfO۲)
- تترا کلرید رادرفوردیم (RfCl۴)
- اکسی کلرید رادرفوردیم (RfOCl۲)
- هگزا کلرید رادرفوردیم (RfCl۶)
- پتاسیم هگزا کلرید رادرفوردات (IV) (K۲RfCl۶)
- تترا برمید رادرفوردیم (RfBr۴)
- هگزا فلوئورید رادرفوردات (IV) (RfF۶)
خطرات رادرفوردیم بر روی سلامتی انسان
از آنجاییکه عنصر رادرفوردیم به صورت طبیعی وجود ندارد، پس در پوسته زمین نیز یافت نمی شود. به علاوه، رادرفوردیم آن قدر ناپایدار است (دارای نیمه عمری کوتاه در حدود ۱۰ دقیقه)، که هر مقداری از آن تشکیل شود، به سرعت به سایر عناصر تبدیل می گردد. بنابراین می توان گفت که دلیلی برای در نظر گرفتن اثرات و خطرات سلامتی آن وجود ندارد. به بیان دیگر، عنصر شماره ۱۰۴ جدول تناوبی نقش زیست شناختی مشخصی ندارد، اما با توجه به پرتوزا بودن، سمی محسوب می شود. بنابراین در هنگام کار با آن، باید حتما مراقب بود.



















