
عنصر پلوتونیم (Plutonium) با نماد شیمیایی Pu، یکی از عناصر شیمیایی جدول مندلیف است که عدد اتمی آن ۹۴ می باشد. این عنصر در حقیقت نود و چهارمین عنصر از جدول تناوبی بوده که در گروه IIIB و تناوب هفتم جدول تناوبی قرار دارد. در واقع عنصر پلوتونیم یک فلز واسطه (Transition Metals) به رنگ خاکستری- نقره ای و از عناصر رادیواکتیو گروه اکتینید ها است. عنصر پلوتونیم در تاریکی به رنگ قرمز درخشان است. این فلز با عناصر اسکاندیم (Sc)، ایتریم (Y) و لانتان (La)، در گروه سوم واسطه جدول تناوبی قرار گرفته است. در ادامه این مقاله در نشریه جهان شیمی فیزیک به بررسی عنصر پلوتونیوم پرداخته می شود. لطفا با ما همراه باشید.
تاریخچه کشف عنصر پلوتونیم
عنصر پلوتونیم برای اولین بار در سال ۱۹۴۰ میلادی، توسط گروه دانشمندان آمریکایی یعنی گلن تئودور سیبورگ (GlennT.Seaborg)، ادوین متیسون مک میلان (Edwin McMillan)، ژوزف دبلیو کندی (Joseph W. Kennedy) و آرتور وال (Arthur Charles Wahl)، از طریق بمباران دوترونی هسته اورانیوم به وسیله سیکلوترون و در دانشگاه کالیفرنیا برکلی کشف شد. اما به دلیل ملاحظات زمان جنگ (پلوتونیوم می توانست برای بمب اتمی استفاده شود)، دانشگاه کالیفرنیا تا سال ۱۳۴۸ میلادی از منتشر کردن این اکتشاف خودداری کرد.
همانطور که می دانید، عنصر اورانیوم بعد از کشف سیاره اورانوس و عنصر نپتونیوم بعد از کشف سیاره نپتون نامگذاری شده بودند. از این رو، عنصر پلوتونیوم نیز بعد از کشف سیاره پلوتون که در آن زمان در دسته بندی سیارات قرار داشت نامگذاری شد. سیاره پلوتو در منظومه شمسی بعد از سیاره نپتون قرار دارد.

پیدایش و منابع عنصر شماره ۹۴ جدول تناوبی
همانطور که بیان شد، عنصر پلوتونیم در گروه عناصر کمیاب زمین قرار دارد. لازم به ذکر است که این عنصر دارای بیشترین عدد اتمی می باشد که به صورت طبیعی یافت شده است. پلوتونیوم در طبيعت به مقادير بسيار اندك و ناچیز در سنگ های معدنی اورانیوم (پیچبلند) یافت می شود. اما منبع اصلی این عنصر را می توان رآکتورهای اورانیوم ۲۳۸ در نظر گرفت (در مقیاس های بالا تولید می شود). بنابرابن و به همین دلیل، این عنصر را به عنوان عنصری مصنوعی می شناسند. از سال ۱۹۴۵ میلادی به بعد، پلوتونیم به عنوان محصولی از فرآیند گیر اندازی نوترون و واپاشی بتا رایج شده است. در این فرایند، نوترون ها در جریان شکافت هسته ای، اورانیوم-۲۳۸ را به پلوتونیوم-۲۳۹ تبدیل می کنند.
در واقع عنصر پلوتونيوم در اثر واكنش هسته ای ايزوتوپ اورانيوم بوجود مي آيد. اين فرآیند در نيروگاه های هسته ای اتفاق مي افتد. در نيروگاه های هسته ای (چه آب سنگين و چه آب سبك) در اثر جذب نوترون به وسیله اورانيوم ۲۳۸، پلوتونيوم توليد مي گردد. این فرآیند بدین صورت است که در درون هسته پايدار اورانيوم ۲۳۸، يكي از نوترون های هسته خود به خود به یک پروتون و يك الكترون تبديل مي شود. در این صورت به تعداد پروتون ها يكي اضافه شده و عنصر جديد كه دارای ۹۴ پروتون است را پلوتونيوم نامیدند. علاوه بر آن، فلز پلوتونیوم را همچنین می توان با کاهش تری فلوئورید آن با فلزات خاکی قلیایی تهیه کرد.

ویژگی های فیزیکی و شیمیایی عنصر پلوتونیم
عنصر پلوتونیم، فلزی پرتوزا و رادیواکتیو بسیار خطرناک ( به دلیل نشر ذرات آلفا) است. این عنصر از عناصر سری اکتینید ها (بلوک- f) محسوب می شود. این عنصر، دومین عنصر از سری عناصر ترانس اورانیم است. عنصر پلوتونیوم خالص، فلزی سفید رنگ و متخلخل است، اما در مجاورت با هوا اکسید شده و سطح آن کدر می گردد. در واقع، رنگش تا حدی به زرد تیره تغییر می کند. همانطور که بیان شد، هنگامیکه فلز پلوتونیوم در معرض هوای مرطوب قرار بگیرد، اکسیده و هیدراته می شود. در این صورت حجم آن تا هفتاد درصد افزایش می یابد. در این حالت حتی می تواند ظرف نگهدارنده فولادی خود را نیز بشکند. این عنصر بر خلاف سایر فلزات، هدایت خوبی از الکتریسیته یا گرما نیست.
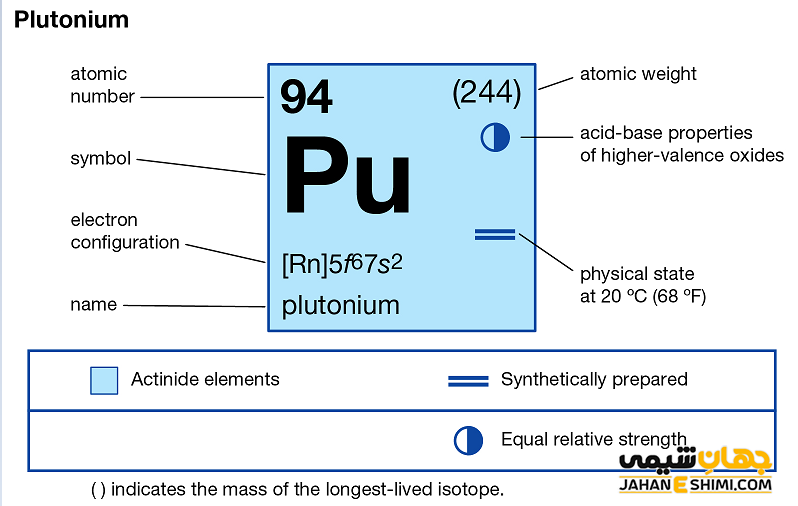
خصوصیات قابل توجه پلوتونیم از ساختار اتمی آن ([۸۶Rn] 5f۶۷s۲) ناشی می شود. همان طور که مشخص است، زیر لایه f در این عنصر در حال پر شدن است. این عنصر نیز همانند لانتانید ها و اکتینید ها و به واسطه آرایش الکترونی که دارد، در دسته فلزات واسطه داخلی قرار می گیرد. در واقع در این دسته از عناصر، الکترون های متمایز کننده در تراز های F(n-2) لایه ظرفیت که در واقع تراز های درونی اند قرار می گیرند. به همین دلیل، به عناصر واسطه داخلی معروف می باشند. این عناصر جزء عنصر های فلزات واسطه جدول تناوبی می باشند.فلزات واسطه قرار می گیرد. فلزات واسطه در حقیقت بین فلزات قلیایی خاکی (گروه دوم) و عناصر گروه بور در جدول تناوبی قرار گرفته اند. به عناصر واسطه، عناصر گروه B نیز گفته می شود.
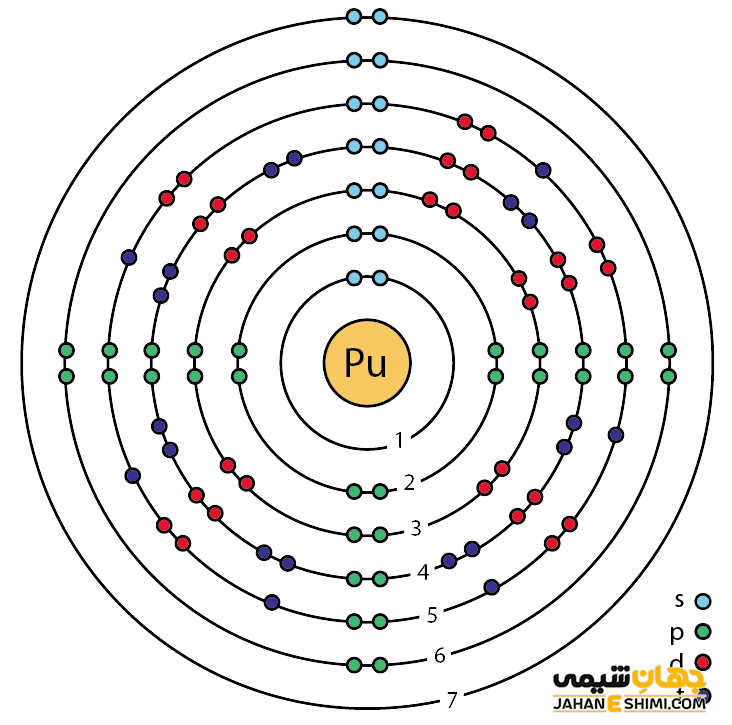
خواص ویژه پلوتونیوم
همانطور که بیان شد، پلوتونیم در دسته عناصر رادیواکتیو، یکی از پرتوزا ترین آنها به حساب می آید. زیرا این عنصر، ذرات آلفا را با انرژی بسیار بالا از خود منتشر می کند. در این حالت اگر مقداری پلوتونیوم در یک جا و در فضای بسته جمع شود، دمای آن به قدری بالا می رود که حتی نمی توان آن را لمس کرد. عنصر پلوتونیوم از لحاظ شیمیایی نیز بسیار فعال می باشد. حتی می توان گفت که از عنصر اورانیوم هم فعال تر است. بنابراین در صورت واکنش با اکسیژن، می تواند حرارت جهنمی تا چندین هزار درجه و با انرژی و توان بسیار زیاد تولید نماید. از طرفی دیگر، این فلز خاصیت هسته ای دارد، یعنی به راحتی با نوترون ها شکافته می شود. لازم به ذکر است که پلوتونیوم از اورانيوم نیز شكافت پذير تر می باشد.
با توجه به آرایش الکترونی مشخص شد که هشت الکترون در دورترین لایه الکترونی پلوتونیم وجود دارد. بنابراین این عنصر می تواند در ترکیبات به صورت کاتیون های مختلف ظاهر شود. حالت اکسیداسیون آن بیشتر ۴+ است. از این رو می تواند در چهار پیوند کووالانسی شرکت کند. عنصر پلوتونیم همچنین حالت اکسیداسیون رنگی در حالت محلول دارد. کاتیون سه بار مثبت یعنی Pu+۳ (اسطوخودوسی یا بنفش)، کاتیون چهار بار مثبت یعنی Pu+۴ (قهوه ای- طلایی)، کاتیون پنج بار مثبت یعنی Pu+۵ (صورتی کم رنگ)، کاتیون شش بار مثبت یعنی Pu+۶ (نارنجی صورتی) و کاتیون هفت بار مثبت یعنی Pu+۷ (سبز). دقت داشته باشید که حالت اکسیداسیون +۷، غیر معمول است. علاوه بر آن، حالت اکسیداسیون ۲+ نیز مشاهده شده است. لازم به ذکر است که این حالت های مختلف معمولا پایدار نیستند. بنابراین می توانند به صورت خود به خود تغییر حالات دهند.

سایر ویژگی های عنصر پلوتونیم
- حالت فیزیکی آن در دمای ۲۵ درجه سلسیوس و فشار ۱ اتمسفر به صورت جامد است.
- دمای ذوب و دمای جوش این عنصر به ترتیب ۶۳۹.۴ و ۳۲۲۸ درجه سانتی گراد است.
- ساختار بلوری آن به شکل تک شیب یا مونوکلینیک (Simple Monoclinic)است.
- این عنصر شش آلوتروپ مختلف دارد. آلوتروپ هفتم نیز در دمای بالا وجود دارد. این آلوتروپ ها دارای ساختار ها و تراکم های مختلف بلوری می باشند. تغییرات شرایط محیطی به راحتی سبب می شود که پلوتونیم از یک آلوتروپ به آلوتروپ دیگری تغییر کند. شش آلوتروپ پلوتونیوم به نام های آلفا، بتا، گاما، دلتا، دلتا پرایمر و آبرتوس اپسیلون نامگذاری شده است. در دمای اتاق فرم آلفای پلوتونیوم را می توان مشاهده نمود. شکل آلفای پلوتونیوم سخت و شکننده است، در حالیکه فرم دلتای آن، نرم و ورقی است.
- جرم اتمی پلوتونیم برابر با ۲۴۴ g/mol است.
- چگالی آن نیز برابر با ۱۹.۸۱۶ g/cm۳ می باشد. این عنصر پر چگال می باشد. بنابراین سنگین ترین عنصر طبیعی کشف شده است.
- شعاع اتمی آن نیز برابر با ۱۵۹ pm تخمین زده شده است.
- یون های پلوتونیم معمولا اعدد اکسایش برابر با اعداد ۰، +۲، +۳، +۴، +۵، +۶ و +۷ دارند. در حقیقت یک اکسید آمفوتری محسوب می شود. اعداد اکسایش ۰ و +۴ متداول تر می باشند.
- اولین انرژی یونیزاسیون آن برابر با ۵۸۴.۷ kJ/mol است.
- فلز پلوتونیوم به سرعت در اسید هیدرویدیک و اسید پرکلریک غلیظ، حل می شود.
اکتینید ها
کلمه اکتینید (Actinide) به معنای شبیه اکتینیوم است که به طور کلی با نماد شیمیایی An نمایش داده می شود. همانطور که معلوم است، نام این سری از عناصر، از عنصر آکتینیوم گرفته شده است. بنابراین خواص شیمیایی این عناصر شبیه به عنصر اکتینیوم خواهد بود. اکتینید ها در واقع از ۱۵ عنصر با عدد های اتمی ۸۹ تا ۱۰۳ تشکیل شده است. گروه اکتینید ها در واقع با فلز اکتینیوم آغاز و به فلز لارنسیوم ختم می شود. در این دسته از عناصر، زیر لایه ۵ اف آنها در حال پر شدن است. به دلیل کمبود جا در جدول و به منظور اینکه نظم و ترتیب جدول تناوبی عناصر بهم نخورد، این گروه از عناصر در یک ردیف ۱۴ تایی در پایین جدول قرار گرفته اند.
تمامی اکتینید ها به جز عنصر اکتینیم جز بلوک f جدول تناوبی هستند. عنصر اکتینیم جز بلوک d جدول تناوبی محسوب می شود، اما خواص آن شبیه به چهارده اکتینید دیگر است. لازم به ذکر است که با کشف عنصر نپتونيم مشخص شد که عناصر توریم، اورانیوم و پلوتونیم می توانند سری جدیدی از عناصر خاک های کمیاب را تشکیل دهند. از این رو و به منظور متمایز شدن آنها از عناصر سری خاک های کمیاب قبلی که با نام عناصر لانتانید شناخته شده بودند، این سری جدید را عناصر اکتینید نامیدند.
خواص ویژه اکتینید ها
از عنصر چهارم به بعد این سری، که به عناصر ترانس اورانیوم مشهورند، در طبیعت به ندرت و مقدار بسیار ناچیز یافت می شوند. تمامی آنها هسته ناپایدار دارند، بنابراین جز عناصر پرتوزا حساب می شوند. این عناصر، معمولا فلزاتی متراکم، نرم، انعطاف پذیر، چگالی بالا و الکتروپوزیتیو هستند. برخی از آنها با چاقو به راحتی برش می خورند. ممکن است آلوتروپ های زیادی تشکیل دهند. معمولا خاصیت پارامغناطیسی نشان می دهند. این فلزات در دمای اتاق جامد بوده و در هوا، خود به خودی آتش می گیرند. با هالوژن ها، کالکوژن ها و یا کربن (تشکیل ترکیبات اورگانو اکتینید) واکنش می دهند. همچنین با آب جوش و اسید های رقیق، گاز هیدروژن آزاد می نمایند. توجه کنید که برای مطالعه اکتینید ها، ساختار هسته عناصر نسبت به آرایش الکترونی آنها از اهمیت بیشتری برخوردار است.
ایزوتوپ های عنصر پلوتونیم
همانطور که می دانید، ایزوتوپ های یک عنصر، در تعداد نوترون ها با یکدیگر تفاوت دارند. عنصر پلوتونیم ایزوتوپ های فراوانی دارد. در واقع بیست ایزوتوپ پرتوزا از عنصر پلوتونیوم شناسایی شده است. ایزوتوپ های رادیواکتیو این عنصر دارای جرم های اتمی در محدوده ۲۲۸ تا ۲۴۷ amu می باشند. رادیوایزوتوپ ۲۳۸Pu با نیمه عمر ۸۷ سال، به صورت طبیعی و به دلیل پرتوزایی از خود، نور مرئی ساطع می کند.
بعد از ایزوتوپ ۲۳۸Pu، رادیو ایزوتوپ ۲۳۹Pu با نیمه عمر ۲۴۱۱۰ سال، رادیو ایزوتوپ ۲۴۰Pu با نیمه عمر ۶۵۰۰ سال، رادیو ایزوتوپ ۲۴۱Pu با نیمه عمر ۱۴ سال، رادیوایزوتوپ ۲۴۲Pu با نیمه عمر ۳۷۳۳۰۰ سال و رادیوایزوتوپ ۲۴۴Pu با نیمه عمر ۸۰/۸ میلیون سال از جمله ایزوتوپ های معروف پلوتونیم می باشند. بقیه ایزوتوپ های رادیو اکتیو آن، نیمه عمری کمتر از از ۷۰۰۰ سال دارند. علاوه بر آن، پلوتونیوم دارای هشت حالت متا (m) نیز می باشد. لازم به ذکر است که تمام ايزوتوپ هاي پلوتونیوم از لحاظ شيميايي فوق العاده فعال می باشند.

کاربرد های عنصر پلوتونیم
عنصر پلوتونیوم یکی از مواد مهم جهت شکافت هسته ای در سلاح های هسته ای پیشرفته می باشد. پلوتونیم یک فلز شکننده و سخت می باشد. اما با آلیاژ با عناصر دیگر، می توان آن را به شکل انعطاف پذیر تبدیل نمود. به عبارت دیگر، آلیاژ عنصر پلوتونیوم با فلزات دیگر (مانند عناصر آلومینیوم، سریم، گالیم) کمک می کند تا این فلز را به کار و جوش تبدیل کند. عنصر پلوتونیم- ۲۳۸ در ژنراتور هواپیما و همچنین چراغ های ناوبری زمینی مورد استفاده قرار می گیرد. این ایزوتوپ همچنین در تجهیزات ردیابی نوترونی (آشکارساز نوترونی) کاربرد دارد. پلوتونیوم همچنین در ژنراتور ترموالکتریک رادیو ایزوتوپ مورد استفاده قرار می گیرد که جهت استفاده در فضاپیما کاربرد دارد. علاوه بر آن، رادیوایزوتوپ ۲۳۸Pu به منظور تقویت کننده ضربان قلب استفاده می شود.

ترکیبات عنصر پلوتونیم
عنصر پلوتونیم می تواند به راحتی با عناصر اکسیژن، نیتروژن، کربن، سیلیکون، هیدروژن و هالوژن ها واکنش دهد. ترکیب مشهور آن، اکسید پلوتونیم (PuO۲) است که می توان از طریق اشتعال پروکسید ها، هیدروکسید ها، اگزالات ها و نیترات های تمام حالت های اکسیداسیونی پلوتونیم در هوا و در محدوده دمایی ۸۷۰ تا ۱۲۰۰ درجه سانتی گراد تهیه نمود. عنصر پلوتونیم همچنین می تواند اکسی هالید های PuOI، PuOBr و PuOCl را نیز تشکیل دهد. از جمله ترکیبات آن می توان به موارد زیر اشاره کرد.
- دی هیدرید پلوتونیم (PuH۲)
- تری هیدرید پلوتونیم (PuH۳)
- دی اکسید پلوتونیم (PuO۲)
- اکسید پلوتونیم (PuO)
- تری کلرید پلوتونیم (PuCl۳)
- تری فلوئورید پلوتونیم (PuF۳)
- تترا فلوئورید پلوتونیم (PuF۴)
- تری برمید پلوتونیم (PuBr۳)
- تری یدید پلوتونیم (PuI۳)

خطرات پلوتونیوم بر روی سلامتی انسان
عنصر پلوتونیوم عنصری رادیواکتیو و پرتوزا است. بنابراین در هنگام مواجه شدن اشعه آن با بدن می تواند در استخوان های بدن (مغز استخوان) جمع شوند. همین امر، خطرناک بودن استفاده از آن را باعث می شود. عنصر پلوتونیم اگر رادیواکتیو هم نبود، اما به عنوان یک فلز سنگین سمی بود. با فروپاشی این عنصر، تابش های آلفا، بتا و گاما آزاد می شود. قرار گرفتن در معرض حاد و طولانی مدت می تواند منجر به بیماری های پرتودرمانی، سرطان و مرگ گردد. ذرات استنشاق شده عنصر پلوتونیم حتی می توانند سبب سرطان ریه گردد. ذرات مصرف شده در درجه اول می تواند به کبد و اسکلت آسیب رساند. لازم به ذکر است که عنصر پلوتونیم هیچگونه نقش بیولوژیکی شناخته شده ای در هیچ ارگانیسمی ندارد.




















