عنصر مسکوویم چیست؟ درباره کاربرد مسکوویوم چه می دانید؟

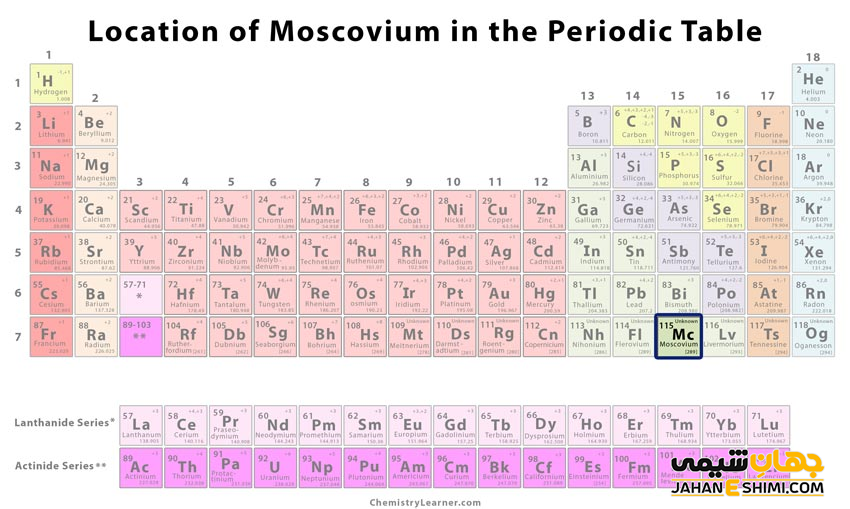
عنصر مسکوویم (Mcerovium) با نماد شیمیایی Mc، یکی از عناصر شیمیایی جدول مندلیف است که عدد اتمی آن ۱۱۵ می باشد. این عنصر در حقیقت صد و پانزدهمین عنصر جدول تناوبی عناصر بوده که در گروه XV و دوره هفتم جدول تناوبی عناصر قرار گرفته است. در واقع عنصر مسکوویم یک عنصر ترانس اکتینیدی (Transactinide) فوق العاده سنگین، مصنوعی و از عناصر به شدت راديواكتيو جدول تناوبی است. این فلز با عناصر نیتروژن (N)، فسفر (P)، آرسنیک (As)، آنتیموان (Sb) و بیسموت (Bi)، در گروه پانزده یا گروه پنج اصلی (گروه نیتروژن) جدول تناوبی قرار گرفته است. توجه داشته باشید که عنصر مسکوویوم سنگین ترین عضو گروه ۱۵ محسوب می شود. در ادامه این مقاله در نشریه جهان شیمی فیزیک به بررسی عنصر مسکوویوم پرداخته می شود. لطفا با ما همراه باشید.
تاریخچه کشف عنصر مسکوویم
عنصر مسکوویم برای اولین بار در سال ۲۰۰۳ میلادی، به صورت مصنوعی در موسسه تحقیقات هسته ای (JINR) دوبنا (Dunba) شوروی سابق گزارش شده است. در این سنتز، یک تیم مشترک از دانشمندان روسی و آمریکایی (دانشمندان آمریکایی آزمایشگاه ملی لورنس لیورمور در کالیفرنیا آمریکا) به سرپرستي فیزیکدان هسته ای روسی یعنی یوری اوگانسیان (Yuri Tsolakovich Oganessian)، در موسسه JINR، اهداف امریسیم (ایزوتوپ ۲۴۳Am) را با هسته های کلسیم (ایزوتوپ ۴۸Ca) بمباران کردند. بدین شکل ۴ اتم از عنصر شماره ۱۱۵ را بدست آوردند.
وجود عنصر جديد توسط گروه های تحقیقاتی مختلف از جمله، گروه دانشمندان آمریکایی در لابراتوار لارنس برکلی کالیفرنیا، آمریکا و محققان موسسه تحقیقات هسته ای یون های سنگین (GSI) هلمهولتز واقع در دارمشتات، آلمان و محققان دانشگاه لوند در سوئد تایید شد. به عنوان مثال، محققان دانشگاه لوند سوئد با بمباران یک ورقه نازک از عنصر آمریسیوم به وسیله یون های کلسیم، توانسته اند فوتون های مربوط به تجزیه الفای عنصر جدید را اندازه گیری نمایند. در حقیقت، انرژی های قطعی از فوتون های اندازه گیری شده با انرژی های پرتوی ایکس مورد انتظار، مطابقت داشته است. در نهایت انجمن بين المللي شيمي محض و كاربردي یا همان آیوپاک (IUPAC)، در سال ۲۰۱۵ میلادی، وجود عنصر مسکوویم را تایید کرد. از این جهت، تیم مشترک روسی دوبنا و تیم آمریکایی آزمایشگاه ملی لورنس لیورمور را رسما به عنوان کاشف عنصر ۱۱۵ به رسمیت شناخت.
نامگذاری عنصر مسکوویم
با استفاده از سیستم عناصر پیش بینی شده توسط مندلیف، عنصر مسکوویم با نام اکا- بیسموت شناخته می شد. در نهایت در سال ۱۹۷۹ میلادی، آیوپاک تصمیم گرفت که تا زمانیکه عنصر فوق کشف و تایید نشده است (در این صورت نامی نیز برایش تعیین نشده)، عنصر را در جدول تناوبی عناصر با نام سیستماتیک معرفی کند. بنابراین، انجمن آیوپاک نام موقت یونون پنتیوم، اونانپنتیوم یا اوناونپنتیم (ununpentium) و نماد Uup را برای این عنصر تا زمانیکه یک تصمیم نهایی برای نامگذاری آن گرفته شود، انتخاب کرد. جالب است بدانید که اغلب دانشمندان، عنصر فوق را با نام های عنصر ۱۱۵، E115 و یا حتی ۱۱۵ می شناختند.
تیم تحقیقات هسته ای دوبنای روسیه، در سال ۲۰۱۵ میلادی، ابتدا نام لانژینیم (langevinium) را به پاس قدردانی از فیزیکدان فرانسوی یعنی پل لانگوین (Paul Langevin) پیشنهاد دادند. اما بعد ها نام مسکوویوم را به خاطر منطقه مسکو که آزمایشگاه دوبنا در آن قرار دارد، انتحاب کرد. در نهایت و در سال ۲۰۱۶ میلادی، آیوپاک واژه مسکوویوم را به عنوان نام رسمی این عنصر تایید کرد.
پیدایش و منابع عنصر شماره ۱۱۵ جدول تناوبی
عنصر مسکوویم به دلیل سنگینی و ناپایداری بسیار زیاد در طبیعت وجود ندارد. بنابراین می توان گفت که در پوسته زمین نیز پیدا نمی شود. به عبارت دیگر، این عنصر تنها به دست انسان و در آزمایشگاه تولید شده است. لازم به ذکر است که تاکنون تنها تعداد کمی از اتم های مسکوویم تهیه شده است.
اتم های عنصر مسکوویم از طریق هم جوشی میان اتم های امریسیم و کلسیم بدست آمده است. این کار با شتاب دادن یون های کلسیم در دستگاه شتاب دهنده، جهت دستیابی به سطوح انرژی بالاتر، انجام شده است. در نهایت و بعد از چند روز، ذرات کلسیم به سوی هدف امریسیمی، جهت سنتز عنصر مسکوویوم، بمباران شده اند. هسته های کلسیم (با عدد اتمی ۲۰) و امریسیم (با عدد اتمی ۹۵) در یک واکنش هم جوشی هسته ای با یکدیگر ترکیب شدند. بدین شکل، هسته های عنصر جدید را تشکیل دادند که عدد اتمی آن (۱۱۵) حاصل جمع عدد اتمی دو عنصر کلسیم و امریسیم است.

سنتز هسته های سنگین
هسته های اتم های سنگین در واکنش های هسته ای سنتز می شوند که در طی آن، دو هسته با اندازه نا برابر در یک هسته ترکیب شوند. هر چقدر دو هسته از لحاظ جرم، غیر مساوی تر باشند، احتمال واکنش میان آن دو بیشتر خواهد بود. ترکیب شیمیایی ساخته شده از هسته های سنگین تر به عنوان هدفی انتخاب می شود که می تواند توسط پرتو های هسته های سبک تر بمباران گردد. دو هسته تنها در حالی می توانند با یکدیگر ترکیب شوند که به اندازه کافی به هم نزدیک شوند. به طور معمول، هسته ها دارای بار مثبت هستند، پس به دلیل دافعه الکترواستاتیکی، یکدیگر را دفع می کنند. حال آنکه بر هم کنش های قوی می تواند بر این دافعه غلبه کند.
زمانیکه دو هسته به یکدیگر نزدیک می شوند، معمولا به مدت ۱۰ تا ۲۰ ثانیه در کنار یکدیگر باقی می مانند، سپس از هم جدا می شوند. اگر همجوشی میان آنها اتفاق افتد، ادغام موقت (که هسته مرکب نامیده می شود) یک حالت برانگیخته است. برای از دست دادن انرژی برانگیختگی و رسیدن به حالت پایدار تر، یک هسته مرکب شکافته می شود و یا یک یا چند نوترون را بیرون می اندازد. وقتیکه انرژی ترکیبی دو هسته نا برابر زیاد نباشد، نیرو های دافعه بین هسته ها بر آن غلبه کرده و واکنش شکست خواهد خورد.
جهت تولید یک هسته منفرد، هدف بایستی در مدت زمان نسبتا زیادی بمباران شود. هسته تازه تولید شده به یک آشکار ساز منتقل می شود که هسته را متوقف می کند. محل دقیق ضربه آتی بر روی آشکار ساز، انرژی آن و زمان ورود مشخص می گردد. هسته پس از ثبت فروپاشی مجددا ثبت می شود و مکان، انرژی و زمان فروپاشی اندازه گیری می شود.
ویژگی های فیزیکی و شیمیایی عنصر مسکوویم
همانطور که بیان شد، عنصر مسکوویم تاکنون تنها به مقدار بسیار کم و در حد چند اتم تهیه شده است. این اتم ها به سرعت تجزیه می شوند. بنابراین، این عنصر هنوز خیلی شناخته شده نیست. به عبارت دیگر، به اندازه ای پایدار نیست که بتوان بر روی آن آزمایش انجام داد. از این جهت، اطلاعات کمی درباره شكل ظاهری و یا خواص فیزیکی و شیمیایی آن وجود دارد. با این وجود، تعدادی پیش بینی و نتایج تجربی اولیه درباره خواص آن انجام شده است. پیش بینی می شود که عنصر جدید عضو فلزات پس واسطه باشد.
فلز مسکوویوم در بلوک- p جدول تناوبی عناصر واقع شده است. از طرفی دیگر، دوازدهمین عنصر سری فرا اکتینیدی نیز محسوب می شود. خواص مسکوویم تا حدودی شبیه همولوگ های سبکترش در گروه پانزده است. همانطور که بیان شد، این عنصر جدید در دسته عناصر ابر سنگین قرار دارد، عناصر فوق سنگین به عنصر هایی با اعداد اتمی بیشتر از ۱۰۳ گفته می شود.
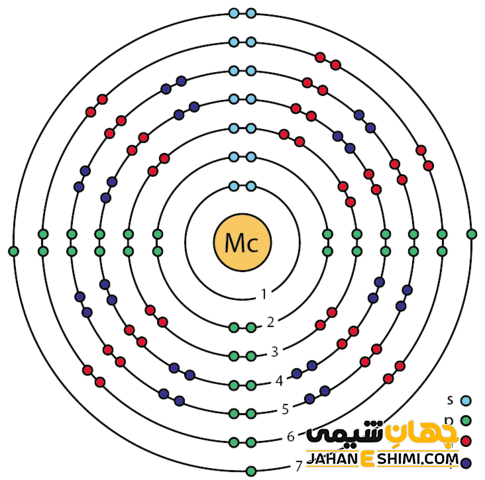
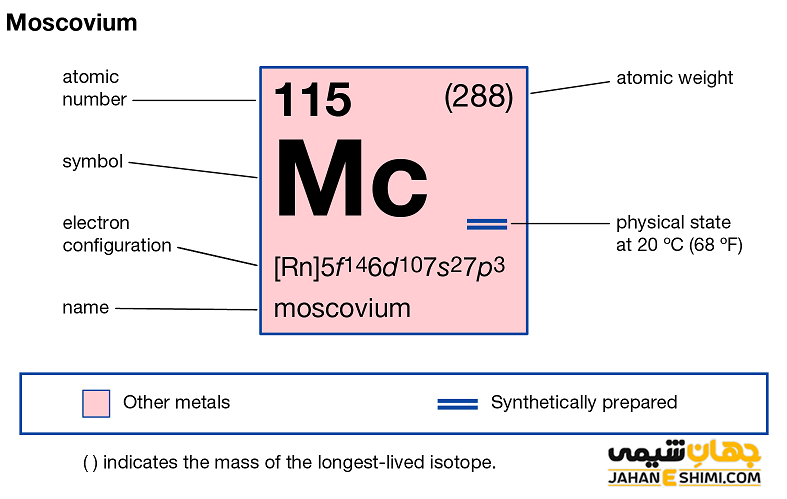
خصوصیات ویژه مسکوویم از ساختار اتمی ([۸۶Rn] 5f۱۴۶d۱۰۷s۲۷p۳) آن ناشی می شود. همانطور که مشخص است، اوربیتال p لایه آخر در این عنصر در حال پر شدن است. با توجه به آرایش الکترونی آن مشخص است که پنج الکترون در دورترین لایه الکترونی مسکوویوم وجود دارد. اوربیتال های ۷s در فلز مسکوویوم پایدارند، بنابراین این عنصر بیشتر دوست دارد که سه الکترون اوربیتال p را از دست بدهد و به کاتیون سه بار مثبت (+Mc۳) تبدیل شود. دقت داشته باشید که در بعضی حالت ها نیز می تواند فقط یک الکترون از دست دهد و در نتیجه به مسکوویم (+Mc) تبدیل گردد.
خواص ویژه مسکوویم
از دیگر ویژگی های عنصر مسکوویوم می توان به موارد زیر اشاره کرد.
- حالت فیزیکی آن در دمای ۲۵ درجه سلسیوس و فشار ۱ اتمسفر احتمالا به صورت جامد است.
- دمای ذوب و دمای جوش این عنصر به ترتیب برابر با ۴۰۰ و ۱۱۰۰ درجه سانتی گراد پیش بینی شده است.
- خاصت مغناطیسی عنصر مسکوویم نا مشخص است.
- ساختار بلوری آن نیز نا مشخص می باشد.
- این عنصر احتمالا آلوتروپ ندارد. در واقع آلوتروپ های آن نا شناخته هستند.
- جرم اتمی مسکوویم برابر با ۲۹۰ g/mol است.
- چگالی آن نیز برابر با ۱۳.۵ g/cm۳ پیش بینی می شود.
- شعاع اتمی آن نیز ۱۸۷ pm تخمین زده شده است.
- یون های مسکوویم معمولا عدد اکسایش برابر با اعداد ۰، +۱ و +۳ را دارند. اعداد اکسایش ۰، +۱ و +۳ متداول تر می باشند.
- انرژی یونیزاسیون آن برابر با ۵۳۸.۳ kJ/mol است.
فلزات پس واسطه
در جدول تناوبی، فلزات پس واسطه به عنصر هایی گفته می شود که در جدول تناوبی عناصر در میان گروه عناصر واسطه (سمت چپ) و شبه فلزات (سمت راست) واقع شده اند. لازم به ذکر است که شمار عناصر پس واسطه با توجه به اینکه فلزات واسطه در کجا به اتمام رسیده اند و در حقیقت غیر فلزات شروع شده اند، تغییر می کند. دلیل استفاده از نام فلزات پس واسطه اینست که هیچ نام پذیرفته شده ای توسط آیوپاک برای این دسته از فلزات وجود ندارد. عناصر ۱۱۲ تا ۱۱۷ جدول تناوبی احتمالا پس واسطه باشند. از آنجاییکه مقدار خیلی کمی از این عناصر فوق سنگین تولید شده است، بنابراین این میزان، جهت پژوهش و بررسی بر روی ویژگی های فیزیکی و شیمیایی آنها کافی نبوده است.
ایزوتوپ های عنصر مسکوویم
همانطور که در مقالات پیشین نشریه جهان شیمی فیزیک گفته شده است، ایزوتوپ های یک عنصر تنها در تعداد نوترون ها با هم متفاوت هستند. عنصر مسکوویم ایزوتوپ های فراوانی دارد. نخستین ایزوتوپ شناسایی شده آن، رادیو ایزوتوپ ۲۸۸Mc است که در سال ۲۰۰۴ میلادی کشف و ردیابی شد. از آنجاییکه عنصر مسکوویوم، عنصری مصنوعی است، بنابراین هیچ ایزوتوپ پایداری ندارد. این عنصر در حقیقت به صورت سنتزی و در رآکتور های هسته ای ساخته شده است. در نتیجه نمی توان برای مسکوویوم جرم اتمی استاندارد تعریف کرد. تاکنون ۴ ایزوتوپ پرتوزا از عنصر مسکوویم شناسایی شده است. ایزوتوپ های رادیواکتیو این عنصر دارای جرم های اتمی در محدوده ۲۸۷ تا ۲۹۰ amu می باشند.
لازم به ذکر است که ایزوتوپ های سنگین تر مسکوویم از ایزوتوپ های سبک تر آن پایدارتر هستند. رادیو ایزوتوپ ۲۹۰Mc پایدار ترین ایزوتوپ مسکوویم با نیمه عمر ۰.۶۵ ثانیه است. بعد از رادیوایزوتوپ ۲۹۰Mc، رادیو ایزوتوپ ۲۸۹Mc با نیمه عمر ۰.۳۵ ثانیه، ایزوتوپ پایدار بعدی آن می باشد. دو ایزوتوپ پرتوزای دیگر آن، نیمه عمری در حد میلی ثانیه دارند (رادیو ایزوتوپ ۲۸۸Mc با نیمه عمر ۱۶۴ میلی ثانیه و رادیو ایزوتوپ ۲۸۷Mc با نیمه عمر ۳۷ میلی ثانیه).

کاربرد های عنصر مسکوویم
از آنجاییکه عنصر شماره ۱۱۵ جدول تناوبی عناصر به مقدار بسیار کم تولید شده است، بنابراین کاربرد خاصی خارج از پژوهش های علمی، تحقیقاتی- هسته ای ندارد. به بیان دیگر، به دلیل نیمه عمر بسیار کم آن، این عنصر عملا کاربرد تجاری ندارد.
ترکیبات عنصر مسکوویوم
پیش بینی می شود که عنصر مسکوویوم بتواند با عناصر اکسیژن، گوگرد و هالوژن ها واکنش دهد. در این صورت اکسید، سولفید و هالید ها را ایجاد نماید. از جمله ترکیبات احتمالی آن می توان به موارد زیر اشاره کرد.
- تری هیدرید مسکوویوم (McH۳)
- هیدروکسید مسکوویوم (McOH)
- کلرید مسکوویوم (McCl)
- تری کلرید مسکوویوم (McCl۳)
- کربنات مسکوویوم (Mc۲CO۳)
- فلوئورید مسکوویوم (McF)
- تری فلوئورید مسکوویوم (McF۳)
- اگزالات مسکوویوم (Mc۲C۲O۴)
- برمید مسکوویوم (McBr)
- تری برمید مسکوویوم (McBr۳)
- یدید مسکوویوم (McI)
- تری یدید مسکوویوم (McI۳)
- اکسی برمید مسکوویوم (McOBr)
- تیوسیانات مسکوویوم (McSCN)
- اکسی کلرید مسکوویوم (McOCl)
- سولفید مسکوویوم (Mc۲S)
- تری سولفور مسکوویوم (McS۳)

خطرات مسکوویم بر روی سلامتی انسان
همانطور که گفته شد، عنصر مسکوویم در طبیعت وجود خارجی ندارد. همچنین مسکوویم اینقدر نا پایدار است و نیمه عمری کوتاهی دارد، که هر مقداری از آن ایجاد شود، به سرعت به بقیه عناصر تبدیل می شود. بنابراین دلیلی برای در نظر گرفتن اثرات و خطرات سلامتی آن وجود نخواهد داشت. به عبارت دیگر، عنصر شماره ۱۱۵ جدول تناوبی حتی نقش زیست شناختی مشخصی نیز ندارد. اما با توجه به پرتوزا بودن، سمی محسوب می شود. بنابراین در هنگام کار با آن، بایستی حتما مراقب بود.




















عنصر ۱۱۵ جدول تناوبی عناصر، به این دلیل مورد تـوجه و سپس در دست تولید آزمایشگاهی قرار گرفت! که پس از حادثه سقوط یک شیئ پرونده ناشناخته در منطقه رازول ایالات متحده، بعد از انتقال آن به صحرای نوادا که محل انجام آزمایشات هسته ای است، در قسمتی از آن صحرا، در منطقه ای با عنوان منطقه ۵۱ که محل انجام مطالعات و مهندسی معکوس بر روی اشیا پرنده ناشناس است، متوجه رفتار گرانشی بسیار عجیب این شئی پرنده ناشناخته شدند. طی بررسی های بعمل آمده مشخص گردید که در ساختار این شئی یک راکتور وجود دارد که قادر به تولید انرژی مغناطیسی است. در درون این راکتور که به شکل یک کاسه وارونه بر روی یک لوله استوانه ای است، عنصری تعبیه شده است که مولد اصلی انرژی مغناطیسی در راکتور میباشد. این عنصر، شک غیر رادیواکتیو یا بعبارتی دیگر ایزوتوپ پایدار عنصر ۱۱۵ جدول تناوبی است که در سیاره زمین وجود ندارد. دانشمندان تاکنون موفق به تولید آزمایشگاهی چهار ایزوتوپ ناپایدار از این عنصر خاص شده اند. اما تاکنون شکل پایدار این عنصر که عملا قابلیت تولید انرژی گرانش یا ضد گرانش را دارد، برای دانشمندان امکان پذیر نبوده است.
احسنت بله شما درست گفتید این عنصر تو سط فرازمینی ها در سفینه انها استفتاده میشود حتی طبق مدارک اولیه عنصر ۱۱۵ توسط فرازمینی ها به انسان ها گفته شد