در علم شیمی آلی، قانون مارکونیکوف (Markovnikov’s rule or Markownikoff’s rule) به قانونی گفته می شود که به وسیله آن می توان محصولات اصلی و عمده یک واکنش افزایشی را در هنگام اضافه کردن اسید پروتونی (Protic Acid) به یک آلکن نامتقارن پیش بینی نمود. این قانون با نام های مارکوف نیکوف و مارکوفنیکوف نیز شناخته شده است. در ادامه این مقاله در نشریه جهان شیمی فیزیک به بررسی قاعده مارکونیکوف پرداخته می شود. لطفا با ما همراه باشید.
تاریخچه قانون مارکونیکوف
در اوایل دهه ۱۸۷۰ میلادی، یک شیمیدان روسی به نام ولادیمیر واسیلیویچ مارکونیکوف (Vladimir Vasilyevich Markovnikov) یک قانون را بر اساس مشاهدات تجربی بدست آورد. این قانون به عنوان قاعده مارکونیکوف منتشر شد. در واقع، وی در ۳۳ سالگی، قاعده ای درباره تعیین محصولات اصلی واکنش های افزایشی آلکن های نامتقارن با ترکیباتی که مولکول ناجور هسته دارند، پیشنهاد داد. بر طبق این قانون، در واکنش های افزایشی میان واکنش دهنده های ناجور هسته با آلکن های نا متقارن، اتم هیدروژن این نوع مولکول های ناجور هسته همواره به آن اتم کربن پیوند دوگانه اضافه می شود که از قبل، تعداد بیشتری از اتم های هیدروژن به آن متصل هستند.

قانون مارکونیکوف
وقتی که یک اسید پروتونی مانند HCl، HBr و HI به آلکنی نامتقارن اضافه شود، هیدروژن اسیدی آنها به کربنی پیوند می دهد که تعداد هیدروژن متصل به آن بیشتر باشد. در حالیکه اتم هالوژن به اتم کربنی پیوند خواهد داد که گروه های آلکیل بیشتری به آن اتم کربن متصل اند. به بیان دیگر، اتم هیدروژن اسیدی به کربن با اتم های هیدروژن بیشتر و اتم هالوژن به کربن با اتم های هیدروژن کمتر متصل می شوند. به عنوان مثال، افزایش هیدروژن برمید به مولکول پروپن را در نظر بگیرید. اتم هیدروژن به اتم کربنی اضافه می شود که از قبل دو اتم هیدروژن دارد. از طرفی دیگر، اتم برم نیز به کربنی که دارای یک اتم هیدروژن است افزوده شده است.
مکانیسم قانون مارکونیکوف
اساس شیمیایی قانون مارکونیکوف، تشکیل پایدار ترین کربوکاتیون در طول فرآیند افزایش است. افزایش یون هیدروژن به یک اتم کربن در آلکن مورد نظر، بار مثبت را بر روی اتم کربن دیگر ایجاد می کند. در این صورت یک واسطه کربوکاتیونی تشکیل می شود. حال هر چه کربوکاتیون تشکیل شده، استخلاف بیشتری داشته باشد، به دلیل القاء و هایپرکانجوگیشن (فوق مزدوج شدن) پایدارتر است. بدین صورت، محصول اصلی و عمده واکنش افزایشی، محصولی است که از واسطه پایدارتر تشکیل شده است. همانطور که می دانید کربوکاتیون نوع سوم پایدار تر از کربوکاتیون های نوع دوم و اول می باشد. همچنین کربوکاتیون نوع دوم نسبت به کربوکاتیون نوع اول، نیز پایدار تر است. در واقع، بر طبق قانون مارکونیکوف، تشکیل کربوکاتیون پایدارتر در اولویت قرار دارد.
با این توضیحات مشخص می شود که محصول اصلی افزایش HX به یک آلکن (که در آن اتم X از اتم H الکترونگاتیوتر است)، حالتی است که اتم هیدروژن با اتم کربن با استخلاف کمتر و اتم X با اتم کربن با استخلاف بیشتر پیوند دهند. لازم به ذکر است که کربوکاتیون با پایداری کمتر نیز همچنان در غلظتی تشکیل می شود و محصول فرعی خواهید داشت. به عبارت دیگر، مکانیسم افزایش HX به یک آلکن، دو مرحله دارد. در مرحله اول، افزایش پروتون (+H) به پیوند دوگانه کربن- کربن از آلکن، یک واسطه کربوکاتیون ایجاد می کند. سپس در مرحله دوم، واکنش میان الکتروفیل و یک هسته دوست به منظور ایجاد پیوند کووالانسی جدید انجام می شود.
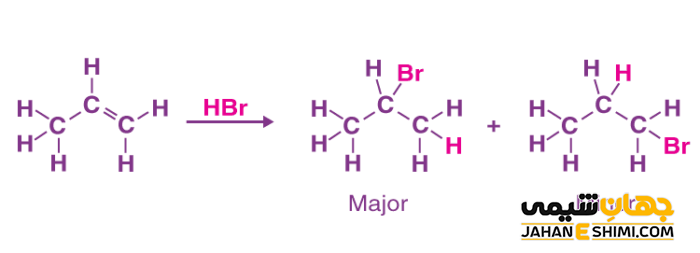
مکانیسم افزایش هیدروژن برمید به مولکول پروپن
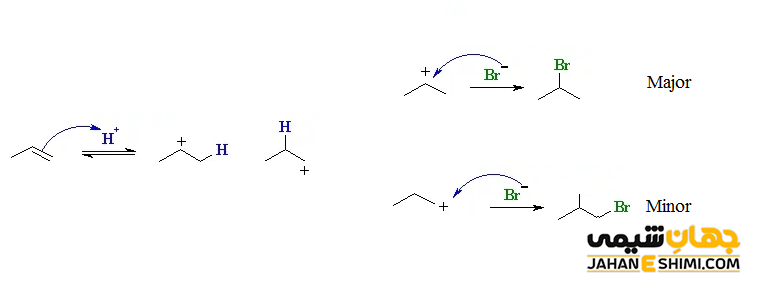
همانطور که در شکل زیر مشخص است، با پروتون دهی به مولکول پروپیلن، دو نوع کربوکاتیون (کربوکاتیون نوع اول و نوع دوم) ایجاد می شود. از آنجاییکه کربوکاتیون نوع دوم نسبت به کربوکاتیون نوع اول، بسیار پایدارتر است، بنابراین، تشکیل آن اولویت بیشتری دارد. در مرحله بعدی، یون نوکلئوفیل هالید به کربوکاتیون نوع دوم تشکیل شده، حمله می کند. در اثر این واکنش، آلکیل هالید مربوطه تولید می شود. دقت داشته باشید که محصول عمده این واکنش، ۲- برمو پروپان است. به عبارت دیگر، فرآورده اصلی و بیشتر، از قانون مارکونیکوف پیروی می کند. در حالیکه که فرآورده کمتر و جانبی، از این قانون پیروی نکرده است.
واکنش آنتی مارکونیکوف
واکنش هایی که شامل واسطه کربوکاتیونی نمی شوند (مانند افزایش رادیکال آزاد)، ممکن است از طریق سایر مکانیسم ها، انجام شوند. این مکانیسم ها به وسیله قاعده مارکونیکوف دیکته نشده اند، بنابراین به چنین واکنش هایی، ضد مارکونیکف گفته می شود. زیرا اتم هالوژن به اتم کربن با استخلاف کمتر پیوند می دهد ( اتم کربنی که پیوند های C-H بیشتری دارد). به عبارت دیگر می توان گفت که در واکنش های آنتی مارکونیکف، تشکیل کربوکاتیون ناپایدارتر در اولویت قرار دارد. لازم به ذکر است که ترکیبات بور، در واکنش های شیمیایی همیشه به صورت مکانیسم ضد مارکونیکوف و حالت سین (syn) عمل می کنند. لازم به ذکر است که واکنش ضد مارکونیکوف را تنها با مولکول HBr می توان دید. بنابراین با مولکول های HCl و HI قابل انجام نیست.
قانون ضد مارکونیکوف را می توان با استفاده از افزایش هیدروژن برومید به مولکول ایزوبوتیلن در حضور بنزوئیل پراکسید یا پراکسید هیدروژن نشان داد. نحقیقات اولیه نشان داده است که دلیل تغییر نسبت محصولات واکنش بر طبق قاعده مارکوفنیکوف به محصولات واکنش بر طبق ضد مارکونیکف، به دلیل وجود غیر منتظره مواد یونیزه کننده رادیکال آزاد همچون پراکسید ها است. پیوند O-O در پراکسید ها، پیوندی نسبتا ضعیف است. این پیوند به کمک نور، گرما و یا حتی گاهی اوقات به صورت خودی خود می تواند تقسیم شود و دو رادیکال آزاد اکسیژن تشکیل دهد. سپس گروه های رادیکال آزاد می توانند با مولکول HBr تعامل کنند تا یک رادیکال Br تولید شود. رادیکال آزاد Br در نهایت با پیوند دوگانه واکنش می دهد.
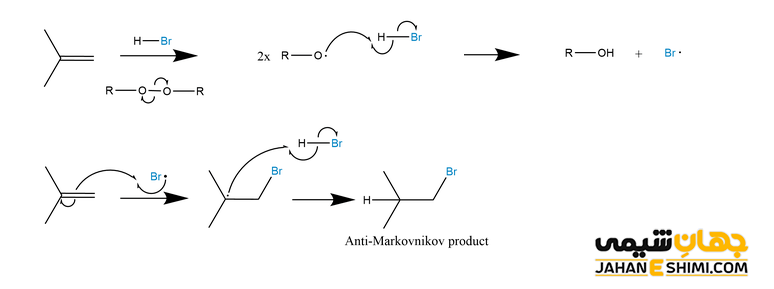
مکانیسم واکنش افزایشی آنتی مارکونیکوف
همانطور که بیان شد، واکنش افزایشی آنتی مارکونیکوف، از مکانیسم رادیکال آزاد پیروی می کند. در حالیکه واکنش مارکونیکوف دارای مکانیسم یونی است. مولکول های پراکسید در این واکنش، در حقیقت به تولید رادیکال آزاد کمک می کنند.
مکانیسم آنتی مارکونیکوف به عنوان یک واکنش زنجیره ای محسوب می شود که سه مرحله مختلف دارد. در مرحله اول که مرحله شروع زنجیره است، تفکیک فوتو شیمیایی مولکول های HBr یا پراکسید انجام می شود. در این صورت، رادیکال های آزاد Br و H ایجاد می شوند. سپس در مرحله دوم که مرحله انتشار است، رادیکال آزاد Br به مولکول آلکن حمله کرده و رادیکال آلکیل تشکیل می شود. در نهایت و در مرحله آخر، رادیکال آلکیل تولیدی به هالید هیدروژن حمله می کند. بدین شکل و از طریق گسست جور پیوند هالید هیدروژن، آلکیل هالید تشکیل می شود.
از آن جهت که اتم برم نسبتا بزرگ است، بنابراین ترجیح می دهد که با اتم کربنی که کمترین استخلاف را دارد، واکنش دهد. علاوه بر آن، مشابه گونه های باردار مثبت، گونه های رادیکالی زمانی پایدارتر هستند که الکترون جفت نشده در موقعیت با استخلاف بیشتر قرار گیرد. در واقع، حد واسط رادیکال با پدیده هایپرکانژوگه، هایپر کانجوگیشن و یا فوق مزدوج شدن (Hyperconjucation) تثبیت می شود. جالب است بدانید که در موقعیت پر استخلاف تر، پیوند های کربن- هیدروژن بیشتری با اوربیتال مولکولی رادیکال آزاد که کمبود الکترون دارد همسو می شوند. بنابراین اثرات فوق مزدوج شدن بیشتر خواهد بود و موقعیت مطلوب تر است.
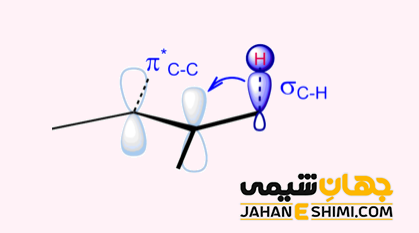
مثال هایی از واکنش های افزایشی مارکونیکوف
واکنش های افزایشی هیدروژن هالید ها
در واقع، آلکن ها به وسیله هیدروژن کلرید (HCl)، هیدروژن برمید (HBr) و یا هیدروژن یدید (HI) به آلکیل هالید مربوطه تبدیل می شوند. توجه داشته باشید که آلکن ها با سرعت بسیار کمی با هیدروژن کلرید واکنش می دهند. برای انجام واکنش، اغلب از عبور مستقیم گاز خشک هیدروژن هالید از آلکن مربوطه بهره می برند. البته لازم به ذکر است که گاهی نیز از یک حلال با قطبیت متوسط (مانند استیک اسید) نیز استفاده می شود. اسید استیک می تواند هیدروژن هالید قطبی و آلکن غیر قطبی را حل کند. در این واکنش، آلکن به آلکیل هالید تبدیل می شود. اتم هیدروژن به یکی از کربن های پیوند دو گانه و اتم هالوژن نیز به کربن دیگر بر طبق قانون مارکونیکوف متصل می شوند.
به عنوان مثال در واکنش افزایشی اسید پروتونی به ایزوبوتیلن، اتم هیدروژن به اتم کربنی که از قبل دارای دو هیدروژن است اضافه می شود، نه به اتم کربنی که هیچ هیدروژنی ندارد. هالوژن نیز ترجیح می دهد با کربنی که هیچ هیدروژنی به آن متصل نیست پیوند دهد.
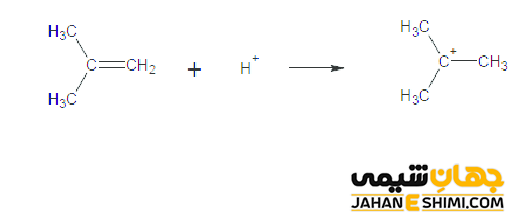
همانطور که بیان شد قانون مارکونیکوف درباره آلکن های نامتقارن صدق می کند و می تواند محصول اصلی را پیش بینی کند. مثلا در مولکول ۲- پنتن، هر دو کربن متصل به پیوند دوگانه حاوی تنها یک هیدروژن هستند. بنابراین بر طبق قاعده مارکونیکوف انتظار دارید که هیچ کدام از محصولات غالب نباشند. در حقیقت پیش بینی صحیح خواهد بود و می توان گفت مقادیر مساوی از دو ایزومر به طور واقعی به دست میآیند.
واکنش های افزایشی هیدراتاسیون
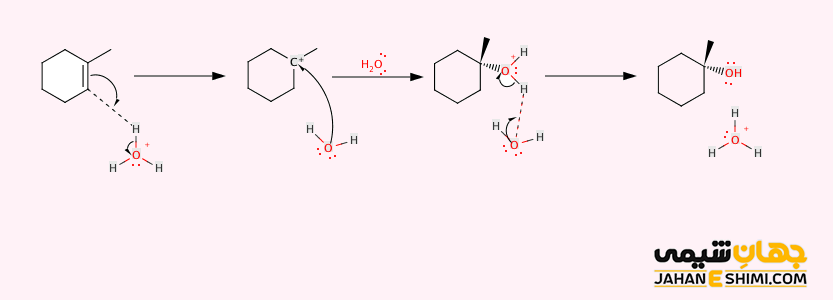
جالب است بدانید که قانون مارکونیکوف در واکنش آلکن نامتقارن با آب جهت تشکیل الکل نیز صادق است. در طی این واکنش، گروه هیدروکسیل (OH) به اتم کربنی که تعداد پیوند های کربن- کربن بیشتری دارد، پیوند می زند. در حالیکه اتم هیدروژن به اتم کربن در انتهای دیگر پیوند دوگانه، که در حقیقت پیوند های کربن- هیدروژن بیشتری دارد، متصل می شود.
مکانیسم واکنش به این صورت است که گروه هیدروکسیل به یک کربن پیوند دوگانه متصل می شود. در این صورت، یک پروتون (+H) نیز به کربن دیگر پیوند دوگانه اضافه می شود. واکنش فوق بسیار گرمازا می باشد. در مرحله اول، آلکن به عنوان یک هسته دوست عمل نموده و با پیروی از قانون مارکونیکوف، به پروتون حمله می کند. در مرحله دوم، یک مولکول آب به اتم کربن دیگر که استخلاف بیشتری دارد متصل می شود. اتم اکسیژن در اینجا دارای سه پیوند شیمیایی بوده و حامل بار مثبت است (یون اکسونیوم). یک مولکول آب دیگر می آید و پروتون اضافی را می گیرد. جالب است بدانید که این واکنش تمایل به تولید بسیاری از محصولات جانبی نامطلوب دارد.