در شیمی آلی، واکنش افزایشی (Addition reaction) به واکنش شیمیایی گفته می شود که در آن، دو یا چند مولکول ساده، با یکدیگر ترکیب شده و یک مولکول بزرگتر را تشکیل دهند. توجه داشته باشید که واکنش افزایشی تنها در مولکول هایی انجام می گیرد که پیوند های شیمیایی دوگانه (مانند آلکن ها) و یا سه گانه (مانند آلکین ها) داشته باشند. علاوه بر نمونه های ذکر شده، مولکول هایی که دارای پیوند دوگانه در کربن– اکسیژن (مانند گروه عاملی کربونیل (C=O)) و یا پیوند دوگانه کربن- نیتروژن (در گروه عاملی ایمین (C=N)) باشند، نیز می توانند در واکنش افزایشی شرکت کنند. در ادامه این مقاله در نشریه جهان شیمی فیزیک به بررسی واکنش افزایشی و انواع مختلف آن پرداخته می شود. لطفا با ما همراه باشید.
واکنش افزایشی چیست؟
همانطور که بیان شد، در طی یک واکنش افزایشی، با ترکیب دو یا چند مولکول، ترکیب پیچیده تری تشکیل می شود. از جمله واکنش های افزایشی، می توان به واکنش هیدروکربن های سیر نشده با هیدروژن (هیدروژناسیون)، هالوژن ها (هالوژناسیون)، هیدروژن هالید ها (هیدروهالوژناسیون) و همچنین سایر واکنشگر ها اشاره کرد. در واقع می توان گفت که معمولی ترین تبدیل شیمیایی یک پیوند دوگانه کربن- کربن، واکنش افزایشی خواهد بود. واکنش افزایشی در حقیقت عکس واکنش حذفی است. به عنوان مثال، هیدروژناسیون (افزایش هیدروژن) یک آلکن و تبدیل آن به یک الکل با فرآیند دهیدروژناسیون (هیدروژن گیری، دهیدروژن زدایی یا کم آبی الکل ها) معکوس می شود. واکنش دهیدروژن زدایی الکل ها، یک واکنش حذفی است.
واکنش افزایشی اغلب برای اشباع کردن هیدروکربن ها بکار می رود. در واقع باعث تغییر از حالت سیر نشده یا غیر اشباع، به حالت سیر شده یا اشباع می شود. در طی این واکنش، تعداد پیوند های دوگانه و یا سه گانه کاهش پیدا می کند.
انواع مختلف واکنش های افزایشی
به طور کلی، دو دسته واکنش افزایشی وجود دارد، واکنش های افزایشی قطبی (polar addition reactions) و ناقطبی (non-polar addition reactions). دو نوع اصلی از واکنش های افزایشی قطبی عبارتند از: واکنش افزایشی الکترون دوستی یا الکتروفیلی (Electrophilic addition) و واکنش افزایشی هسته دوستی یا نوکلئوفیلی (Nucleophilic addition). دو نوع واکنش افزایشی غیر قطبی نیز وجود دارد که به آنها واکنش افزایشی رادیکال آزاد (Free-radical addition) و واکنش افزایشی حلقه زایی (cycloaddition) می گویند. مکانیسم افزایشی در پلیمریزاسیون ها نیز مشاهده می شود که پلیمریزاسیون افزایشی (addition polymerization) نامیده می شود.
واکنش افزایشی الکترون دوستی (الکتروفیلی)
در این نوع از واکنش ها، پیوند پای ترکیبات آلی در اثر انجام واکنش شکسته شده و دو پیوند جدید سیگما ایجاد می گردد. بنابراین همانطور که مشخص است، برای انجام این واکنش، وجود پیوند دوگانه و یا سه گانه الزامی است. نیروی محرکه انجام این واکنش شیمیایی، تشکیل یک الکتروفیل +X است که می تواند یک پیوند کووالانسی با پیوند دوگانه غنی از الکترون و غیر اشباع، کربن- کربن تشکیل دهد. بار مثبت روی اتم X به پیوند پای کربن- کربن منتقل می شود. در نتیجه با تشکیل پیوند کووالانسی C-X، یک کربوکاتیون نیز تشکیل می گردد.
در مرحله بعدی یک واکنش افزایش الکتروفیلی، بار مثبت ماده واسطه، با گونه غنی از الکترون ترکیب می شود تا پیوند کووالانسی دوم را تشکیل دهد. مرحله دوم در واقع همان فرآیند حمله هسته دوستی است که در واکنش SN۱ نیز یافت می شود. ماهیت دقیق الکتروفیل و ماهیت واسطه با بار مثبت همیشه مشخص نیست و به واکنش دهنده ها و همچنین شرایط واکنش بستگی دارد.
لازم به ذکر است که در واکنش های افزایشی به آلکن های نا متقارن، گزینش پذیری (regioselectivity) موقعیت دو اتم کربن مهم است و اغلب به وسیله قانون مارکونیکوف (Markovnikov’s Rule) تعیین می شود. دقت داشته باشید که ترکیبات بور یا ارگانوبوران ها (Organoborane)، محصولات افزایشی آنتی (ضد) مارکونیکوف را ایجاد می کنند.
قانون مارکونیکوف
بر طبق قانون مارکونیکوف، وقتی که ترکیبی مثل (HX) می خواهد به آلکن نامتقارن اضافه شود، هیدروژن اسیدی به اتم کربنی اضافه می گردد که هیدروژن پیوند شده بیش تری داشته باشد. به عبارت دیگر، این قانون تشکیل کربوکاتیون پایدارتر را در اولویت خود قرار می دهد. به عنوان نمونه به اضافه شدن پی در پی HBr و HCl به آلکین نامتقارن زیر توجه کنید.
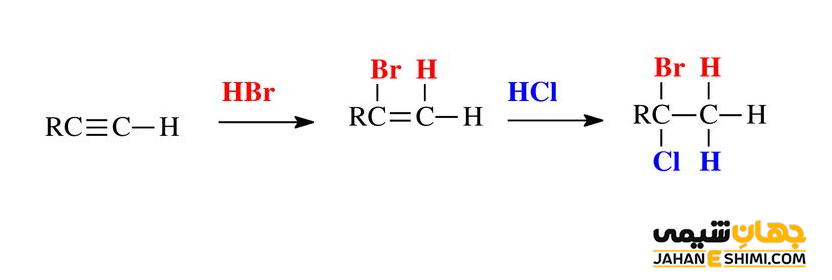
در مثال بالا، هیدروژن اسیدی مولکول HBr، به اتم کربن گروه CH متصل می شود. زیرا گروه CH، هیدروژن بیش تری نسبت به گروه CR دارد. در مرحله دوم نیز، هیدروژن اسیدی مولکول HCl نیز به اتم کربن گروه CH۲ متصل می شود، زیرا دوباره هیدروژن بیش تری نسبت به گروه CRBr دارد. دقت داشته باشید که در قانون مارکونیکوف، تنها هیدروژن های متصل به کربن های درگیر در پیوند دوگانه یا سه گانه را در نظر می گیریم.
انواع مختلف افزایش الکترون دوستی آلکن ها
واکنش های افزایشی هالوژن ها (X۲)
در طی واکنش هالوژناسیون (Halogen addition reactions) یک مولکول هالوژن (برم و کلر) به پیوند دوگانه کربن- کربن در گروه عاملی آلکن اضافه می شود. دقت داشته باشید که از لحاظ ترمودینامیکی، واکنش مولکول ید به خاطر اندازه اتمی بزرگش، بسیار آهسته و مولکول فلوئور نیز به خاطر اندازه اتمی بسیار کوچکش بسیار انفجاری و شدید خواهد بود. لازم به ذکر است که برای این واکنش باید فضا گزینی (Stereoselectivity) را در نظر گرفت، اما به صورت جهت گزین انجام نمی شود. حلال های خنثی، همچون CH۲Cl۲ یا CCl۴ برای این نوع از واکنش های هالوژناسیون الکتروفیلی مورد استفاده قرار می گیرند. به عنوان مثال، در ادامه واکنش اتیلن با یک مولکول برم را مشاهده می کنید.

واکنش های افزایشی هیدروژن هالید ها (HX)
واکنش هیدروهالوژن دار کردن یا هیدروهالوژناسیون (Hydrohalogenations) واکنشی است که در طی آن، تمامی آلکن ها با هیدروژن هالید ها (اسید های هیدرو هالیکی همچون هیدروژن کلرید یا هیدروژن برومید) در واکنش افزایشی شرکت می کنند. فرآورده این واکنش، هالوآلکان های مربوطه است. توجه داشته باشید که بر طبق قانون مارکونیکوف، اگر آلکن نامتقارن باشد، هالوژن ترجیح می دهد با کربنی که کمترین تعداد هیدروژن به آن متصل باشد پیوند می دهد.
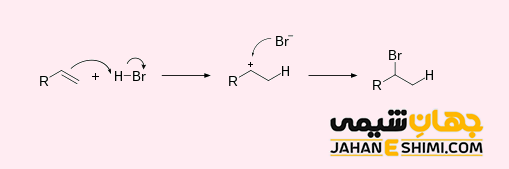
واکنش های افزایشی هیدروژناسیون (H۲)
واکنش هیدروژناسیون (Hydrogenation) واکنشی است که در طی آن، آلکن ها با گاز هیدروژن در حضور کاتالیست مناسب همچون نیکل، پالادیوم و پلاتینیوم در واکنش افزایشی شرکت می کنند. این واکنش اغلب به منظور اشباع کردن هیدروکربن ها بکار می رود. به عبارت دیگر، با انجام این واکنش، تعداد پیوند های دوگانه یا سه گانه کاهش پیدا می کند.
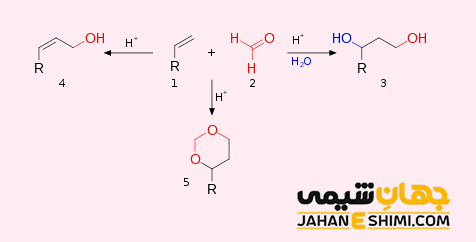
واکنش افزایشی هیدراتاسیون (H۲O)
در طی واکنش هیدراتاسیون (Hydration reactions)، یک گروه هیدروکسیل (–OH) و یک کاتیون (پروتون اسیدی) به پیوند دوگانه کربن- کربن در گروه عاملی آلکن اضافه می شوند. این واکنش به صورت صنعتی برای تولید ترکیباتی مثل اتانول، ایزوپروپانول و بوتان-۲-اول استفاده می شود.
RRC=CH۲ in H۲O / acid → RRC (OH) – CH۳
واکنشهای افزایشی اکسی جیوه دار کردن
واکنش اکسی جیوه دار کردن یا اکسی مرکوریشن (oxymercuration reaction) واکنشی است که در طی آن، آلکن با جیوه استات (AcO–Hg–OAc) در محلول آبی در واکنش افزایشی شرکت می کند. فرآورده این واکنش، الکل خنثی است. در واقع، یک گروه استوکسی جیوه (HgOAc) و یک گروه هیدروکسیل (–OH) در دو طرف پیوند دوگانه شکسته شده، اضافه می شوند.

واکنش هیدروبوراسیون- اکسیداسیون
واکنش افزایشی هیدروبوراسیون- اکسیداسیون یا واکنش هیدروبوردار کردن- اکسید کردن (Hydroboration–oxidation reaction) به واکنشی گفته می شود که در طی آن، یک اتم هیدروژن و یک گروه هیدروکسیل (–OH) به صورت سین به پیوند دوگانه گروه عاملی آلکن اضافه می شوند. این واکنش در حقیقت یک واکنش آنتی مارکونیکوف است. به بیان دیگر، هیدروژن به اتم کربنی اضافه می گردد که هیدروژن پیوند شده کمتری داشته باشد. دقت داشته باشید که در طی این واکنش افزایشی، یک آلکن به الکل تبدیل می گردد.
واکنش پرینس
در طی واکنش افزایشی پرینس (Prins reaction)، یک کتون یا آلدئید به پیوند دوگانه کربن- کربن در گروه عاملی آلکن یا آلکین طی جذب یک هسته دوست یا حذف یک پروتون (+H) اضافه می شود. لازم به ذکر است که محصول واکنش به شرایط واکنش بستگی دارد. به بیان دیگر، فرآورده نهایی بدست آمده با توجه به نوع واکنش دهنده ها می تواند متفاوت باشد.
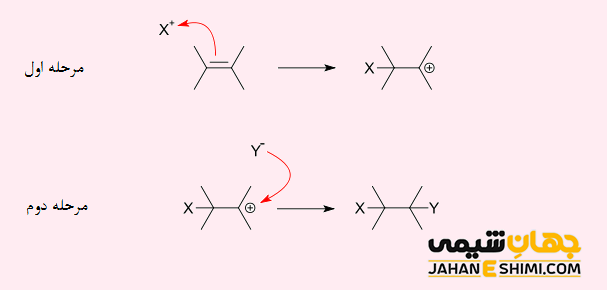
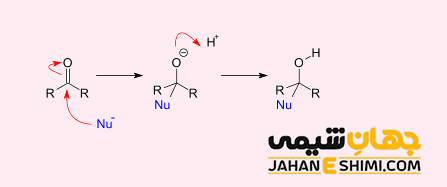
واکنش افزایشی هسته دوستی (نوکلئوفیلی)
واکنش افزایشی نوکلئوفیلی به واکنشی گفته می شود که در طی آن، ترکیب شیمیایی با پیوند دوگانه یا سه گانه، با یک هسته دوست غنی از الکترون واکنش دهد. به طوریکه در طی این فرآیند، پیوند دو گانه یا سه گانه شکسته می شود.
گروه های عاملی کربونیل (C=O) و ایزوسیانید (CN) نیز می توانند در این واکنش افزایشی شرکت کنند و تنوع زیادی را نشان دهند. لازم به ذکر است که این نوع از پیوند های کووالانسی، قطبی اند (تفاوت زیادی در الکترونگاتیویته بین دو اتم درگیر در پیوند وجود دارد). در نتیجه، اتم های کربن این پیوند ها، دارای بار مثبت جزئی هستند. این باعث می شود که مولکول یک الکتروفیل و اتم کربن مرکز الکتروفیل آن باشد. بنابراین، این اتم هدف اولیه برای هسته دوست خواهد بود.
دقت داشته باشید که نیروی محرکه برای افزایش به گروه عاملی آلکن ها، تشکیل یک هسته دوست –X می باشد. در واقع این هسته دوست در مرحله، یک پیوند کووالانسی با یک سیستم غیر اشباع فقیر از الکترون (-C=C-) تشکیل می دهد. بار منفی اتم X به پیوند دوگانه کربن- کربن منتقل می شود. در مرحله ۲ کربانیون با بار منفی با اتم Y که از نظر الکترونی ضعیف است ترکیب می شود و در نتیجه دومین پیوند کووالانسی را تشکیل می دهد.
واکنش افزایشی رادیکال آزاد
واکنش افزایشی رادیکال آزاد به واکنشی گفته می شود که دارای رادیکال آزاد باشد. توجه داشته باشید که ممکن است این واکنش شیمیایی بین یک رادیکال و غیر رادیکال، یا حتی بین دو رادیکال انجام شود. واکنش رادیکال آزاد به معرفی با پیوند ضعیف وابسته خواهد بود.
این واکنش طی سه مرحه صورت می گیرد. در مرحله اول، یک رادیکال آزاد با گرفتن انرژی فعال سازی مناسب از یک مولکول غیر رادیکالی ایجاد می شود. در مرحله دوم که مرحله انتشار زنجیره ای نام دارد، رادیکال های آزاد با یک غیر رادیکال برخورد کرده و با آن واکنش می دهند. بدین شکل، گونه رادیکال جدیدی ایجاد می گردد. این واکنش زنجیره ای تا مرحله ای ادامه پیدا می کند که دو رادیکال آزاد با یکدیگر بر خورد کرده و بدین صورت یک ترکیب غیر رادیکالی ایجاد کنند. این مرحله، در حقیقت مرحله پایانی واکنش خواهد بود.
واکنش حلقه زایی
واکنش افزایشی حلقه زایی واکنشی است که در طی آن، دو یا چند مولکول غیر اشباع (یا قسمت هایی از یک مولکول) به یکدیگر متصل شده و ترکیب حلقوی تشکیل می دهند. همان طور که بیان شد، این واکنش در دسته واکنش های افزایشی غیر قطبی قرار دارد. به عنوان مثال، واکنش دیلز-آلدر نمونه شناخته شده و مشهوری از این دسته واکنش ها محسوب می شود.
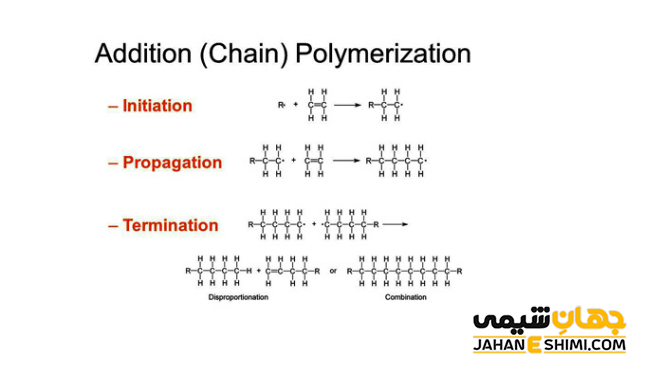
واکنش پلیمریزاسیون افزایشی
واکنش پلیمریزاسیون واکنشی است که در طی آن، مولکول های کوچک در یک فرآیند شیمیایی با یکدیگر پیوند شیمیایی می دهند. بدین شکل، زنجیره های پلیمری و یا شبکه های سه بعدی ساخته می شود. در واکنش پلیمری شدن افزایشی، واحد های مونومر بدون آنکه مولکولی را از دست بدهند، به یکدیگر متصل می شوند. به عبارت دیگر، هیچ محصول جانبی با جرم مولی پایین در طی فرآیند پلیمریزاسیون ایجاد نمی گردد. بنابراین، پلیمر تولید شده در این حالت، دارای واحد های تکرار شونده ای همچون مونومر های اولیه است.
در این روش از ترکیبات آلی که دارای پیوند دوگانه کربن- کربن می باشند، پلیمر تولید می کنند. مانند تولید پلی اتیلن (PE) از مونومر های اتیلن. پلیمر آکریلان نیز از مشتقات اتیلن محسوب می شود. منومر اولیه این پلیمر، سیانید ونیل (آکریکو نیتریل) است. همچنین پلی وینیل کلراید (PVC) نیز از پلیمری شدن کلرید وینیل (CH۲ ═ CHCl) تولید می شود. از جمله دیگر پلیمر های افزایشی می توان به پلی پروپیلن (PP)، پلی استایرن (PS)، پلی وینیل استات (PVAS)، پلی تترا فلوئورو اتیلن یا تفلون (PETFE)، همچنین بیشتر پلیمر های گرما نرم ها و تعدادی از گرما سخت ها اشاره کرد.