
عنصر ید (Iodine) با نماد شیمیایی I، یکی از عناصر شیمیایی جدول مندلیف است که عدد اتمی آن ۵۳ می باشد. این عنصر در حقیقت پنجاه و سومین عنصر از جدول تناوبی بوده که در گروه XVII و دوره پنجم جدول تناوبی قرار دارد. در واقع عنصر ید یک نافلز جامد و درخشان و به رنگ آبی- بنفش مایل به سیاه و از عناصر گروه هالوژن ها است. این فلز با عناصر فلوئور (F)، کلر (Cl)، برم (Br)، آستاتین (At) و تنسین (Ts)، در گروه هفده یا گروه هفت اصلی (VIIA) جدول تناوبی قرار گرفته است. در ادامه این مقاله در نشریه جهان شیمی فیزیک به بررسی عنصر ید پرداخته می شود. لطفا با ما همراه باشید.
فهرست مطالب این مقاله
۱- تاریخچه کشف عنصر ید
۲- پیدایش و منابع عنصر شماره ۵۳ جدول تناوبی
۳- ویژگی های فیزیکی و شیمیایی عنصر ید
۴- ایزوتوپ های عنصر ید
۵- کاربرد های عنصر ید
۶- ترکیبات عنصر ید
۷- خطرات ید بر روی سلامتی انسان
تاریخچه کشف عنصر ید
عنصر ید براي نخستین بار در سال ۱۸۱۱ میلادی، توسط شیمیدان فرانسوی به نام برنارد کورتوی (Bernard Courtois) در فرانسه کشف شد. یـد هم مثل بسیاری از ترکیبات دیگر به صورت اتفاقی کشف شده است. ارتش ناپلئون برای تهیه باروت به مقدار زیادی پتاسیم نیترات (برای تولید آن نیاز به سدیم کربنات بود) نیاز داشت. سدیم کربنات از خاکستر چوب بید تهیه می شد. با طول کشیدن جنگ و کاهش چوب درخت بید، پیشنهاد شد که از خاکستر جلبک دریایی برای تهیه باروت استفاده شود. در این روش، مقادیر زیادی ترکیبات گوگردی مزاحم وجود داشت که باعث آلودگی ظروف کار می شدند. از اسید سولفوریک برای تمیز کردن آنها استفاده می شد. یک روز به صورت اتفاقی، کورتیوس مقدار بیشتری اسید سولفوریک جهت تمیز کردن خمره پتاسیم نیترات، بکار برد.
در این هنگام یک بخار بنفش رنگی از ظرف خارج شد. زمانیکه این بخار بنفش رنگ با یک لوله سرد تماس پیدا می کرد به فرم کريستالی براق تبدیل می شد. کورتوی نمی دانست که این ماده یک عنصر جدید است یا خیر. از طرفی با تشدید جنگ، دیگر فرصت کافی برای تحقیق بیشتر بر روی این ماده شیمیایی مجهول را نداشت. بنابراین کورتوی مقداری از اين ماده ناشناخته را برای دانشمندان ديگری مانند چارلز- برنارد دسورمز، نیکولاس کلمنت، گیلوساک و آندره آمپر ارسال کرد. در نهایت گیلوساک در سال ۱۸۱۳ میلادی، مقاله ای منتشر کرد که این ماده ناشناخته را یک ماده جدید معرفی کرد. وی ید را به کمک واژه یونانی یودیس (Ioeides) به معنای رنگ بنفش نامگذاری کرد. لازم به ذکر است که در مشاجره بر سر کاشف عنصر یـد، گیلوساک و دیوی در نهایت برنارد کورتوی را کاشف این عنصر جدید و ناشناخته اعلام کردند.

پیدایش و منابع عنصر شماره ۵۳ جدول تناوبی
عنصر ید، کمیاب ترین هالوژن پایدار و غیر رادیواکتیو در طبیعت می باشد. این عنصر از نظر فراوانی در بین عناصر در پوسته زمین، در رده شصت و سومین قرار دارد. در واقع سنگین ترین عنصر در بین مواد مغذی معدنی است. هالوژن ها به خاطر انحلال پذیری زیاد در آب، معمولا در آب دریا بیشتر از خشکی ها وجود دارند. لازم به ذکر است که ید بسیار خالص را از واکنش یدید پتاسیم با سولفات مس می توان تهیه کرد. البته توجه داشته باشید که روش های دیگری نیز جهت جداسازی این عنصر وجود دارد.

ویژگی های فیزیکی و شیمیایی عنصر ید
عنصر ید، جامد درخشانی به رنگ آبی- بنفش مایل به سیاه می باشد. همانطور که بیان شد، ید عنصری غير فلزی از خانواده هالوژن ها است که بين عناصر برم و استاتين قرار دارد. يـد از نظر الکترونگاتيويته در میان هالوژن ها در رتبه آخر قرار می گیرد، پس شدت واکنش آن در مقايسه با عناصر فلور، کلر و برم کمتر خواهد بود. به بیان دیگر، واکنش مشخصه در هالوژن ها، واکنش مستقيم آنها با فلزات است. شدت اين واکنش در عنصر يـد در مقايسه با ديگر هالوژن ها کمتر می باشد، در نتیجه منجر به تشکيل يک جامد غير فرار مي شود. دقت داشته باشید که قدرت اکسيد کنندگي يـد از عنصر استاتين بيشتر است. به طور کلی می توان گفت که یـد در دمای معمولی اتاق نسبت به ديگر هالوژن ها، ايمنی بالاتری دارد.
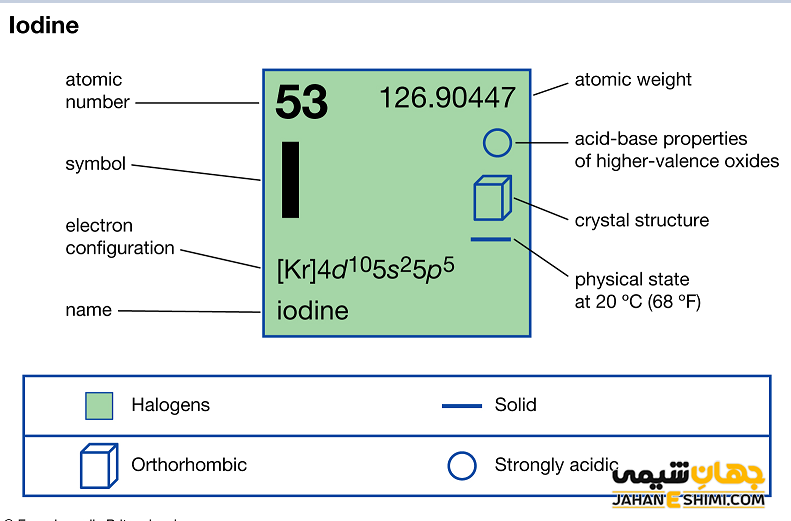
خصوصیات قابل توجه ید از ساختار اتمی آن ([۳۶Kr] 4d۱۰۵s۲۵p۵) ناشی می شود. همانطور که مشخص است، اوربیتال p لایه آخر در این عنصر در حال پر شدن است. این عنصر در اوربیتال p خود، دارای یک اوربیتال نیمه پر و دو اوربیتال پر است. با توجه به آرایش الکترونی آن مشخص می شود که هفت الکترون در دورترین لایه الکترونی ید وجود دارد. در نتیجه با توجه به ساختار الکترونی ید انتظار داریم که این عنصر یک الکترون گرفته و به حالت اکتت یا پایدار خود برسد. در حالیکه واکنش پذیری آن از تمام هالوژن ها کمتر است. در واقع الکترون دهنده ترین هالوژن شبه فلز (نافلز) محسوب می شود. پس حالت های اکسیداسیون ۱-، ۱+، ۳+، ۵+ و ۷+را خواهد داشت. دقت داشته باشید که حالت اکسايش ۴+ نيز در ترکيبي از ید ديده شده است.
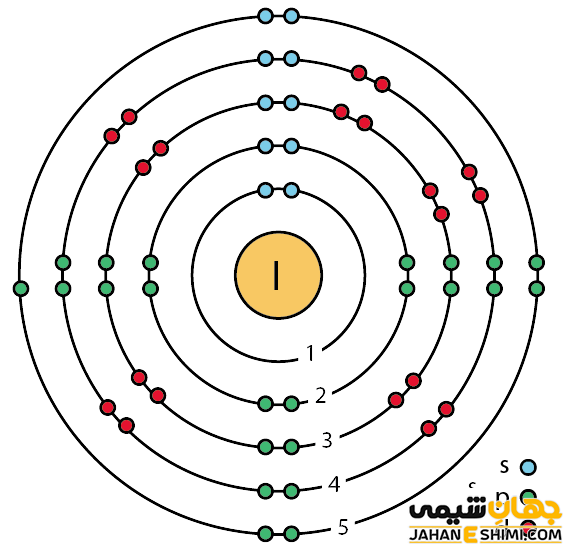
جالب است بدانید که
عنصر ید در دمای جوش خود به بخاری بد بو، بنفش رنگ و بسیار سمی تبدیل می گردد. بخار این عنصر در فشار پايين، فلورسانس از خود نشان مي دهد. اگر به وسيله نور خورشيد يا قوس الکتريکی روشن شود، نوري به رنگ سبز مايل به زرد ساطع می کند. عنصر شماره ۵۳ جدول تناوبی، علاقه زیادی به تشکیل زنجیر هایی با خود دارد. از این خاصیت می توان در ترکیبات آلی که شامل ید می باشند، به عنوان کاتالیزور بهره برد. به علاوه خواص اکسيداسيونی ملايمی نیز در برابر اسيد ها نشان مي دهد. لازم به ذکر است که بخار مرطوب یـد، می تواند اثر خورندگی بر روی فلزات و انواع استنلس استیل داشته باشد.
دقت داشته باشید که ید عنصری حل نشدنی است. این عنصر به میزان کمی در آب حل می شود. همچنین به راحتی در کلروفرم، کربن دی سولفید و کربن تتراکلرید حل شده و محلول های ارغوانی رنگ ایجاد می کند. از طرفی دیگر، با گاز های نجيب، گوگرد و یا سلنيم واکنش نمي دهد. بر خلاف کلر، يد نمی تواند واکنشی با ترکیبات مونوکسيد کربن، نيتريک اکسيد و يا دی اکسيد گوگرد انجام دهد. اما می تواند با برخي عناصر به طور مستقيم واکنش دهد. عناصری مثل کربن، نيتروژن، اکسيژن و تعدادی از فلزات بي اثر.
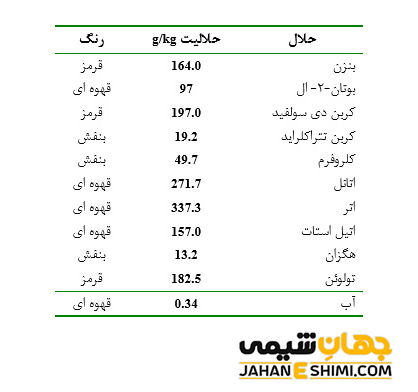
از دیگر ویژگی های عنصر شماره ۵۳ جدول تناوبی می توان به موارد زیر اشاره کرد.
- حالت فیزیکی آن در دمای ۲۵ درجه سلسیوس و فشار ۱ اتمسفر به صورت جامد است.
- دمای ذوب و دمای جوش این عنصر به ترتیب ۱۱۳.۷ و ۱۸۴.۳ درجه سانتی گراد است.
- عنصر ید دیا مغناطیس است.
- ساختار بلوری آن به شکل دستگاه بلوری راست لوزی یا اورتورومبیک (Orthorhombic)است.
- این عنصر آلوتروپ دارد. دی یدین (I۲) آلوتروپ آن است.
- جرم اتمی ید برابر با ۱۲۶.۹۰۴۴۷ g/mol است.
- چگالی آن نیز برابر با ۴.۹۳۳ g/cm۳ می باشد.
- شعاع اتمی آن نیز برابر با ۱۱۵ pm (140)می باشد.
- یون های ید معمولا عدد اکسایش برابر با اعداد -۱، ۰، +۱، +۳، +۴، +۵ ، +۶ و +۷ دارند. در حقیقت یک اکسید اسیدی قوی محسوب می شود. اعداد اکسایش -۱، ۰، +۱، +۳، +۵ و +۷ متداول تر می باشند.
- اولین انرژی یونیزاسیون آن برابر با ۱۰۰۸.۴ kJ/mol است.
ایزوتوپ های عنصر ید
همانطور که می دانید، ایزوتوپ های یک عنصر، در تعداد نوترون ها با یکدیگر تفاوت دارند. عنصر ید ایزوتوپ های فراوانی دارد. یدی که در طبیعت وجود دارد تنها دارای ایزوتوپ پایدار ۱۲۷I (100 %) می باشد. علاوه بر آن، ۳۷ ایزوتوپ پرتوزای ید نیز شناخته شده است. پایدارترین رادیوایزوتوپ ید ۱۲۹I با نیمه عمر ۷/۱۵ میلیون سال است. رادیو ایزوتوپ های این عنصر دارای جرم های ۱۰۸ تا ۱۴۴ می باشند، که اغلب به شکل مصنوعی تولید می شوند. در جدول زیر نیمه عمر تعدادی از ایزوتوپ های رادیواکتیو آن را مشاهده می کنید. ایزوتوپ های رادیواکتیو ید کاربرد های گسترده ای دارند. به عنوان مثال، ایزوتوپ پرتوزای دست ساز ۱۳۱I که دارای نیمه عمری برابر هشت روز است (ساطع کننده پرتوی بتا)، به منظور درمان سرطان و دیگر بیماری های غده تیروئید کاربرد دارد.
| نیمه عمر | ایزوتوپ |
| ۳/۶ دقیقه | I-122 |
| ۱۳/۲ ساعت | I-123 |
| ۴/۲ روز | I-124 |
| ۶۰/۱ روز | I-125 |
| ۱۳ روز | I-126 |
| ۲۵ دقیقه | I-128 |
| E7 1/57 سال | I-129 |
| ۱۲/۴ ساعت | I-130 |
| ۸ روز | I-131 |
| ۲/۳ ساعت | I-132 |
| ۲۰/۸ ساعت | I-133 |
| ۵۲/۶ دقیقه | I-134 |
| ۶/۶ ساعت | I-135 |
| ۱/۴ دقیقه | I-136 |
کاربرد های عنصر ید
ترکیبات شامل ید در ترکیبات آلی مهم و در علم پزشکی بسیار سودمند هستند. در واقع از یدید ها، پوویدون آیوداین (بتادین) و تیروکسین که دارای ید می باشند در پزشکی و در ترکیب با الکل (به عنوان تنتورید) برای ضد عفونی نمودن زخم های بیرونی استفاده می شود. در حقیقت دامنه و توانایی میکروب کشی ید بسیار گسترده است. این عنصر بر روی ویروس ها، قارچ ها، باکتری ها، اسپور ها و پروتوزوئا تاثیر دارد و می تواند آنها را تخریب و نابود نماید. دقت داشته باشید که تنتورید (از سه درصد ید عنصری در پایه آب/اتانول) یکی از مهمترین اجزا تمامی وسایل و ابزار کمک های اولیه است. این ماده هم جهت ضد عفونی کردن زخم ها و هم به منظور پاک سازی آب های آشامیدنی سطحی بکار می رود.
از ید همچنین در عکاسی (یدید پتاسیم) و رنگ به عنوان کاتالیزور و پیگمنت بهره می برند. به عنوان مثال، از یدید نقره به همراه نقره برمید (به خاطر حساسیت به نور) جهت بارور کردن ابر ها (باران مصنوعی) در صنعت ساخت فیلم و عکاسی استفاده می کنند. تری یدید نیتروژن ترکیبی بسیار ناپایدار است که در ساخت مواد انفجاری بکار می رود. علاوه بر آن، یدید تنگستن جهت افزایش روشنایی لامپ کاربرد دارد.
جالب است بدانید که
مقدار بسیار کم ید برای تمام موجودات زنده، لازم است. در واقع، این ماده معدنی برای سلامت تیروئید ضروری می باشد. هورمون های تیروئید (تیروکسین و تری یدوتیرونین) دارای اتم های ید هستند. تیروئید مسئول تنظیم هورمون ها، متابولیسم بدن، سلامت سیستم عصبی و سایر موارد است. ید همچنین مهم ترین عنصر برای رشد مغز انسان محسوب می شود. از فواید دیگر این عنصر در بدن می توان به موارد کمک به پروتئین سازی، حفظ انرژی بدن، حفظ استحکام ناخن ها، جلوگیری از پوسیدگی دندان ها، کمک به رشد استخوان ها و دندان ها، کمک به رشد بدن، جلوگیری از ابتلا به سرطان، تقویت مو، حفظ سلامت پوست، بهبود مشکلات روانی، افزایش نشاط روانی و کمک به سوزاندن چربی ها در رژیم های لاغری اشاره کرد.
لازم به ذکر است که عوارض کمبود این عنصر در بدن عبارتند از : ابتلا به بیماری گواتر، بروز مشکلات غده تیروئید، کم کاری تیروئید، ابتلا به کرتینیسم در نوزادان، ابتلا به میکزدم در کودکان و بزرگسالان، پف آلودگی صورت و دست ها، افزایش وزن بی دلیل، گیجی و کم حافظه شدن، تورم در گردن، ضعف و خستگی، ریزش مو، خشکی پوست، احساس سردی، تغییرات در ضربان قلب، حساسیت شدید به سرما، مشکل در یادگیری، پریود های نا منظم یا سنگین، اختلال عملکرد روانی و رشد فیزیکی و همچنین باعث مشکلات در دوران بارداری.
انسان ها در حالت عادي روزانه نياز به ۱۵۰ ميکرو گرم يد دارند. این مقدار مي تواند به وسیله نمک هاي يـد دار، تخم مرغ، محصولات لبنی (ماست و پنیر) و بعضی از غذا های گیاهی (آلو خشک و اسفناج) تامين شود. توجه داشته باشید که انواع غذا های دریایی (همچون میگو، ماهی مرکب، جلبک دریایی، انواع ماهی، ماهی تن و خرچنگ) سرشار از ید می باشند.

ترکیبات عنصر ید
یدید های سدیم و پتاسیم و همچنین اکسید ید یکی از معمول ترین ترکیبات ید محسوب می شوند. عنصر شماره ۵۳ جدول تناوبی همچنین می تواند به راحتی با کربن نیز واکنش دهد و در نتیجه ترکیبات آلی ید را ایجاد نماید. از دیگر ترکیبات آن می توان به موارد زیر اشاره کرد.
- یدید سدیم (NaI)
- یدید پتاسیم (KI)
- یدید نقره (AgI)
- یدید آلومینیوم (Al۲I۶)
- یدید تانتالیوم (Ta۲I۱۰)
- یدیت (KIO۳)
- نیتروژن ترییدید (NI۳)
- هیدرویدیک اسید (HI)

خطرات ید بر روی سلامتی انسان
عنصر ید در حالت آزاد بسیار سمی است. بنابراین تماس مستقیم آن با پوست بدن خطرناک می باشد. در واقع تماس مستقیم می تواند باعث آسیب و سوختگی های شیمیایی گردد. در حالیکه یون یدید سمیت بسیار کمی دارد، اما مصرف بیش از اندازه آن به بدن می تواند باعث بیماری یدیسم شود. از جمله علائم بیماری یدیسم می توان به اضطراب شدید، تپش قلب، تعریق زیاد، کاهش غیر عادی و شدید وزن اشاره کرد. علاوه بر آن، ید به شکل جامد یا بخار نیز به شدت سمی و خطرناک است. بخار ید سبب دردناک شدن چشم ها و غشاء مخاطی خواهد شد. تنفس بخار های ید در طولانی مدت حتی در مقادیر کم نیز می تواند برای غده تیروئید خطرناک و سرطان زا باشد.
لازم به ذکر است که از محلول های ضد عفونی کننده موضعی دارای ید (مانند پوویدون آیوداین)، برای زخم های عمیق و یا بیماران تحت درمان با دارو های لوو تیروکسین سدیم و لیتیوم کربنات نباید استفاده کرد. دقت داشته باشید که در هنگام کار با عنصر ید (عنصر شماره ۵۳ جدول تناوبی) باید از دستکش محافظ استفاده کنید. آزمایشات با آن به ویژه در زمان تصعید شدن، زیر هود هایی با ساکشن بالای آزمایشگاهی انجام شوند. بنابراین زمان کار با ید، بایستی بسیار احتیاط کرد.




















بالاخره ید حل شدنی است یا حل نشدنی؟
آیا این عنصر در نفت حل میشود؟
در روغن خوارکی چطور؟