
بازده درصدی (Percent Yield) در علم شیمی، معياری از میزان پيشرفت یک واکنش شیمیایی و همچنین معیاری جهت کارآمد بودن روش های سنتز محسوب می شود. در اغلب موارد و در بسیاری از واکنش های شیمیایی به منظور تهیه مواد شیمیایی به ویژه در صنعت، مقدار فرآورده های بدست آمده از واکنش مورد نظر، کمتر از مقدار محاسبه شده می باشد. در اینصورت، نیاز است تا بازده درصدی واکنش حساب گردد. جالب است بدانید که بازده درصدی، با اسامی بازده کسری و یا بازده نسبی نیز نامیده می شود. در این مقاله در نشریه جهان شیمی فیزیک، توضیحات بیشتری در رابطه با بازده درصدی و روش محاسبه آن ارائه شده است. لطفا همراهی بفرمایید.
بازده واکنش
راندمان واکنش در علم شیمی، به مقدار محصول تولیدی در طی یک واکنش شیمیایی گفته می شود. توجه داشته باشید که مقدار فرآورده بدست آمده در هر واکنش شیمیایی، معمولا کمتر از مقدار محصول پیش بینی شده و قابل انتظار با فرض كامل بودن واكنش است. دلایل مختلفی برای تفاوت در مقدار محصول وجود دارد که تعدادی از آنها به صورت خلاصه در زیر بیان شده است.
- تعداد زیادی از واکنش های شیمیایی به صورت کامل انجام نمی شوند. در واقع، تمام واکنش دهنده ها به محصول تبدیل نخواهند شد.
- احتمال دارد که دو و یا حتی چند واکنش شیمیایی به صورت همزمان انجام شوند. به بیان ساده تر، واکنش های جانبی در هنگام انجام واکنش شیمیایی اصلی رخ دهند. بنابراین، مقادیری از واکنش دهنده ها به محصولات نا خواسته تبدیل خواهند شد.
- خطا های فردی، خطا های آزمایشگاهی و همچنین خطا های اندازه گیری باعث می شوند که میزان فرآورده های مورد انتظار، در عمل بدست نیاید.
- در بسیاری از موارد، اشکال در جداسازی مواد از یکدیگر وجود دارد. به عبارت دیگر، در زمان جداسازی و یا خالص سازی فرآورده های واکنش از مخلوط واکنش، مواد شیمیایی از جمله فرآورده ها هدر می روند.
- وجود ناخالصی در واکنش دهنده ها نیز میتواند یک عامل مهم در کاهش بازده واکنش محسوب شود.
- وجود مواد زود جوش (برخی از مواد شیمیایی دمای جوش پایینی دارند) نیز می تواند سبب کاهش مقدار محصول مورد نظر شود.
- همچنین عدم امکان جمع آوری کامل محصولات واکنش نیز می تواند دلیل کاهش راندمان واکنش باشد.

انواع مختلف بازده واکنش
در هنگام بحث درباره بازده واکنش، با سه اصطلاح بازده نظری (Theoretical Yield)، بازده عملی یا بازده حقیقی (Actual Yield) و بازده درصدی مواجه می شوید. مقدار فرآورده هایی که از محاسبه استوکیومتری در یک واکنش شیمیایی، بدست می آید را مقدار نظری می گویند. به بیان دیگر، مقدار محصول نظری به مقدار فرآورده با فرض کامل بودن واکنش و همچنین بدون اتلاف واکنشگر ها به محصولات گفته می شود. در حالیکه، مقدار فرآورده هایی که در عمل تولید می شوند را مقدار عملی می گویند. همانطور که بیان شد، در بیشتر موارد، مقدار عملی از مقدار نظری کمتر خواهد بود. از طرفی دیگر، بازده درصدی یک واکنش شیمیایی نسبت دو بازده نظری و عملی به یکدیگر می باشد.

بازده درصدی
مقدار نسبی مواد اولیه و محصولاتی که در یک معادله شیمیایی موازنه شده وجود دارند را به عنوان مقادیر استوکیومتری (Stoichiometric Amounts) می نامند. در اغلب موارد، فرض بر این است که جهت محاسبات میزان فرآورده های تولید شده، تمامی مقادیر مورد نیاز مواد اولیه برای واکنش شیمیایی مورد نظر، با نسبت های استوکیومتری در دسترس می باشند. اما در عین حال، مواردی وجود دارد که واکنشدهنده ها با نسبت های استوکیومتری در واکنش حضور ندارند. بدین شکل، مقدار محصولات بدست آمده، کمتر از مقدار محاسبه شده است.
بیشتر واکنش های شیمیایی بازده ای کمتر از صد در صد خواهند داشت. لازم به ذکر است که شیمیدانان همیشه تلاش می کنند تا بازده کسری فرآیند های صنعتی و آزمایشگاهی را افزایش دهند. هرچه میزان خطای فردی و آزمایشگاهی کمتر باشد، بازده واکنش به صد نزدیک تر بوده و در نتیجه واکنش با کیفیت بهتری انجام شده است. بازده درصدی یک واکنش شیمیایی را می توان به کمک رابطه زیر تعیین کرد.
۱۰۰ × بازده نظری / بازده عملی = بازده درصدی
جالب است بدانید که بازده کسری واکنش به درصد خلوص شبیه است. اما توجه داشته باشید که درصد خلوص فقط برای مواد اولیه محاسبه می شود. در حالیکه، بازده درصدی واکنش تنها برای محصولات محاسبه می گردد. لازم به ذکر است که در معادله بالا، صورت و مخرج کسر، هر دو متعلق به یک ماده شیمیایی می باشند. همچنین، صورت و مخرج کسر فوق، یک نوع واحد خواهند داشت. بنابراین، واحد های ارائه شده، در صورت و مخرج معادله بازده نسبی در نهایت حذف می شوند. البته دقت داشته باشید که کمیت در این معادله می تواند متغیر باشد (یعنی گاهی جرم، گاهی مول، گاهی حجم و گاهی حجم مولی با یکدیگر مقایسه می شوند).
سوال مهم درباره بازده کسری
اگر بازده کسری یک واکنش شیمیایی خاص، ۳۰ درصد باشد، آیا می توان گفت که ۷۰ درصد مواد اولیه در ظرف واکنش باقی مانده اند یا نه؟ همانطور که بیان شد، یکی از دلایل بازده واکنش کمتر از صد، اینست که ماده اولیه، ناخالصی دارد. بنابراین زمانیکه بازده عملی ۳۰ % شده است، لزومی ندارد که حتما ۷۰ درصد باقیمانده در ظرف واکنش، ماده اولیه باشد. در عوض می توان گفت که ماده اولیه به همراه ناخالصی ها ۷۰ درصد را تشکیل داده اند.
به علاوه، اگر واکنش مورد بررسی، دو یا چند محصول داشته باشد که یکی از آنها، فرآورده مورد انتظار ماست، دیگری قطعا محصول فرعی خواهد بود. در این حالت، واکنشگر ها مصرف شده اند، اما تنها محصول اصلی بدست نیامده و همزمان محصول فرعی نیز تولید شده است. به عنوان مثال، اتانول به جای تولید اتیلن، می تواند اتر هم تولید کند. بنابراین، بازده درصدی کمتر خواهد بود و نمی توان به طور یقین گفت که ۷۰ درصد مواد اولیه در ظرف واکنش باقی مانده است.
محاسبه بازده نظری
مسائل مربوط به بازده کسری را می توان به سه گروه زیر تقسیم کرد.
گروه اول؛ مسائلی که در آنها، مقدار محصول عملی داده شده است و بازده کسری مورد سوال می باشد. در این مدل از سوالات، با توجه به مقدار ماده اولیه، مقدار محصول نظری تولید همان فرآورده را با همان واحد محاسبه می کنند. حال اگر دو واکنش دهنده در واکنش مورد نظر، وجود داشته باشد، واکنش دهنده محدود کننده را در نظر می گیرند. در نهایت و با توجه به معادله، بازده کسری واکنش بدست خواهد آمد.
گروه دوم؛ مسائلی که در آنها، بازده کسری واکنش مورد نظر داده شده است و مقدار محصول عملی باید محاسبه گردد. در این حالت و با توجه به روابط استوکیومتری، مقدار محصول نظری فرآورده مورد بررسی، محاسبه می شود. در نهایت و به کمک رابطه بازده کسری می توان مقدار مجهول را محاسبه نمود.
گروه سوم؛ مسائلی که در آنها هم مقدار محصول عملی و هم بازده کسری داده شده است و مقدار واکنش دهنده مورد سوال است. در این حالت، در ابتدا و به کمک معادله بازده درصدی، مقدار محصول نظری محاسبه می شود. در نهایت و با توجه به مقدار محصول نظری فرآورده مورد بررسی، مقدار واکنش دهنده لازم بدست می آید.

مثال
در صورتيكه از واكنش فسفر سفيد (P۴) با اكسيژن هوا، ۵۰ گرم P۴O۱۰ بدست آید، حداقل چند گرم فسفر سفيد بايد استفاده شود؟ توجه داشته باشید که بازده واكنش فوق ۶۰% است. (P۴ + ۵O۲ → P۴O۱۰)

روش های محاسبه بازده درصدی واکنش های شیمیایی
دو روش مختلف برای محاسبه بازده کسری وجود دارد که در ادامه مقاله به اختصار بیان می شوند. در روش اول که روش تناسب نامیده می شود، مقدار واکنش دهنده مورد نظر را در R/100 که همان بازده درصدی است، ضرب می کنند. دقت داشته باشید که هرچه مقدار آن کوچک تر باشد، نشان دهنده آنست که مقدار کمتری از مواد اولیه به محصولات قابل دسترس تبدیل شده اند. بنابراین، فرآورده کمتری بدست خواهد آمد.

در روش دوم می توان سه مرحله زیر را برای محاسبه بازده نسبی طی کرد.
- مرحله اول؛ پیدا کردن واکنش دهنده محدود کننده واکنش شیمیایی مورد نظر
- گام دوم؛ محاسبه بازده نظری واکنش به کمک مقدار واکنش دهنده محدود کننده
- مرحله سوم؛ محاسبه بازده درصدی واکنش به کمک رابطه
واکنش دهنده محدود کننده
در بیشتر واکنش های شیمیایی، مواد اولیه به اندازه نسبت های استوکیومتری در کنار یکدیگر قرار نمی گیرند. در حقیقت یکی از واکنش دهنده ها به میزان کمتر وجود دارد. به این واکنش دهنده که مقدار آن نسبت به مقدار استوکیومتری کمتر است، واکنش دهنده محدود کننده (Limiting Reactant) گفته می شود. این ماده اولیه در جریان واکنش شیمیایی زودتر مصرف می شود. در واقع، پیشرفت واکنش شیمیایی مورد نظر را با محدودیت روبرو می نماید. به طور مشابه، به ماده اولیه دیگر که به مقدار بیشتری در ظرف واکنش وجود دارد، واکنش دهنده اضافی (Excess Reactant) می گویند .پس از پایان واکنش، مقداری از واکنش دهنده اضافی در ظرف واکنش باقی می ماند.
محاسبه واکنش دهنده محدود کننده
در ابتدا داده های واکنش دهنده ها را به مول تبدیل می کنند. سپس، تعداد مول های واکنش دهنده ها را به ضریب همان واکنش دهنده تقسیم می نمایند. بدین شکل، کوچکترین عدد بدست آمده از مرحله قبل را به عنوان واکنش دهنده محدود کننده انتخاب می کنند. جالب است بدانید که قیمت یک ماده شیمیایی، در انتخاب واکنش دهنده محدود کننده بسیار اهمیت دارد. در صنعت، به منظور دست یابی به محصولات بیشتر، معمولا واکنش دهنده ارزان قیمت را به عنوان واکنش دهنده اضافی مورد استفاده قرار می دهند.
مثال
به منظور تولید آمونیاک، ۲۵ گرم نیتروژن با ۵ گرم هیدروژن واکنش می دهد. اولا حساب کنید که چند گرم آمونیاک بدست می آید؟ از کدام ماده شیمیایی و به چه مقدار در ظرف واکنش در نهایت باقی می ماند؟
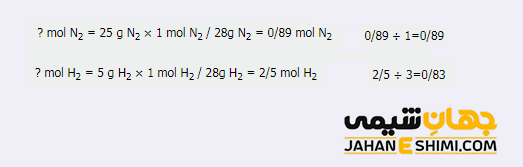
همانطور که مشخص است، هیدروژن، واکنش دهنده محدود کننده و نیتروژن، واکنش دهنده اضافی می باشند.
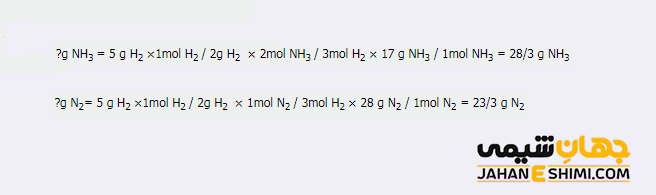
مقدار باقیمانده = مقدار اولیه – مقدار باقیمانده در ظرف
۲۵ – ۲۳/۳ = ۱/۷ g N۲



















