ترازهای انرژی در شیمی چیست؟ – مدل اتمی بور
ترازهای انرژی در شیمی یا لایه های الکترونی، مکانی را در اطراف هسته اتم نشان می دهند که احتمال حضور الکترون در آن بیشتر است. فاصله ای که ترازهای الکترونی از هسته دارند بر حسب پیکومتر بیان می شود. به طور کلی در تعریف لایه های الکترونی می توان گفت که مدارهایی در اطراف هسته اتم هستند که حضور الکترون ها در حوزه ی آن در اطراف هسته نشان می دهند. این لایه ها به ترتیب فاصله از هسته شماره گذاری می شوند. در این مقاله نشریه جهان شیمی فیزیک به بررسی ترازهای انرژی در شیمی می پردازیم.
با توجه به مکانیک کوانتومی، تراز انرژی به میزان معینی از انرژی گفته می شود که یک ذره یا سیستم می تواند دریافت کند. این موضوع در تضاد با مکانیک کلاسیک است. در این جا منظور از تراز انرژی، اشاره به الکترون های درون اتم است که در ناحیه الکتریکی هسته اتم قرار دارند.
مدل اتمی رادرفورد
با مطالعه روی ذرات زیراتمی، رادرفورد و همکارانش به ارائه مدلی پرداختند که به نام مدل سیاره ای نام گرفت. اوبیان کرد که اتم از هسته ای با بار مثبت تشکیل شده که الکترون ها با بار منفی به دور هسته در حال چرخش هستند. این مدل در سال ۱۹۱۱ ارائه شده و در آن، الکترون ها مانند گردش سیارات به دور خورشید، به دور هسته اتم در مدارهای مختلفی در چرخش بودند. مشکلی که در ارائه این مدل وجود داشت به دلیل باردار بودن ذره در حال چرخش به دور هسته اتم بود.

با توجه به نظریه الکترومغناطیسی کلاسیک، انرژی توسط ذره شتاب دار به صورت نور منتشر می شود. حرکت یک الکترون با سرعت ثابت به دور هسته، به دلیل تغییر مداوم جهت بردار سرعت، شتابدار است. به همین دلیل انتظار می رود که در مدل ارائه شده توسط رادرفورد، انرژی الکترون های در حال چرخش به طور مداوم باید انرژی از دست بدهند. در نتیجه با از دست دادن مداوم انرژی، الکترون روی هسته سقوط خواهد کرد. اما در واقعیت چنین نبوده و بر اساس فیزیک کلاسیک، مدل اتمی رادرفورد ناپایدار است.
مدل اتمی بور
بعد از مشکل ارائه شده در مدل اتمی رادرفورد، در سال ۱۹۱۳ نیلز بور به بیان کمی سازی انرژی برای هیدروژن پرداخته و به حل این مسئله کمک کرد. در مدل اتمی بور الکترون ها به دور هسته، در مسیرهای ثابتی به نام اوربیتال در حال چرخش هستند. در این مدل، هسته دارای بار الکتریکی مثبت بوده و الکترون ها با بار منفی روی سطوح انرژی ثابتی در حال چرخش هستند. بور اظهار داشت که الکترون هایی که در مدارهای دورتر هستند، دارای میزان انرژی بیشتر بوده ولی الکترون های نزدیک به هسته، دارای مقدار انرژی کمتری هستند.
فرضیات ارائه شده در مدل اتمی بور و ترازهای انرژی در شیمی
در این مدل اولا بور اظهار داشت که حرکت الکترون ها در مسیرهای دایره ای ثابتی در اطراف هسته است که تحت نام اوربیتال قرار دارند. دوم این که الکترون ها در این مسیرهای ثابت دارای مقدار انرژی ثابتی هستند. یک پوسته یا لایه از چند اوربیتال تشکیل شده و هیچ انرژی از الکترون ها تا زمانی که در مسیر خود در حال حرکت هستند، تابش نمی شود.
هر کدام از سطوح انرژی در این مدل اتمی با n نمایش داده شده و به ترتیب نزدیکی به هسته اتم با اعداد ۱،۲،۳،… نام گذاری می شوند. این اعداد که به نام اعداد کوانتومی نامیده می شوند، مقداری صحیح هستند.
فرضیه چهارمی که توسط بور بیان شد این بود که با تغییر سطح انرژی در اتم، تغییرات انرژی در یک الکترون را خواهیم داشت. وقتی جابجایی الکترون از تراز پایین تر به تراز انرژی بالاتر انجام می شود، الکترون انرژی جذب می کند. اما با از دست دادن انرژی توسط الکترون، سطح انرژی آن نیز کاهش پیدا می کند.
بور بیان کرد که تعدادی لایه یا پوسته انرژی در اطراف هسته هر اتم وجود دارد که هر کدام از آن ها متشکل از چندین زیرپوسته (اوربیتال) هستند.
محدودیت های مدل اتمی بور
در مدل اتمی که توسط بور ارائه شد، محدودیت هایی وجود داشت. یکی از معایب این مدل، عدم توجیه اثر زیمان که همان تاثیر میدان مغناطیسی بر طیف اتمی عناصر است، بود. همچنین این مدل نمی توانست اصل عدم قطعیت هایزنبرگ را توجیه کند و این اصل را نقص می کرد. سومین نقض مدل اتمی بور، عدم توانایی در توصیف طیف اتم های بزرگ تر بود.
ترازهای انرژی در شیمی چیست؟
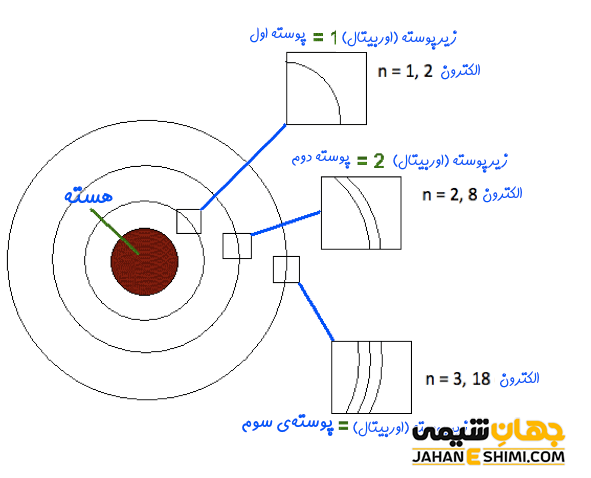
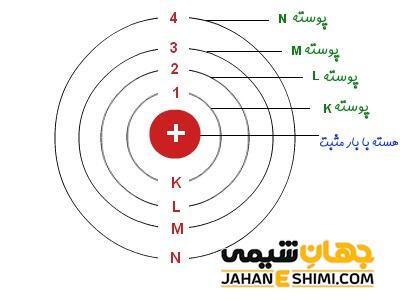
بعد از بیان مدل اتمی بور، مفهوم ترازهای انرژی در شیمی بیان شد. ترازهای انرژی در شیمی به مدارهایی گفته می شود که احتمال حضور الکترون در آن ها در اطراف هسته بالاست. فاصله ی هر کدام از لایه ها بر حسب پیکومتر بیان شده و تعداد این لایه ها در اتم های مختلف می تواند بین ۱ تا ۷ لایه باشد. با n لایه الکترونی را نشان می دهند. لایه n = 1 که همان پوسته اول است با نماد K نمایش داده می شود. لایه n = 2 همان پوسته دوم (سطح انرژی دوم) بوده و با نماد L نشان داده می شود. به همین ترتیب لایه های سوم و چهارم نیز با نمادهای M و N نمایش داده می شوند.
تعداد الکترون ها در ترازهای انرژی در شیمی
تعداد الکترون ها در هر کدام از این لایه ها، ثابت بوده و بر حسب فرمول ۲n۲ بیان می شود که n همان لایه الکترونی مورد نظر و عدد کوانتومی است. به عنوان مثال تعداد الکترون ها در لایه شماره ۱، بر طبق این فرمول برابر ۲ خواهد بود. همچنین، لایه دوم تعداد ۸ الکترون را می تواند در خود جای دهد. به همین ترتیب ترازهای n = 3 و n = 4 نیز به ترتیب تعداد ۱۸ و ۳۲ الکترون را می توانند در خود جای دهند. همچنین با دور شدن از هسته اتم ها، مقدار انرژی تراز زیاد شده و در لایه های نزدیک تر، میزان انرژی در آن ها کمتر خواهد بود. به عبارتی با افزایش n، مقدار انرژی تراز انرژی بیشتر شده و در فاصله دورتری از هسته قرار خواهد داشت.
مفهوم ترازهای انرژی در شیمی
به انرژی پتانسیل الکترون در فاصله های مختلف، تراز انرژی می گویند و بر حسب الکترون ولت بیان می شود. دو عامل بار هسته و فاصله الکترون از هسته در میزان انرژی پتانسیل موثر هستند.
با دور شدن از هسته اتم، شعاع الکترونی زیاد شده و فاصله میان لایه ها نیز زیاد می شود. به عنوان مثال در مقایسه فاصله بین لایه های سوم و چهارم نسبت به لایه های سوم و دوم، ۷a در مقابل ۵a است. اما هر چه از هسته دورتر می شویم، فاصله ای که بین ترازهای انرژی وجود دارد، کم می شود. به عبارتی می توان گفت که نزدیک شدن انرژی لایه ها را به هم با دور شدن از هسته داریم. در نتیجه رابطه ای مستقیم بین شعاع لایه ها و فاصله بین لایه های الکترونی وجود دارد. n بزرگتر یعنی شعاع بیشتر و بیشتر شدن فاصله بین لایه ها است.
اما وقتی شعاع الکترونی در نتیجه بزرگ شدن n، بزرگتر شود، الکترون به دلیل احساس جاذبه کمتری از سمت هسته اتم، میزان پایداری کمتری خواهد داشت. اما رابطه معکوسی بین پایداری یک ذره با میزان سطح انرژی آن وجود خواهد داشت. الکترون های نزدیک تر به هسته پایدارتر از الکترون هایی هستند که در فاصله دورتری از هسته قرار دارند.
مفهوم برانگیختگی در اتم
در مدل اتمی بور، الکترون ها متعلق به تراز انرژی مشخصی بوده و میزان انرژی در آن ها کوانتیزه است. به عبارتی یک الکترون نمی تواند هرگز بین دو تراز انرژی قرار گیرد. به تراز انرژی که الکترون ها در حالت عادی در آن قرار دارند، تراز پایه گفته می شود. اگر انتقال الکترون به تراز بالاتر انجام شود، به آن تراز برانگیخته گفته می شود.
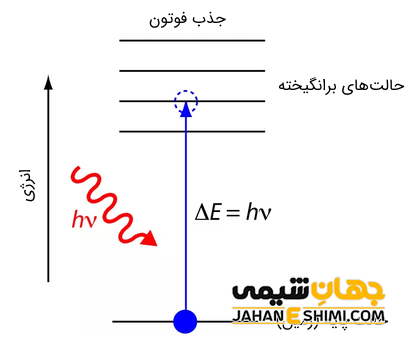
در حالت پایه، الکترون ها دارای کمترین حد انرژی خود هستند و گذار آن ها از این حالت به حالت برانگیخته، با گرفتن انرژی توسط این الکترون ها امکان پذیر خواهد بود. میزان انرژی که الکترون ها جذب می کنند برابر با اختلاف انرژی بین دو تراز است. اما الکترون ها به طور خود به خودی تمایلی ندارند که انرژی جذب کنند و در پایدارترین حالت خود قرار دارند که انرژی کمی دارند. مقدار انرژی جذب شده همان تراز کوانتوم انرژی یا همان فوتون است. تولید یک فوتون نوری با فرکانس v است.
E upper – Elower = hv
اما در حالت برانگیخته، الکترون ها در ترازهای بالاتر از تراز پایه قرار گرفته و تنها با گسیل فوتون می توانند به تراز پایه منتقل شوند. در این حالت یک موج الکترومغناطیسی تشکیل می شود. طول عمر تراز برانگیخته به دلیل ناپایداری و تمایل به قرارگیری در تراز پایین تر، کوتاه تر از تراز پایه است. فوتون صورتی است که کوانتای انرژی در تراز برانگیخته آزاد می کند. یک اتم می تواند چند تراز برانگیخته داشته باشد که نزدیکترین به هسته به عنوان اولین تراز برانگیخته خواهد بود.
اعداد کوانتومی
برای توصیف الکترون های یک اتم و همچنین بیان موقعیت آن ها از چهار عدد به نام های عدد کوانتومی اصلی (n)، عدد کوانتومی فرعی یا اوربیتال (L)، عدد کوانتومی مغناطیسی (m) و عدد کوانتومی مغناطیسی اسپینی (s) توسط شرودینگر استفاده شد.
با عدد کوانتومی اصلی، اندازه و انرژی اوربیتال نشان داده می شود. با زیاد بودن فاصله الکترون ها از هسته، عدد کوانتومی اصلی بزرگتر بوده و اندازه و انرژی اوربیتال نیز بزرگ خواهد بود. الکترون های با مقدار عددی n یکسان با یک فاصله از هسته قرار گرفتند.
شکل اوربیتال ها با یک عدد کوانتومی فرعی نشان داده می شوند که برای هر n، تعداد n-1 اوربیتال وجود دارد. نمادهای نشان دهنده شکل های اوربیتال ها، s با L = 0، p با L = 1، d با L = 2، f با L = 3 و … هستند. اوربیتال s به شکل دایره ای و اوربیتال p به شکل دمبلی در جهت های مختلف است. اوربیتال های d و f نیز دارای شکل های مختلفی هستند.
سومین عدد کوانتومی به نام عدد کوانتومی مغناطیسی است که جهت گیری اوربیتال ها را در فضا نشان می دهد. این برای یک اوربیتال بین دو عدد –L و +L قرار دارد. به عنوان مثال برای اوربیتال p که دارای L = 1 است، عدد کوانتومی مغناطیسی برابر با ۱+، ۰، ۱- است.
با توجه به این که الکترون به دور هسته خود نیز در حال چرخش است، عدد کوانتومی چهارمی به نام عدد اسپینی نیز برای آن تعریف می شود. هر الکترون می تواند به دو صورت ساعتگرد و پاد ساعتگرد حرکت کند.



















