نظریه اتمی – از نظریه دالتون تا نظریه شرودینگر
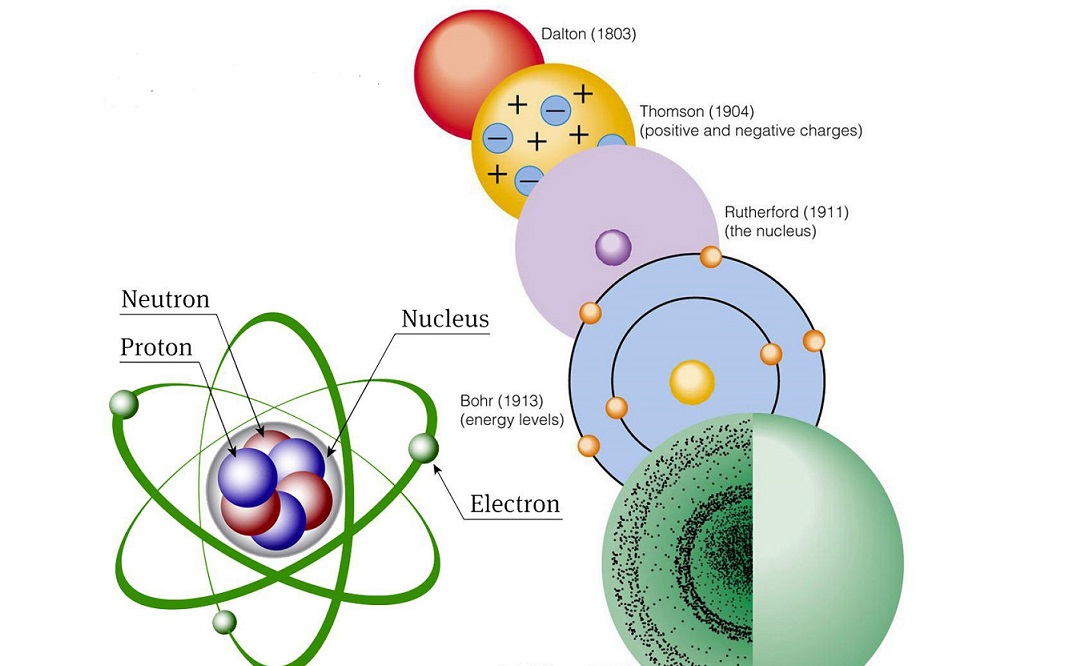
سنگ بنای شیمی را می توان نظریه اتمی دانست. اینکه اتم چیست و چه شکلی دارد و اتم ها چه رفتاری در مقابل هم از خود نشان می دهند اساس و پایه درک علم شیمی است. جان دالتون اولین کسی بود که نظریه اتمی را مطرح کرد.

به مرور شیمیدان های دیگری (تامسون، رادرفورد، بور، شرودینگر) نظریه های کامل تری ارائه دادند تا اینکه مدل اتمی به شکل کنونی ارائه شد. دالتون برای بیان نظریه خود از دو نظریه قانون پایستگی جرم و قانون نسبت های معین بهره گرفته است. در این نشریه جهان شیمی فیزیک به بیان نظریه های مختلف اتمی و تکامل آن می پردازیم.
تاریخچه پیدایش نظریه اتمی
پیدایش معنا و مفهوم اتم ۴۰۰ سال پیش توسط دموکریت، دانشمند یونانی برای اولین بار مطرح کرد. بر طبق نظر او مواد از ذرات بسیار ریزی به نام اتم که قابل مشاهده و تجزیه نیستند تشکیل شده است. همچنین اوگفت اتم های مواد مختلف شکل های متفاوتی دارند. اما ارسطو این نظر را به دلیل اعتقادش به اینکه ماده بی اندازه می تواند تقسیم شود، نپذیرفت. رابرت بویل در سال ۱۶۶۱ و نیوتن در سال ۱۶۸۷ این نظریه (وجود اتم) را قبول کردند. در قرن هیجدهم بسکوویچ بیان کرد اتم ها نقاطی هستند که با توجه به فاصله شان، نیروهای دافعه یا جاذبه به هم وارد می کنند.
بالاخره در اوایل قرن نوزدهم جان دالتون با استفاده از دو نظریه قانون پایستگی جرم و قانون نسبت های معین نظریه اتمی را مطرح کرد.

قانون پایستگی جرم
قانون پایستگی جرم در سال ۱۷۸۹ توسط آنتوان لاوازیه این طور بیان شد : وقتی یک واکنش شیمیایی در یک سیستم بسته انجام می شود جرم مواد ثابت می ماند. نه ماده ای تولید می شود و نه ازبین می رود، فقط از شکلی به شکل دیگر تبدیل می شود. جرم مواد واکنش دهنده با جرم محصولات برابر است.
قانون نسبت های معین
این قانون در سال ۱۷۹۹ توسط جوزف پروست این طور بیان شد : وقتی عناصر ترکیب شیمیایی به وجود می آورد این ترکیب شدن عناصر با نسبت های معینی است. به بیانی دیگر اگر ترکیب را به عناصر تشکیل دهنده تقسیم کنیم، بین جرم عناصر نسبت معین و مشخصی وجود دارد. برای مثال دی اکسید کربن با نسبت های معینی از کربن و اکسیژن، (یک اتم کربن و دو اتم اکسیژن) تشکیل شده است.
نظریه دالتون
جان دالتون شیمی دان و فیزیک دان انگلیسی بود که نظریه اتمی خود را در سه بند توضیح داد.
۱- همه عناصر شیمیایی از ذرات بسیار ریزی که تجزیه ناپذیر هستند تشکیل شده است. این ذرات اتم نامیده می شوند. در حین واکنش های شیمیایی نه اتمی به وجود می آید و نه اتمی از بین می رود و اتم های هیچ عنصری به اتم های عنصر دیگر تبدیل نمی شوند.
۲- اتم های یک عنصر از نظر خواص (جرم و دیگر ویژگی ها) یکسان و اتم های عناصر مختلف، با همدیگر متفاوت هستند.
۳- هر ترکیب شیمیایی از دو یا چند عنصر تشکیل شده که با نسبت مشخصی با هم ترکیب شده اند. یعنی عناصر با نسبت های ساده و ثابتی باهم ترکیب می شوند.
ولی با گذشت زمان با شکافت هسته ای اتم که به ذرات کوچکتر تجزیه و تقسیم شد، قانون اول دالتون نقض شد. همچنین می دانیم اتم از الکترون، پروتون و نوترون تشکیل شده است. در قانون دوم، دالتون گفت: همه اتم های یک عنصر جرم یکسانی دارند اما امروزه می دانیم که همه اتم های عناصر جرم های متفاوتی دارند که ایزوتوپ های آن عناصر نامیده می شوند (نقض قانون دوم). ولی میشه این طور بیان کرد که همه اتم های یک عنصر خواص شیمیایی یکسانی دارند. با این همه نظریه اتمی هیچ وقت کنار گذاشته نشد.
قانون نسبت های چندگانه
بر اساس این نظریه دالتون توانست قانون نسبت های چندگانه را بیان می کند. طبق این قانون اگر دو عنصر ترکیب های مختلفی تشکیل دهند، جرم عنصر دوم ثابت باشد، جرم عنصر اول با دومی نسبت های صحیح و کوچکی دارد.
کشف الکترون
مایکل فارادی وقتی اولین لوله کاتدی را اختراع کرد، با عبور جریان الکتریکی از داخل لوله های شیشه ای بدون هوا پرتوهای کاتدی کشف شد. پرتوهای کاتدی از قطب منفی (کاتد) تابش می کند و مسیر آن ها با مواد فسفرسانس شناسایی می شود. یکی از خواص این پرتوها این است که در مسیر مستقیم حرکت می کنند و خاصیت دیگرشان این است که در حضور میدان های الکتریکی با ایجاد اختلاف پتانسیل الکتریکی از قطب منفی (کاتد) به قطب مثبت (آند) حرکت می کنند. از این خصوصیات پرتوهای کاتدی، تامسون به این نتیجه رسید که این پرتوها ذراتی با بار منفی هستند که تحت تاثیر میدان قرار گرفتند. به این ترتیب تامسون به وجود الکترون پی برد.
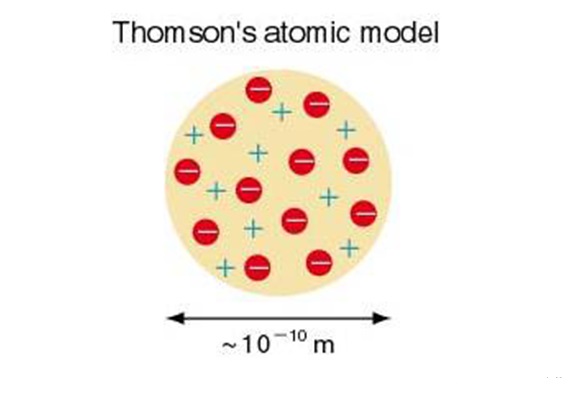
مدل اتمی تامسون
بعد از کشف الکترون بود که تامسون مدل کیک کشمشی یا هندوانه ای خود را بیان کرد. او گفت: اتم از بار الکتریکی منفی (الکترون) و بار الکتریکی مثبت تشکیل شده که به طور یکسان و یکنواخت در آن قرار گرفتند. الکترون به تمثیل کشمش داخل کیک و بار مثبت در نقش کیک قرار دارد. آزمایش رادرفورد مدل اتمی تامسون را نقض کرد.
کشف پروتون و بیان مدل اتمی رادرفورد
ارنست رادرفورد با آزمایش معروف خود نظریه اتم هسته دار را مطرح کرد. در این آزمایش رادرفورد با ذرات α صفحه ای از طلا را بمباران کرد. او پشت صفحه طلا صفحه ای از سولفید روی گذاشته بود و محل برخورد ذرات را مورد بررسی قرار داد. او مشاهده کرد بیشتر ذرات α از صفحه طلا عبور کردند، برخی از ذرات انحراف کمی داشته و برخی دیگر انحراف زیادی داشته اند. بعضی از ذرات نیز از مسیر برگشت خورده اند.
مدل اتمی رادرفورد
بر طبق این نتایج رادرفورد اظهار داشت در اتم بارهای مثبت در فضایی بسیار کوچک در مرکز اتم نگهداری شده اند و بیشترین جرم اتم در همین بخش است. اما ماهیت هسته مشخص نبود.
این هسته مثبت توسط بارهای منفی یعنی الکترون ها که در مسیر دایره ای و ثابت در حال حرکت هستند احاطه شده است. او نام این مسیرهای دایره ای را مدار نامید.
همچنین مجموع بارمثبت هسته و بار منفی الکترون ها با هم برابر است و با نیروی الکتروستاتیکی قوی کنار هم قرار گرفتند.

کشف نوترون
جیمز چادویک در سال ۱۹۳۳ ذرات خنثی که از هسته اتم تابش می شدند را کشف کرد که نوترون کشف شده مدل اتمی را کامل کرد.
مدل اتمی بور
اشکالی که مدل اتمی رادرفورد داشت این بود که الکترون ها با چرخش به دور هسته از خود امواج الکترومغناطیس منتشر کرده و انرژی از دست می دهند و خیلی زود روی هسته سقوط خواهند کرد. اما اتم پایدار است. پایداری اتم با نظریه نیلز بورکه از کشف تئوری کوانتوم توسط ماکس پلانک و آلبرت انیشتین استفاده کرده و نظریه خود را مطرح کرد، توضیح داده شد. او بیان کرد که الکترون ها در مسیرهای دایره ای در سطوح انرژی مشخصی در اطراف هسته در حال چرخش هستند و این مسیرهای دایره ای اوربیتال نام دارند. سطوح انرژی با اعداد n (اعداد کوانتومی) مشخص می شوند. سطوح انرژی که نزدیک هسته هستند نسبت به سطوحی که از هسته دورند انرژی کمتری دارند و الکترون ها می توانند بین این سطوح با دریافت یا انتشار انرژی جابه جا می شوند. این مقدار انرژی الکترون ها کوانتیده است.

اشکالات مدل اتمی بور و معادله شرودینگر
مدل اتمی بور فقط می توانست طیف خطی هیدروژن را توضیح دهد و طیف های اتم هایی که بیش از یک الکترون داشتند با مدل بور قابل توصیف نبودند. همچنین پیشرفت و گسترده کردن مدل بور با توجه به اصل عدم قطعیت هایزنبرگ ممکن نبود. این اصل بیان می کند که در یک لحظه اندازه گیری همه کمیت های یک الکترون (محل دقیق و همچنین سرعت الکترون) امکان پذیر نیست. یعنی مسیر دقیق یک الکترون را نمی توان در اتم پیش بینی کرد.
تا اینکه معادله شرودینگر الکترون را بر اساس خصلت موجی توصیف کرد. این معادله توانست بسیاری از طیف های مختلف عناصر را توضیح دهد. اگر الکترون هیدروژن را در این معادله حل کنیم توابع به دست آمده هر کدام مربوط به یک تراز انرژی از این الکترون است که در آن حضور دارد. مکس بورن کسی بود که گفت تابع موج شرودینگر حالات احتمالی الکترون و نه خود الکترون را توصیف می کند. بر این اساس نظریه دوگانگی موج که الکترون هم به صورت ذره عمل می کند و هم به صورت موج رفتار می کند بیان شد. حضور الکترون در نظریه مدل کوانتومی اتم فقط بر اساس احتمالات است.
مدل کوانتومی اتم
طبق این نظریه اتم از یک هسته (متشکل از پروتون و نوترون) در مرکز اتم و الکترون هایی که در اطراف هسته در سطوحی با انرژِی مشخصی در حال حرکت هستند. حرکت الکترون ها در فضای مشخصی در اطراف هسته که احتکال حضور الکترون در آن بیشتر است انجام می شود، این فضا اوربیتال نام دارد. هر کدام از این اوربیتال ها که تراز انرژی الکترون ها هستند از چند زیر لایه که دارای انرژی های یکسانی هستند تشکیل شده است. همان طور که در این مقاله اشاره شد لایه ها با عدد کوانتومی اصلی n و زیر لایه ها با عدد کوانتومی فرعی L (s، p، d، f) نشان داده می شود. اوربیتال s دایره ای و اوربیتال d دمبلی شکل است.
نظریه دانشمندان در مورد اتم
نظریه اتمی این مفهوم علمی است که ماده از واحدهای مجزایی به نام اتم تشکیل شده است. این سنگ بنای شیمی است که ساختار، خواص و رفتار همه مواد را توضیح می دهد. با درک اتمها، ما اسرار دنیای مادی، از هوایی که تنفس می کنیم تا فناوری هایی که استفاده می کنیم را درک می کنیم.
نظریه اتمی این ایده است که ماده از واحدهای کوچکی به نام اتم تشکیل شده است. هنگامی که دموکریتوس فیلسوف یونان باستان در قرن پنجم قبل از میلاد این ایده را مطرح کرد، در ابتدا به معنای اشاره به واحدهای تقسیم ناپذیر بود. در سال ۱۸۹۷، دانشمند بریتانیایی تامسون کشف کرد که اتم ها در واقع از ذرات کوچکتری تشکیل شده اند. امروزه، این نظریه به این اشاره دارد که ماده از واحدهایی تشکیل شده است که فقط در بعضی مواقع غیرقابل تقسیم هستند. موارد استثنا شامل پلاسماها، مانند آتش، سایر آرایش های یونی، مانند مواردی که در بدن یافت می شوند، مواد رادیواکتیو و بسیاری موارد دیگر هستند.
اگرچه امروزه نظریه اتمی سنگ بنای آشنای علم مدرن است، مانند نظریه میکروب یا تکامل، در بیشتر تاریخ بشریت، مردم بر این باور بودند که ماده احتمالاً پیوسته است و میتواند به صورت دلخواه به مقادیر کوچک تقسیم شود. تا سال ۱۸۰۳، یا احتمالاً کمی قبل از آن، شیمیدان انگلیسی جان دالتون ایده قدیمی را احیا کرد و از آن برای حل مسائل مختلفی که شیمیدانان در آن زمان با آن دست و پنجه نرم می کردند، استفاده کرد. نظریه اتمی دالتون دارای پنج نکته اصلی بود:
- تمام مواد از ذرات کوچکی به نام اتم تشکیل شده است.
- همه اتم های یک عنصر معین با یکدیگر یکسان هستند.
- همه اتم های یک عنصر معین با اتم های سایر عناصر متفاوت هستند.
- اتم های یک عنصر با عناصر دیگر ترکیب می شوند و ترکیباتی را ایجاد می کنند. آنها همیشه در مقادیر مساوی ترکیب می شوند.
- اتم ها را نمی توان ایجاد کرد، تقسیم کرد و یا نابود کرد.



















