مدل کوانتومی برای اتم چیست؟ – مفهوم اعداد کوانتومی
مدل کوانتومی برای اتم را اولین بار دانشمندی اتریشی به نام اروین رودولف شرودینگر در سال ۱۹۲۶ ارائه کرد. شرودینگر عقيده داشت الکترون ها در فضایی با نام اوربیتال و با ابعادی سه بعدی قرار گرفته اند. در این مقاله نشریه جهان شیمی فیزیک به معرفی مدل کوانتومی برای اتم می پردازیم.
مدل کوانتومی برای اتم
برای یک اتم مدل های متعددی تعریف شده است که مقبول ترین آن مدل کوانتومی برای اتم است. در این مدل، الکترون تنها مقدار معینی از انرژی را می تواند دریافت کند.
پیرامون هسته مدارهای وجود دارند که الکترون ها در آن ها قرار گرفته اند. هر مداری که از هسته اتم دورتر باشد انرژی بیشتری نسبت به مدارهای نزدیک هسته دارد.
هر لایه (مدار) شامل تعدادی زیرلایه است. با توجه به عدد لایه، زیرلایه خواهیم داشت. به عنوان مثال n= 1 شامل یک زیرلایه بوده و در n= 2 دو زیرلایه را خواهیم داشت و …
ذکر این نکته حائز اهمیت است که هر زیرلایه شامل چندین اوربیتال است. امکان وجود الکترون در این اوربیتال ها بسیار است.
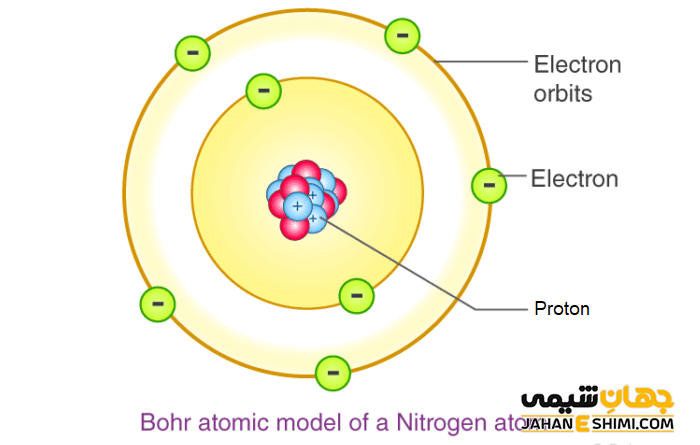
نکاتی در مورد مدل کوانتومی برای اتم
در مدل کوانتومی برای اتم، هسته در وسط اتم جای دارد و اتم نیز شکلی کروی دارد.
گرداگرد هسته و در مدارها، الکترون ها جای گرفته اند. شماره هر لایه با حرف n یا همان عدد کوانتومی اصلی معرفی شده است.
با این که الکترون ها در تمامی مناطق اطراف هسته هستند ولی در برخی مناطق اصلی، الکترون ها به نسبت، بیشتر حضور دارند که این مناطق پررنگ تر نمایش داده می شوند.
در مدل کوانتومی برای اتم، الکترون ها برای جا به جایی از یک لایه به لایه دیگر انرژی گرفته یا از دست می دهند. این شکل از گرفتن یا دادن انرژی به صورت کوانتومی انجام می پذیرد.
البته باید توجه داشت که الکترون ها به هنگام گرفتن یا از دست دادن انرژی قادر هستند فقط بر روی مدارها قرار بگیرند. این مسئله موید این مطلب است که کوانتومی بودن جذب و دفع انرژی به شکلی تدریجی انجام می پذیرد.
وقتی صحبت از رفتار موجی شکل الکترون می شود بدین معنی که با وجود ثابت ماندن جرم، مبادله انرژی انجام می پذیرد.
تعریف اوربیتال
فضای سه بعدی پیرامون هسته اتم که امکان وجود الکترون در آن بسیار بالاست، اوربیتال می گویند. هر اتمی احتمال داشتن چندین اوربیتال را دارد و این عدد با بالا رفتن تعداد الکترون افزایش می یابد.
همان گونه که برای تعیین وضعیت هر چیزی معیاری وجود دارد، برای تعیین وضعیت اوربیتال ها پیرامون هسته نیاز به داده هایی است. زیرلایه هایی که در لایه های الکترونی قرار گرفته اند خود شامل چندین اوربیتال هستند. باید تعیین شود که این اوربیتال ها در کدام لایه و زیرلایه قرار دارند.
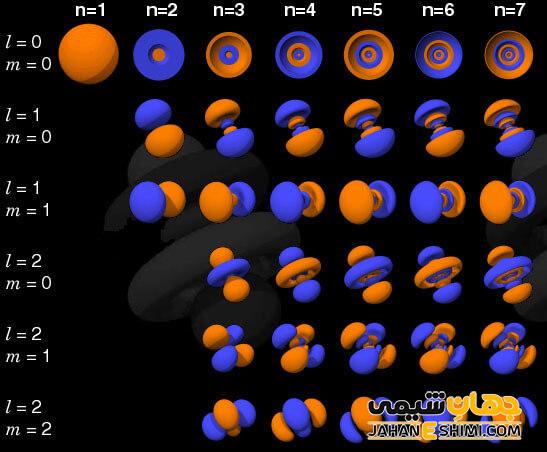
عدد n یا عدد کوانتومی اصلی نشانگر لایه های الکترونی است. l که همان عدد کوانتومی اوربیتالی است مختص زیرلایه ها است. عدد ml یا عدد کوانتومی مغناطیسی نیز بیانگر اوربیتال های درون زیرلایه هاست.
اعداد کوانتومی
شرودینگر برای تعیین اوربیتال ها از اعداد (n,l,m,s) بهره گرفته بود که بعدها این عددها به اعداد کوانتومی معروف گردید. به عبارتی ساده تر برای تعیین جایگاه الکترون پیرامون هسته از اعداد کوانتومی استفاده کرد، که n عدد کوانتومی اصلی، l عدد کوانتومی فرعی یا اوربیتالی و ml یک عدد کوانتومی مغناطیسی است. البته عدد کوانتومی اسپینی mS بعدها توسط دیگر دانشمندان به این اعداد افزوده شد. در زیر به شرح این اعداد به مختصر خواهیم پرداخت.
عدد کوانتومی n
در یک اوربیتال اتمی، اصلی ترین و اولین عدد کوانتومی، n می باشد. این عدد لایه ای که الکترون در آن قرار دارد را نشان می دهد. عدد کوانتومی n یک عدد صحیح و همواره مثبت است. هرگاه این عدد بالاتر برود فاصله الکترون و هسته افزایش می یابد، اوربیتال وسیع تر می شود و تراز انرژی مدار الکترونی نیز بالاتر می رود.
در آرایش الکترونی، در یونیزاسیون، طیف بندی الکترونی، در بار تاثیرگذار هسته، الکترونگاتیوی، ترازهای انرژی، در ویژگی های تقارنی یک ترکیب شیمیایی، در جا به جایی های الکترونی و در ترم های طیفی، عدد کوانتومی n در مطالعات همواره کاربرد دارد.
عدد کوانتومی اوربیتالی یا فرعی l
لایه های اصلی به یک یا چندین لایه فرعی قابل تقسیم اند که با n تعداد این لایه ها را مشخص می کنند.
مباحثی که عدد کوانتومی فرعی می تواند آن ها را تعیین کند، انواع اوربیتال، فرم اوربیتال ها (کروی یا دمبلی) و شمارش اوربیتال ها که از فرمول ۱+L2 پیروی می کند.
در لایه های فرعی چهار نماد داریم که هر کدام از آن ها دارای مقادیری می باشد. به عنوان مثال s نمادی است که مقدار لایه فرعی آن صفر است. نماد p مربوط به لایه فرعی ۱ است. برای لایه ۲ از نماد d استفاده می شود و لایه فرعی ۳ را با نماد f نمایش می دهند.
عدد کوانتومی مغناطیسی ml
سومین عدد کوانتومی از دسته اعداد کوانتومی، عدد کوانتومی مغناطیسی گویند. این عدد کوانتومی بازگوکننده این است که یک اوربیتال در محیط چگونه موضع گیری می تواند داشته باشد. میزان انرژی که در هر لایه الکترونی وجود دارد را با حرف m نشان می دهند. اوربیتال های لایه فرعی را نیز با حرف ml تعیین می کنند. این اعداد کوانتومی می توانند در برگیرنده تمامی اعداد بین +L الی -L شوند.
عدد کوانتومی مغناطیسی اسپین mS
چهارمین عدد از اعداد کوانتومی، عدد کوانتومی اسپین است که با حرف s نشان داده می شود. حرکت زاویه ای الکترون باعث به وجود آمدن اثر مغناطیسی می شود. افزون بر این، چرخش الکترون ها حول محور خود می تواند شبیه عملکرد یک مغناطیس کوچک باشد. به همین دلیل می گوییم الکترون دارای یک اسپین است.
معادلات شرودینگر
شرودینگر با این معادله نشان می دهد که حالت کوانتومی یک سیستم فیزیکی در هر زمان چگونه تغییر خواهد داشت. این معادله افزون بر تعریف مولکول ها، اتم ها و ذره های زیراتمی به تشریح سامانه های ماکروسکوپی نیز می پردازد. در واقع این معادله تعریفی از کنش های موجی ذرات است. این معادله همان عملی که قانون دوم نیوتن در فیزیک کلاسیک برعهده دارد را، در فیزیک کوانتوم ایفا می کند. معادله شرودینگر با توجه به کنش موجی و دوگانه الکترون ها معرفی شد.



















