مفهوم برانگیختگی در شیمی چیست؟ – تفاوت آن با حالت پایه
مفهوم برانگیختگی در شیمی به مرحله تبدیل تدریجی اتم از حالت پایه به حالت برانگیخته با جذب انرژی توسط الکترون های اتم را می گویند. به عبارتی ساده تر برانگیختگی در شیمی زمانی اتفاق می افتد که اتم انرژی را دریافت کرده و حالت پایداری خود را از دست دهد. در چنین حالتی وقتی اتم انرژی خود را از دست می دهد برای مدت زمان خیلی کوتاهی یک فوتون منتشر خواهد کرد و دوباره به همان حالت پایدار برمی گردد. در این مقاله نشریه جهان شیمی فیزیک به مفهوم برانگیختگی در شیمی می پردازیم.
حالت برانگیخته چیست؟
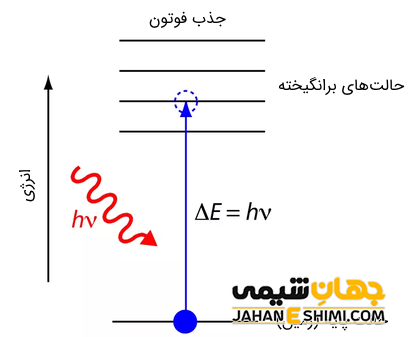
وقتی انرژی یک مجموعه یا سیستم در مقایسه با حالت پایه آن افزایش یابد، الکترون پس از گرفتن انرژی از حالت پایه به حالت برانگیخته (لایه بالاتر) خیز برمی دارد. انرژی در همه حالات برانگیخته بیشتر از انرژی حالت پایه است. به عبارتی الکترون با گرفتن انرژی از سطح انرژی پایین تر به سطح انرژی بالاتر منتقل می شود.
انرژی برانگیختگی
به کمترین انرژی که برای برانگیخته شدن یک الکترون از حالت پایه به حالت برانگیخته (هر حالت) لازم است را انرژی برانگیختگی می گویند. این مقدار انرژی برابر با اختلاف انرژی بین دو سطح و لایه الکترونی است.
حالت پایه چیست؟
حالت پایه یا حالت خلا، حالتی که در آن سیستم دارای حداقل انرژی است.
تفاوت بین مفهوم برانگیختگی در شیمی و حالت پایه
حالت اتم اصطلاحی است که جابجایی و عبور الکترون ها در آن باعث می شود ترازهای انرژی تغییر کنند. طول عمر حالت پایه بیشتر از حالت برانگیخته است ولی انرژی حالت برانگیخته بیشتر از انرژی حالت پایه می باشد. حالت برانگیخته به علت از دست دادن سریع انرژی از حالت پایه ناپایدارتر است.
نکاتی درباره مفهوم برانگیختگی در شیمی
الکترون های حالت برانگیخته مایل به از دست دادن انرژی و جهش به حالت های برانگیخته پایین تر و در نهایت پایه هستند به همین دلیل دارای طول عمری کوتاه تری می باشند. به عبارتی الکترون ها مدت زمان زیادی در حالت برانگیخته دوام نمی آوردند و به همان حالت پایه برخواهند گشت. البته ممکن است برخی حالت های برانگیخته تا ۱۰ میلیون سال عمر داشته باشند.
هر اتم دارای چند حالت برانگیخته است، اولین حالت نزدیکترین آن به هسته اتم است که کمترین انرژی را نسبت به حالت های دیگر دارد. حالت دوم برانگیخته، حالت بعد از اولین حالت است که انرژی بیشتری نسبت به آن دارد.
جرم و سرعت الکترون به هنگام برانگیخته شدن اتم هیچ تغییری نمی کند، حتی وقتی که یک لایه بالاتر می روند یا به لایه قبلی برمی گردند. الکترون تا زمانی که انرژی دارد در لایه جدیدش باقی می ماند و با کمتر شدن انرژی به حالت قبلی برمی گردد.
تئوری نیلز بور
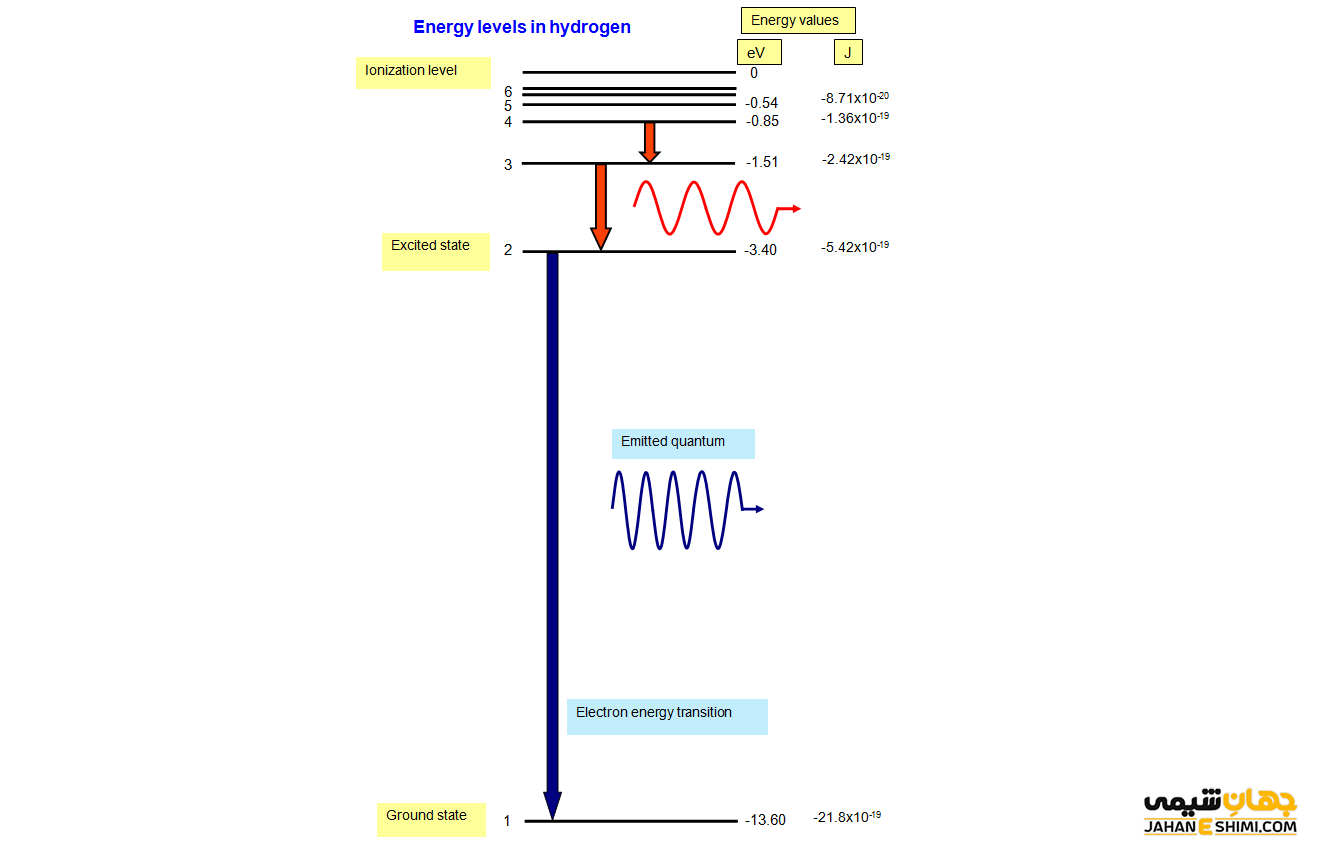
نیلز بور دانشمند دانمارکی برای ترکیب الکترونی هیدروژن نظریه ای معرفی کرد که به تبیین طیف انتشار خطی هیدروژن می توانست کمک کند (هرچند او قادر به توجیه طیف نشر خطی سایر عناصر نبود). طبق این تئوری، الکترون ها در مسیر و لایه های مشخصی با نام تراز و مانند سیاراتی که دور خورشید می چرخند، به دور هسته می گردند. او معادله هایی به دست آورد که در آن با نام گذاری ترازها با عدد ( …۱،۲،۳) و حرف (…،k,l,m) پرداخت.
طبق تئوری این دانشمند، الکترون ها قادر به این نیستند که برای مدت زمان معینی بین دو مدار بمانند. هرچند که آن ها می توانند مدت زمان زیادی را در یک لایه و یا لایه ای دورتر حرکت کنند. او معتقد بود هنگامی که الکترون ها از یک لایه به لایه ای دیگر جابه جا می شوند انرژی آن ثابت نمانده و تغییر می کند که به آن کوانتوم انرژی می گویند. به عبارتی ساده تر الکترونی که از یک لایه به لایه ای بالاتر جا به جا می شود، بسته های مشخصی از انرژی را دریافت یا منتشر خواهد کرد یعنی هر چقدر انرژی بیشتری دریافت شود الکترون ها قادر خواهند بود به لایه های بالاتری صعود کنند.
لایه های الکترون
در سال ۱۸۹۷ دانشمندی به نام جورف تامسون با انجام آزمایش های متعددی به کشف الکترون دست یافت. الکترون ها با علامت e– نمایش داده می شود.
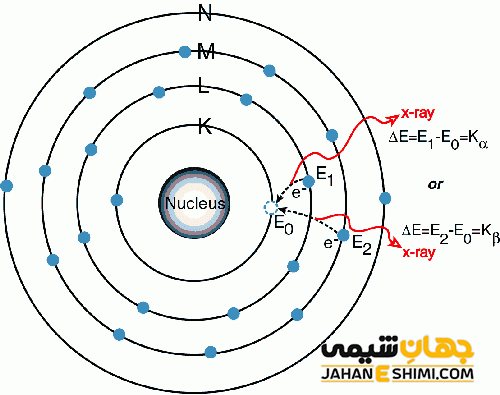
لایه های پیرامون هسته اتم را لایه الکترونی می گویند. این لایه ها با نام هایی چون مدار الکترونی و تراز الکترونی نیز شناخته می شوند. هر لایه یا مدار می تواند تعداد مشخصی الکترون داشته باشد. اولین لایه نزدیکترین آن به هسته اتم است که نهایت دو الکترون ظرفیت دارد. لایه های بعدی لایه دوم، سوم و به همین ترتیب تا هفت لایه می توانیم متصور بود. با دور شدن از هسته اتم پایداری الکترون ها کمتر می شود. دلیل این امر کاهش اثربخشی جاذبه هسته است.
آرایش الکترونی اتم در حالت برانگیخته
در این وضعیت، جابه جایی الکترون های لایه ظرفیت از اوربیتال های پر به اوربیتال های خالی انجام می گیرد. این حالت باعث می شود یک اتم چندین ظرفیت داشته باشد.
اتم های برانگیخته
الکترون ها در هر لایه یا مدار دارای انرژی و آرایش مشخصی هستند و در اتم ثبات تقریبی برقرار است، به چنین حالتی به اصطلاح حالت پایه گفته می شود.
با دور شدن از هسته، انرژی الکترون ها بیشتر می شود. در صورتی که این اتم ها انرژی دریافت کنند، الکترون های آن ها انرژی را گرفته و به لایه های بالاتر جابه جا می شوند. به این اتم ها، اتم های برانگیخته گفته می شود. هرچند که این اتم ها از انرژی زیادی برخوردارند ولی هیچ ثباتی ندارند و همین مسئله باعث می شود مجدد انرژی خود را از دست داده و به همان پایداری سابق رسیده و به حالت پایه برگردند.
هنگام عقب نشینی الکترون به حالت پایه (اولیه)، به علت از دست دادن انرژی، نوری با طول موجی مشخص منتشر می کنند. پس می توان علت به وجود آمدن باند رنگی در طیف انتشار نواری (خطی) هر عنصر را در اتلاف انرژی توسط الکترون و برگشت آن ها از مدارهای بالایی به مدارهای پایینی، جستجو کرد. این انرژی به عدد اتمی بستگی دارد و خاص همان اتم است، پس هر عنصری دارای طیف نشر نواری مخصوص به خود است.
حالت شبه پایدار چیست؟
حالت شبه پایدار به حالتی می گویند که در آن عمر حالت های برانگیخته طولانی تر باشد. به عبارتی در این حالت تا وقتی انگیزش خارجی وجود نداشته باشد الکترون ها به لایه های پایین تر نخواهند رفت و این اتفاق باعث می شود حالت های برانگیخته تا حدودی ثابت بمانند. ایزومرهای هسته ای از این نوع حالت ها هستند.
چگونگی تشخیص حالت برانگیخته
اگر بخواهیم حالت برانگیخته یک الکترون را تشخیص بدهیم لازم است آن را با حالت پایه مورد مطابقت قرار دهیم، در صورتی که الکترون ها به اوربیتال بالایی جا به جا شوند پیش از این که اوربیتال پایین تر را بتوانند پر کنند. در این حالت می توان گفت که اتم برانگیخته شده است.



















