جدول تناوبی جایگزین (جدول گام چپ ژانت) چیست؟ | آموزش کامل به زبان ساده
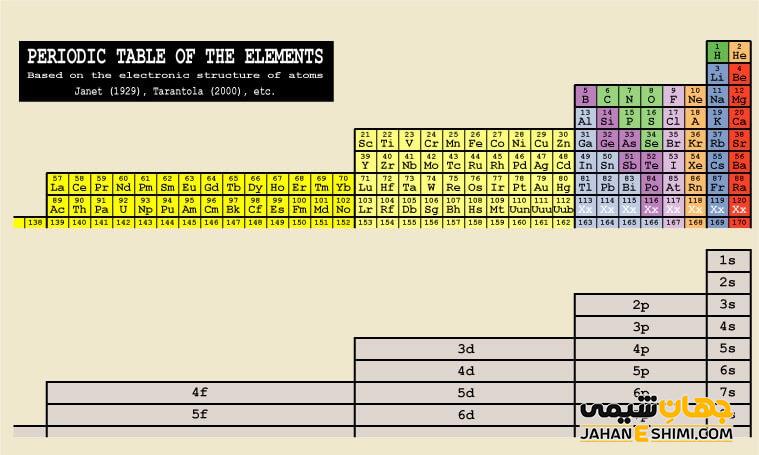
به جدول تناوبی که در خلاف جهت عقربه های ساعت چرخیده باشد و شکل آن ستونی شده باشد، جدول تناوبی جایگزین گفته می شود که به نام جدول گام چپ ژانت نیز خوانده می شود. در این جدول، گروه هایی که در سمت پایین تر جدول تناوبی بودند، در سمت چپ قرار گرفته و افزایش اعداد آن به سمت راست است. جدول تناوبی جایگزین در مقایسه با جدول تناوبی اصل، طول بلندتری دارد. در این جدول، عناصر گروه اول و دوم به سمت راست منتقل شده اند. مقاله نشریه جهان شیمی فیزیک حاضر ما را با جدول گام چپ ژانت، فواید و معایب آن آشنا می کند.
تحقیق درباره جدول تناوبی جایگزین
شارل ژانت شیمیدان معروف فرانسوی و زیست شناس بزرگی بود که کلکسیونی با بیش از ۴۰۰۰۰۰ فسیل داشت. این شیمیدان در سال ۱۹۲۷، عناصر جدول تناوبی را با الگویی دیگر در کنار هم قرار داد. در این الگو عناصر با اعداد اتمی بزرگتر از ۱۱۸ نیز طبقه بندی می شوند. جدول تناوبی امروزی حاصل تلاش های فراوان دیمیتری مندلیف است که در زمان او، این جدول بر اساس افزایش جرم اتمی مرتب شده بود. اما با فعالیت های موزلی و تنظیم جدول تناوبی بر اساس اعداد اتمی توسط او، بسیاری از نارساهایی که در این جدول حاکم بود، برطرف شد.
به مرور زمان عناصری که جای آن ها در جدول تناوبی خالی بود، کشف شده و در خانه های مربوط به خود قرار گرفتند. اما عناصری با اعداد اتمی بالاتر از ۱۱۸ مانند ۱۲۰ و ۱۲۱ در جدول تناوبی به شکل امروزی، جایی ندارند. این عناصر در آزمایشگاه ها و به طور مصنوعی ساخته شدند. اما جدول تناوبی ارائه شده توسط شارل ژانت، با این که ۵۰ سال پیش تنظیم شده است، این عناصر را که اوربیتال های s و g آن ها در حال پر شدن از الکترون هستند را در خود جای می دهد.
تاریخچه جدول تناوبی یا جدول مندلیف
قبل از این که درباره جدول جایگزین شارل ژانت صحبت کنیم ابتدا مروری بر تاریخچه جدول تناوبی انجام می دهیم. با این که جدول تناوبی امروزی به نام شیمیدان روسی به نام دیمیتری مندلیف است، اما لوتر مایر نیز به طور مستقل در حال مطالعه روی این جدول بود. جدولی که او تنظیم کرد از ۲۸ عنصر تشکیل شده و در سال ۱۸۶۴ ارائه شد. جدول این دانشمند بر اساس والانس تنظیم شده بود و او هیچ گاه به تصحیح وزن اتمی نرسیده و نظریه ی پیش بینی عناصر کشف نشده را بیان نکرد.
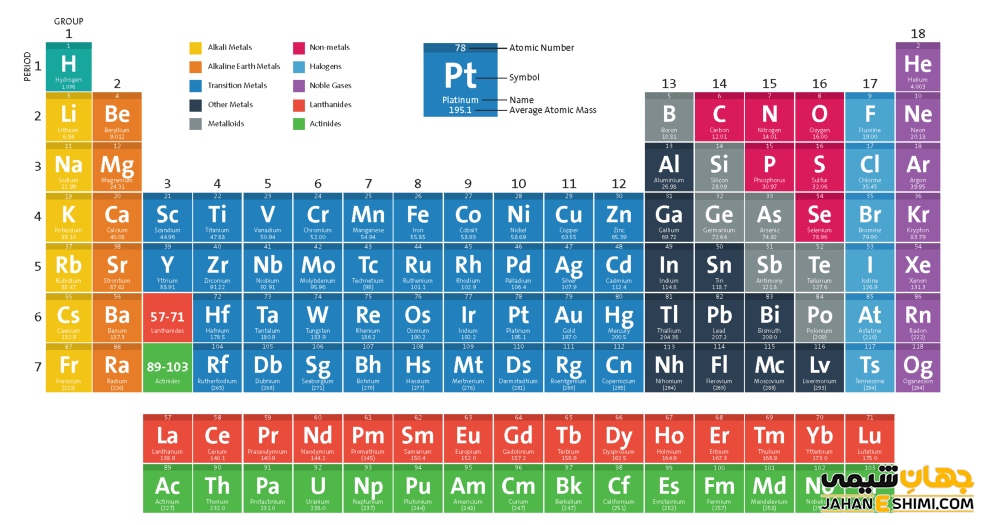
با این که برخی از افراد مندلیف و مایر را به عنوان تنظیم کنندگان مشترک جدول تناوبی می دانند، ولی در کل خیلی از افراد اعتقاد به تنظیم این جدول توسط مندلیف به تنهایی هستند. ایده ی پیش بینی عناصر کشف نشده، مهمترین دلیلی بود که چون توسط مندلیف ارائه شد، سهم خلق این جدول بیشتر به او تعلق گرفت. بعدها کشف این عناصر، تمام پیش بینی ها این دانشمند بزرگ روسی را تایید کرده و دانشمندان حاضر را تحت تاثیر قرار می داد.
کشف هنری موزلی
هنری موزلی دانشمند بزرگی بود که توانست رابطه ی بین طول موج پرتو X عناصر و اعداد اتمی آن ها را بیان کند. بر این اساس تنظیم جدول تناوبی به صورت جدیدتر توسط موزلی تنظیم شد. او این جدول را بر پایه اعداد اتمی تنظیم کرد که نشان داد که این اعداد پایه اندازه گیری تجربی هستند. در این جدول موزلی نشان داد که به عنوان مثال، با این که آرگون دارای وزن اتمی بیشتری نسبت به پتاسیم است ( ۳۹,۹ در مقایسه با ۳۹,۱)، ولی طول موج های پرتو X نشان می دهد که آرگون با عدد اتمی ۱۸ قبل از پتاسیم با عدد اتمی ۱۹ قرار می گیرد.
تنظیم جدول بر اساس عدد اتمی با خواص شیمیایی عناصر متطابق بود. هر عنصری که با توجه به عدد اتمی در یک دسته قرار می گرفت، از نظر خواص شیمیایی با عناصر آن گروه مشابه بود. به عنوان مثال در جای گذاری عناصر مثال بالا، آرگون یک گاز نجیب بوده و پتاسیم یک فلز قلیایی است. با این تنظیم بندی موارد مشابه دیگری که در جدول مندلیف، استثنا بودند، در جای خود قرار گرفتند و کاملا درست بودند. به عنوان مثال کبالت قبل از نیکل و تلوریم قبل از ید قرار گرفت و بدون توجه به وزن اتمی، قرار گیری آن ها توسط موزلی توضیح داده شد.
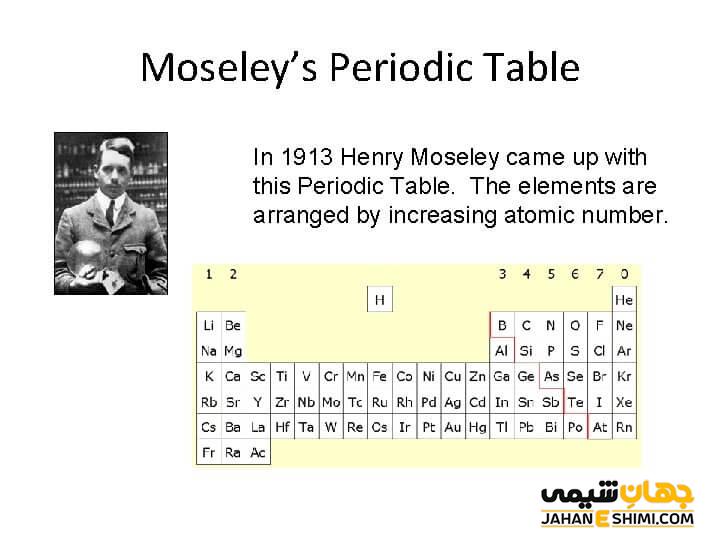
همچنین فضاهای خالی مربوط به خانه های ۴۳ و ۶۱ نیز امروزه با تکنسیم و پرومتیم جایگذاری شدند. با این که این عناصر رادیواکتیو بوده و به طور مصنوعی در آزمایشگاه ها ساخته می شوند. موزلی مانند مندلیف، جاهای خالی را برای عناصر کشف نشده تعیین پیش بینی کرد.
تحقیقات سیبورگ گلن
در سال ۱۹۴۳، گلن سیبورگ در جداسازی امریسیم و کوریم با مشکلی مواجه شد. او با انجام تحقیقات متوجه تفاوت شیمیایی این دو عنصر به سری های متفاوت شد. به طوری که با توجه به این تفکرات، او برخلاف آنچه که همکارانش به او توصیه کردند، در سال ۱۹۴۵ پیشنهاد داد که باید تغییری مهم در جدول تناوبی به وجود آید. تغییر بزرگ سیبورگ نظریه آکتینید بود. طبق این نظریه، آکتینیدها یک سری گذار مشابه با لانتانیدها تشکیل می دهند. این نظریه درباره ساختار الکترونی عنصر سنگین بود. این نظریه امروزه کاملا مقبول است و در صورت های استاندارد مختلف جدول های تناوبی نشان داده می شود. این سری از عناصر شامل عناصر از آکتنیم تا لورنسیم بوده و تراز ۵f آن ها در حال پر شدن از الکترون است.

با گسترده کردن نظریه آکتینید سیبورگ، فرضیه وجود دو سری از عناصر، یکی عناصر فوق سنگین از اعداد اتمی بین ۱۰۴ تا ۱۲۱ و سری سوپر آکتینید که شامل عناصر با اعداد اتمی بین ۱۲۲ تا ۱۵۳ است.
شارل ژانت
با نگاه به جدول تناوبی امروزی می دانیم که عناصری که در یک ستون از جدول قرار گرفتند، آرایش الکترونی لایه ظرفیت آن ها یکی بوده و با یکدیگر، هم گروهی هستند. جایگاه عنصر مورد بحث در بالا (لارنسیوم) در قسمت پایین سمت راست بوده و بالای آن، عنصر لوتیتیم شماره ۷۱ است. به عبارتی این عنصر به عنوان آخرین عنصر آکتینیدها در زیر قسمت اصلی جدول قرار گرفته است. جایگاه اصلی لارنسیوم باید بین عناصر ۸۸ تا ۱۰۴ باشد. متخصصان شیمی و فیزیک، کشف این موقعیت را که چند دهه قبل بود، نادیده گرفتند.
تا این که شیمیدان بزرگ آمریکایی به نام شارل ژانت، اهل فرانسه، توانست جدول تناوبی را در اواخر دهه ۱۹۲۰ به صورت های مختلف ارائه دهد. او در سال ۱۸۴۹ در پاریس به دنیا آمد و بعد از طی دوران مدرسه مهندسی، به فعالیت در کارخانه قلم موی پدر خود مشغول شد. این کار به زودی او را به فرد ثروتمندی تبدیل کرد. اما این دانشمند بزرگ در دوران فراغت خود، فسیل جمع می کرد. همان طور که در بالا گفته شد نزدیک به ۴۰۰۰۰۰ فسیل گرد آوری کرده بود. وی مقالات علمی فراوانی را با مطالعه فسیل ها منتشر کرده و در زمینه های مختلف زمین شناسی، گیاه و حشرات به مطالعه پرداخت. جداولی که ژانت طرح ریزی کرد بر اساس نظم در الکترون هایی بود که هسته های اتم ها را در بر می گیرد.
جدول تناوبی جایگزین یا شارل ژانت
در سال ۱۹۲۹ شارل ژانت، جدول تناوبی را از راست به چپ تنظیم کرده و عناصر گروه فلزات قلیایی و قلیایی خاکی را در سمت راست جدول خود قرار داد. با توجه به اعداد کوانتومی و لایه های الکترونی، تنظیم جدول تناوبی ژانت و قرار گرفتن عناصر در آن، در سال ۱۹۳۰ ارائه شد. جدول تناوبی جایگزین تنظیم شده توسط ژانت، در سمت راست خود دارای عناصر دسته s و زیر هم بوده و ستون های ۳ تا ۹ این جدول نیز شامل عناصر دسته ی p هستند. در جدول ژانت می توان با توجه به آرایش الکترونی عناصر، آن ها را از اعداد اتمی ۱ تا ۱۷۰ در آن جاگذاری کرد.
در این جدول، وقتی زیرلایه s از الکترون پر می شود، یک دوره تمام می شود. طبق یک الگوی منظمی، از هر دو دوره اضافه شدن یک زیرلایه اتفاق افتاده و در دوره هفتم دسته f وارد می شود. اما دوره نهم پیش بینی می شود که زیرلایه g در حال پر شدن از الکترون باشد. با توجه به مطالبی که گفته شد جدول ژانت نه بر اساس دوره بلکه بر اساس نوع زیرلایه ها تنظیم شده است. در این جدول عنصر با عدد اتمی ۱۲۱ در سمت چپ جدول قرار می گیرد که زیرلایه g خواهد داشت.
نکاتی درباره جدول جایگزین یا جدول شارل ژانت
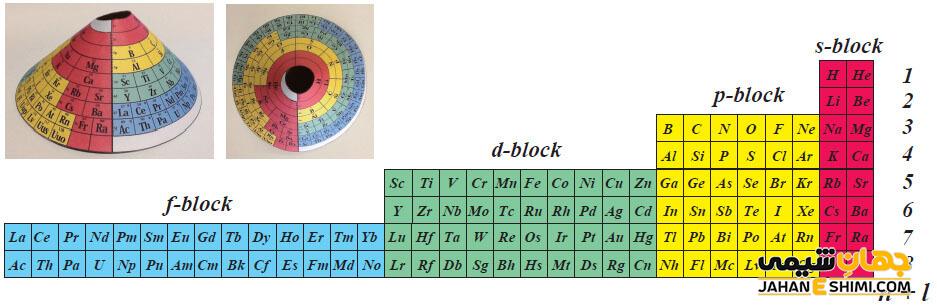
اولین نکته درباره جدول ژانت این است که این جدول از هشت دوره و ۱۴ گروه تشکیل شده است. دومین نکته در نحوه رسم آرایش الکترونی آن است که بعد از پر شدن زیرلایه ۸s، الکترون بعدی در زیرلایه ۵g قرار خواهد گرفت. همچنین در این جدول، ۹ اوربیتال وجود داشته و بیشترین ظرفیت الکترونی آن ۱۸ است.
تفاوت های جدول تناوبی بسط یافته با جدول تناوبی جایگزین
اولین تفاوت قرار گرفتن عناصر دسته s در سمت چپ جدول بسط یافته و در جدول ژانت در سمت راست جدول است. در جدول بسط یافته، شروع هر تناوب با زیرلایه s و اتمام آن با زیرلایه p بوده ولی در جدول ژانت، اتمام هر دوره با زیرلایه s است.
دومین تفاوت این دو جدول با این که هر دو با زیرلایه اول s شروع می شوند، ولی در جدول بسط یافته تنها دوره اول، یک زیرلایه s دارد اما جدول ژانت، دو دوره هستند که یک زیرلایه دارند. به طوری که در دوره اول هیدروژن و هلیم با زیرلایه ۱s و در دوره دوم لیتیم و بریلیم، زیرلایه ۲s پر می شود.
سومین تفاوت در زیرلایه p است که در جدول بسط یافته از دوره دوم و جدول ژانت از دوره سوم وارد می شود.
همچنین زیرلایه d که به عنوان زیرلایه سوم است در جدول بسط یافته از دوره چهارم و در جدول ژانت از دوره پنجم وارد می شود.
به همان ترتیب زیرلایه f به عنوان زیرلایه چهارم در جدول بسط یافته از دوره ششم و در جدول ژانت از دوره هفتم وارد می شود.
تفاوت بعدی در زیرلایه g به عنوان زیرلایه پنجم است که در جدول بسط یافته از دوره هشتم و در جدول ژانت از دوره نهم وارد می شود.
آخرین تفاوت، دو عنصری بودن دوره اول در جدول بسط یافته است که که در جدول ژانت، دو دوره اول و دوم، دو عنصری هستند. در دوره اول دو عنصر هیدروژن و هلیم وجود دارد که مشابه با جدول بسط یافته بوده ولی در دوره دوم، دو عنصر لیتیم و بریلیم هستند.
ویژگی های جدول ژانت
جدول ژانت دارای مزایایی است. به عنوان نمونه عناصر در این جدول به صورت پیوسته و بدون شکاف و فاصله از هم نمایش داده می شوند. اوربیتال های پر شده در این جدول از شکل رایج آن ها مشخص تر است. همچنین در این جدول به جهت این که زیرلایه g ورود می کند، دوره های هشتم و نهم وجود دارد که شامل عناصری با اعداد اتمی بالاتر از ۱۱۸ می شود. در جدول ژانت، قرارگیری عناصر در کنار یکدیگر، بر اساس قرار گرفتن الکترون ها در زیرلایه هاست. مرتب شدن جدول ژانت بر اساس افزایش عدد اتمی بوده و اصل آفبا در نحوه ی پر شدن جدول رعایت شده است.
معایب و اشکلات جدول ژانت
یکی از اشکالاتی که در این جدول وارد شده است، عدم وجود روند تناوبی از فلز به نافلز و انتقال آسان آن هاست. اشکال دیگر در این جدول، عدم قرارگیری هلیم در جایگاه اصلی خود به عنوان یک گاز نجیب است.



















